流行病学和病因
直肠癌是中国常见和高发疾病,好发于40岁以上人群。大部分直肠癌是散发病例,也可能源于某些遗传病,但仅约占5%的病因。直肠癌在西方国家是常见肿瘤,在中国发病率也逐年升高,其发病率和死亡率均排在前十位。散发性直肠癌的具体病因不明,主要与遗传因素、环境因素和生活方式有密切关系。直肠癌的症状在早期通常不明显且无特异性,随着肿瘤进展,常见的局部症状包括:大便习惯改变,如排便次数增多、便秘,以及大便性状的改变,如大便不成形、稀便,大便困难或大便带血,肛门疼痛或肛门下坠等。

直肠癌诊断
依据病史和临床表现,通过体格检查,肠镜、腹盆腔(平扫和增强)MRI和CT、胸部CT或者腹部超声等影像学检查明确局部病灶侵犯范围、淋巴结转移状态以及有无远地转移,准确获得肿瘤的TNM分期证据。
(1)体格检查:重点为直肠指诊,直肠指诊简单易行,是早期发现直肠癌的关键检查手段,一般可以发现距肛门7~8cm之内的直肠肿物。如果肿瘤位于直肠前壁:男性患者应明确肿瘤与前列腺的关系;女性患者应进行阴道双合诊,查明肿瘤是否侵犯阴道后壁。指诊应注意指套有无染血。
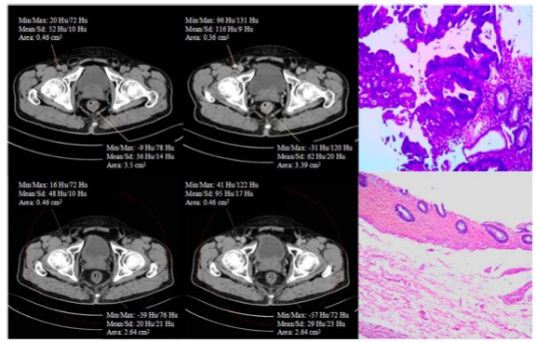
(2)影像学诊断:直肠MRI可以清楚地显示盆腔内软组织和脏器的毗邻关系,对直肠系膜筋膜受累、是否有外侵或盆腔淋巴结转移有更明确的判断。直肠腔内超声可区别累及黏膜和黏膜下层的局部肿瘤与浸润至固有肌层或者浸透肌层进入直肠周围脂肪的肿瘤。直肠腔内超声也可以帮助判断直肠周围淋巴结有无转移。CT有助于对远处转移病灶进行识别并判断肿瘤相关并发症(例如,穿孔、瘘管形成)。肝脏MRl通常仅用于CT扫描有可疑发现但不确定的患者,特别是需要更好地明确肝脏疾病负荷以决定是否需要肝脏切除手术时。
(3)病理学诊断:可通过肠镜获取病理组织。目前用于临床决策的因素包括:DNA错配修复(mismatch repair,MMR)蛋白的状态以及BRAF突变和RAS突变等。除与原发肿瘤相关的影像学、病理学、分子预后指标外,还需要对患者年龄、一般情况、合并症、营养状况、血生化、血常规、肿瘤标记物等进行相应检查和评估,为治疗方案选择和预后判断提供依据。

直肠癌分期
直肠癌分期采用第8版AJCC分期。
(1)直肠癌原发肿瘤(T)分期
Tx:原发肿瘤无法评价;
T0:没有原发肿瘤存在的证据;
Tis:原位癌,黏膜内癌(包括局限于固有层而没有浸透黏膜肌层者);
T1:肿瘤侵犯黏膜下层(浸透黏膜肌层但未进入固有肌层);
T2:肿瘤侵犯固有肌层;
T3:肿瘤浸透固有肌层到达结直肠旁组织;
T4:肿瘤穿透脏腹膜或直接侵犯邻近器官或组织;
T4a:肿瘤穿透脏腹膜(包括肿瘤肠穿孔和持续肿瘤浸润通过炎症区域到达脏腹膜表面);
T4b:肿瘤直接侵犯或粘连于邻近器官或结构。
(2)区域淋巴结(N)、临床N(cN)分期
Nx:区域淋巴结无法评价;
N0:无区域淋巴结转移;
N1:1~3个区域淋巴结转移(淋巴结内的肿瘤≧0.2mm)或任何数量的肿瘤种植(tumor deposit,TD)且所有的淋巴结都是阴性;
N1a:1个区域淋巴结转移;
N1b:2~3个区域淋巴结转移;
N1c:无区域淋巴结转移,但有肿瘤种植。浆膜下、肠系膜、无腹膜覆盖结肠/直肠周围组织内有肿瘤种植,无区域淋巴结转移;
N2:4个及以上的区域淋巴结转移;
N2a:4~6个区域淋巴结转移;
N2b:7个及以上的区域淋巴结转移。
(3)远处转移(M)分期
M0:无远处转移;
M1:有远处转移;
M1a:转移至单个部位或器官,无腹膜转移;
M1b:转移至2个或以上部位或器官,无腹膜转移;
M1c:腹膜转移或腹膜转移伴其他部位或器官转移。
(4)临床预后分期
0期:TisN0M0;
1期:T1-2N0M0;
Ⅱ期:T3-4N0M0;
ⅡA期:T3N0M0;
ⅡB期:T4aN0M0;
ⅡC期:T4bN0M0;
Ⅲ期:T任何N1-2M0;
ⅢA期:T1-2N1M0、T1N2aM0;
ⅢB期:T3-4aN1M0、T2-3N2aM0、T1-2N2bM0;
ⅢC期:T4aN2aM0、T3-4aN2bM0、T4bN1-2M0;
ⅣA期:T任何N任何M1a;
ⅣB期:T任何N任何M1b;
ⅣC期:T任何N任何M1c。

直肠癌治疗原则
对于早期直肠癌患者(T1-2N0M0),根治性手术是标准治疗。但接受局部切除者,进一步的治疗取决于术后病理结果:合并良好预后因素(高中分化、无淋巴血管浸润或无神经周围浸润、无黏蛋白产生、切缘阴性)的pT1期浸润性肿瘤,局部治疗后内镜监测是足够的;对于有预后不良因素的pT1期病变,甚至是pT2期病变,根治性手术是标准方法。
新辅助放疗的适应证主要针对Ⅱ/Ⅲ期中低位直肠癌:长程同步放化疗结束推荐间隔5~12周接受根治性手术;短程放疗联合即刻根治性手术(放疗完成后1周内手术)推荐用于可手术切除的T3期直肠癌。而短程放疗/同步放化疗联合新辅助化疗模式,则推荐用于含有高危复发因素的Ⅱ/Ⅲ期直肠癌。辅助放疗主要推荐用于未行新辅助放疗,术后病理分期为Ⅱ/Ⅲ期、高危复发的直肠癌患者。
具有同时性转移疾病的患者,治疗必须个体化,需确认转移灶是否潜在可切除以及原发肿瘤是否有症状。目前关于最佳治疗方法尚未达成共识,但全身化疗是Ⅳ期患者的基础治疗,可使生存期出现明显的改善。
低位直肠癌有强烈保肛意愿的患者,可建议先放化疗,如果肿瘤对放化疗敏感,达到临床完全缓解,可考虑等待观察的治疗策略。对于直肠病灶局部复发且切除困难,在之前未接受放疗的前提下,可考虑局部放疗使之转化为可切除病灶再行手术切除。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言