人表皮生长因子受体2(HER2)是受体酪氨酸激酶(RTK)的重要成员之一,其它还包括EGFR(HER1)、HER3和HER4。HER2受体通过与其他ERBB家族受体形成同源或异源二聚体而被激活,尤其与EGFR的异二聚体最稳定,因此,能够导致EGFR信号传导增强,促进肿瘤细胞不断分化、增殖和转移。HER2的致癌性激活可由HER2蛋白过表达、基因扩增或基因突变引起,能在多种恶性肿瘤中发生。在NSCLC中,HER2基因突变的患者生存期较一般患者短,这可能是由于此类患者对化疗药物不太敏感。

←doi: 10.21037/tlcr.2018.05.14.
↓doi: 10.1634/theoncologist.2018-0572.
doi:10.1038/nature25475
HER2篇概要
抗体-药物偶联物
1. T-DM1:HER2突变,ORR为44%,PFS为5个月
2. DS-8201:HER2突变,ORR为55%,PFS为8.2个月;HER2扩增,ORR为24.5%,PFS为5.4个月;注意间质性肺炎
酪氨酸激酶抑制剂
3. 吡咯替尼:HER2突变,一项研究ORR为19.2%,PFS为5.6个月;另一项研究ORR为31.7%,PFS为6.9个月;HER2扩增,ORR为22.2%,PFS为6.3个月
4. 阿法替尼:HER2突变,有效率低,可能需要筛选靶点
5. 达克替尼:有效率低
6. 波奇替尼:HER2突变,ORR为35.1%;EGFR ex20ins疗效差
7. TAK-788:HER2突变,疗效未知;EGFR ex20ins,ORR为43%
其他
8. 双靶+多西他赛:HER2突变,ORR为29%,PFS为6.8个月
9. Tarloxotinib:HER2突变,ORR为22%;EGFR ex20ins基本无效
10. U3-1402:治疗多药耐药EGFR突变患者(包括HER2突变),ORR为25%

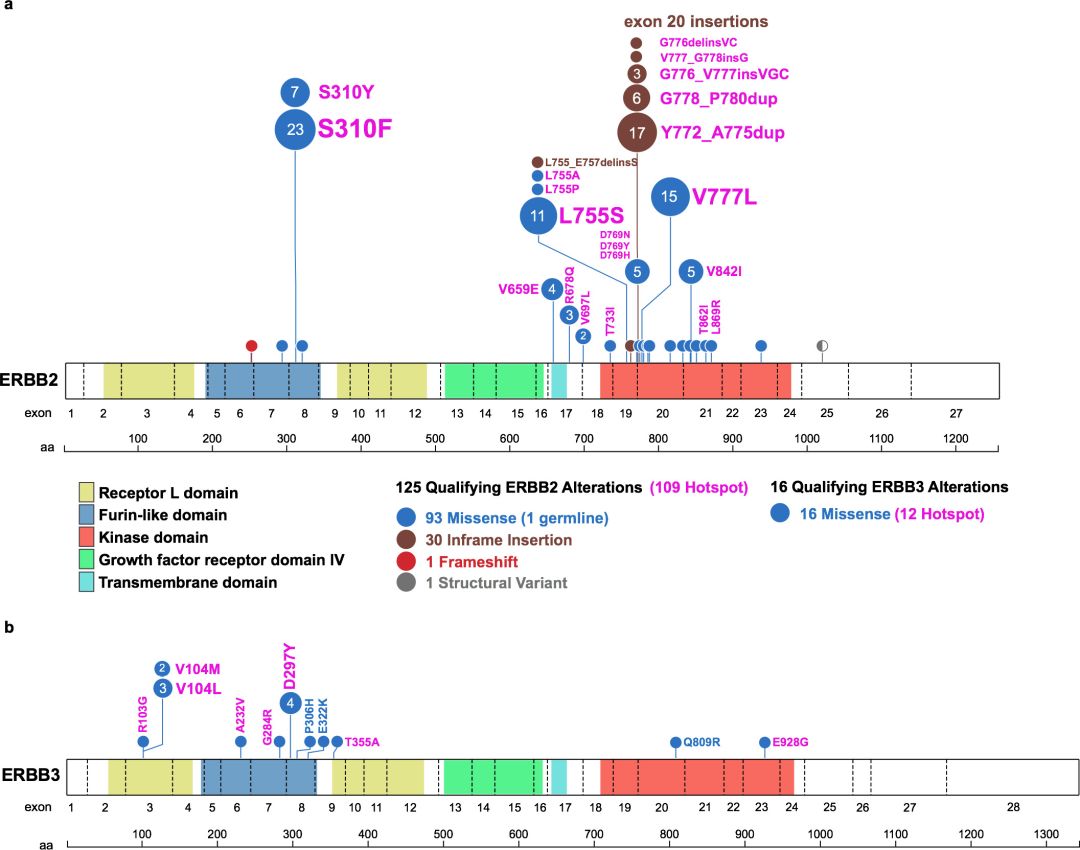
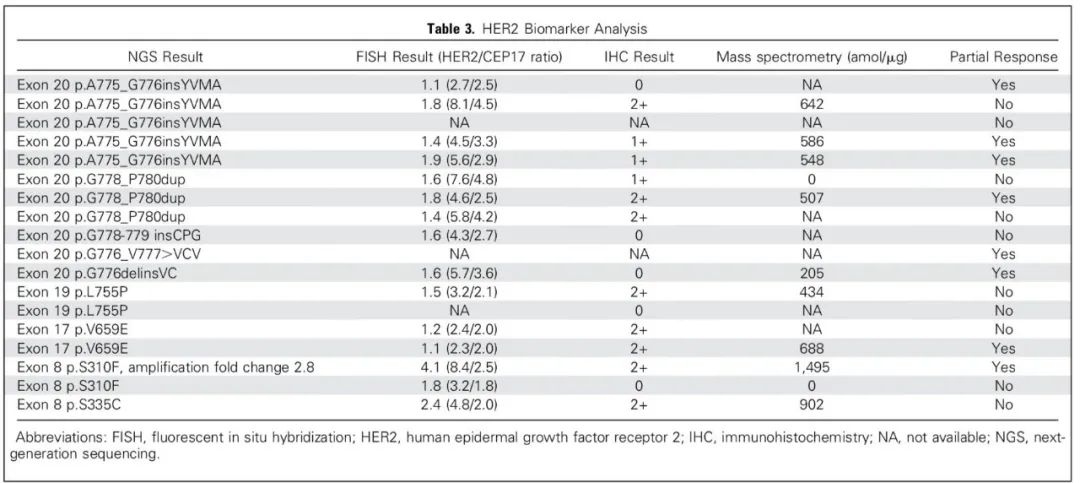
研究一[1]:日本研究者报告了T-DM1单药对复发HER2阳性[免疫组化(IHC)3+,IHC 2+和FISH+或外显子20突变]NSCLC的一项II期临床研究,该研究中15例可评估患者的临床特征:中位年龄67岁,HER2状态:IHC 3+:33%;IHC 2+/FISH:20%;突变:A775_G776insYVMA(33%)、P780_Y781insGSP(7%)G776VinsC(7%)。

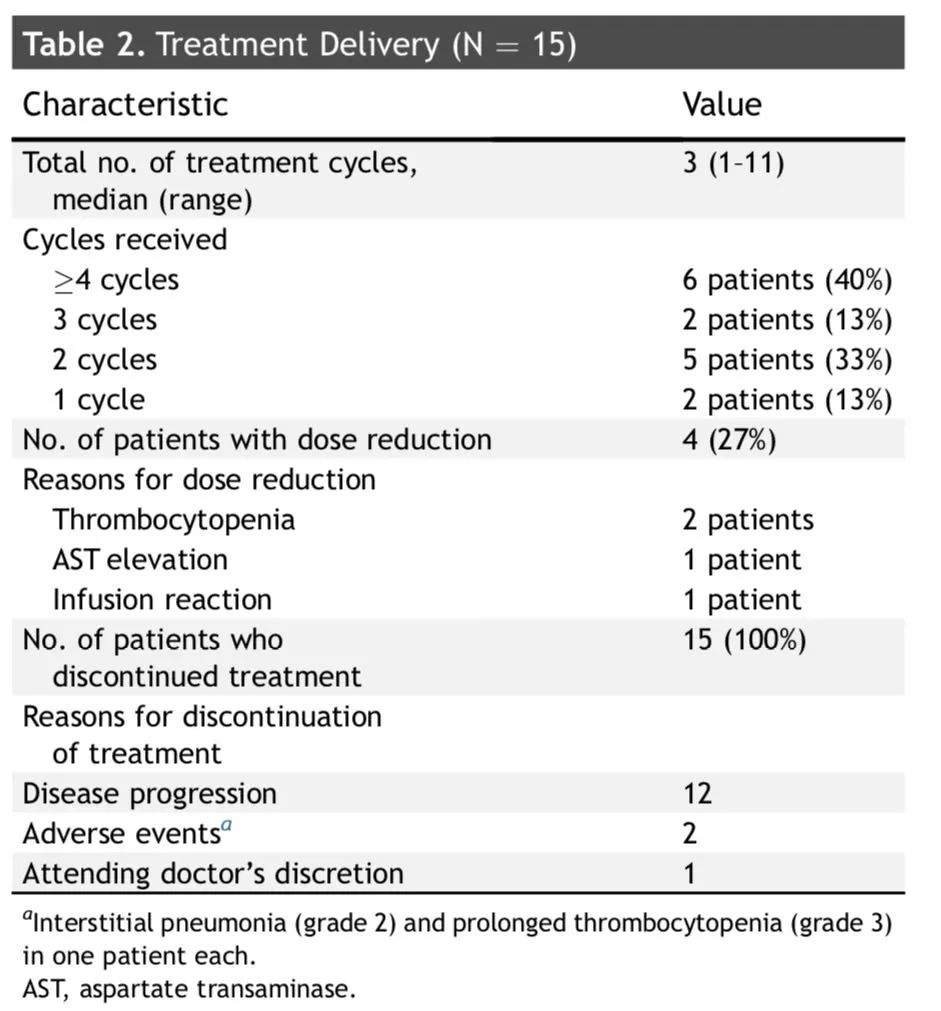

研究结果:1例部分缓解(PR),客观缓解率(ORR)为6.7%(90% CI:0.2%-32.0%)。中位随访时间9.2个月,中位PFS和中位OS分别为2.0个月(90%CI: 1.2-4.0, 95%CI: 1.4-4.0)和10.9个月(90%CI: 2.3-, 95% CI: 4.4-12.0)。3级/4级不良事件包括血小板减少症(40%)和肝毒性(20%),但未见任何治疗相关性死亡。这项研究因为疗效有限而提前终止。
研究二[2]:美国杜克大学Tom Stinchcombe博士牵头,瑞士、德国、意大利等多个国家研究人员共同开展一项II期临床研究,共49例转移性或不可切除局部晚期NSCLC患者接受TDM1治疗,其中29例患者IHC 2+,20例患者IHC3+。结果表明IHC 3+组,ORR为20%,中位生存时间为15.3个月。IHC 2+组ORR为0%(95%CI: 0.0-11.9),中位生存时间为12.2个月。IHC 2+和IHC 3+患者的中位PFS分别为2.6个月和2.7个月。该研究显示TDM1在HER2高表达晚期NSCLC患者中显示出治疗活性,但是HER2免疫组化作为单一参数是不充分的预测标志物。



研究三[3]:一项来自美国纪念斯隆-凯特林癌症中心的Li博士及其同事联合开展的研究,显示了在HER2突变的NSCLC患者中,TDM1具有有效性并且安全可耐受。共有18例HER2扩增或突变的肺腺癌患者接受治疗,中位年龄为63岁,其中72%为女性,39%为从不吸烟。既往接受的全身性疗法的中位数量为2种。ORR为44%(95%CI: 22%-69%),达到了主要研究终点,PFS为5个月(95%CI: 3-9)。在HER2外显子20插入、跨膜和细胞外结构域点突变(A775_G776insYVMA, G776delinsVC, V659E,S310F)的患者中可以观察到疾病缓解。毒性主要为1级或2级,包括输液反应、血小板减少和转氨酶升高,未出现降低剂量或与治疗相关的死亡。这是肺癌HER2分子亚群的第一个阳性临床研究,有必要进一步的多中心研究。
NEJM丨肺癌,DS-8201治疗HER2突变,ORR高达55%
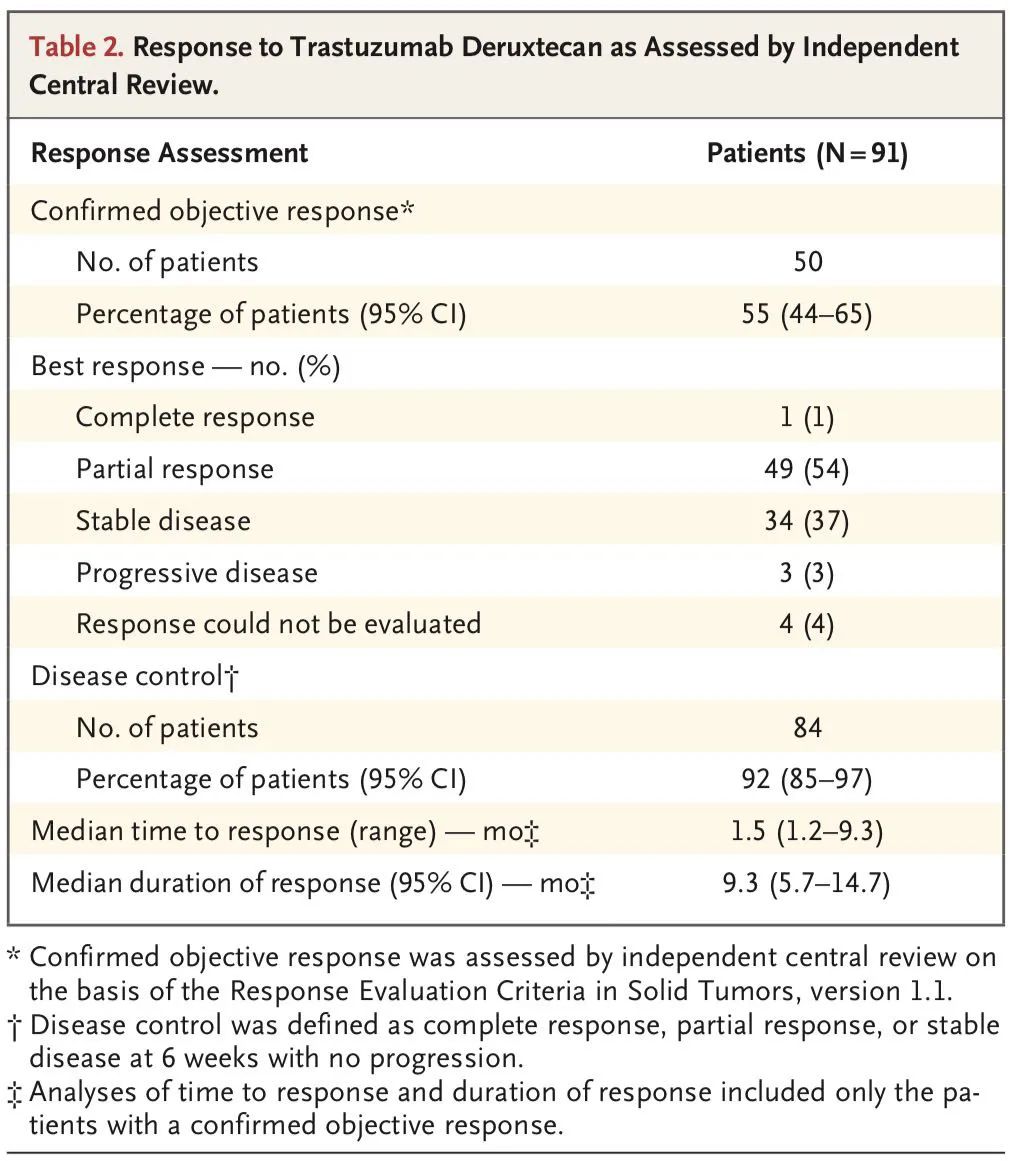
临床疗效
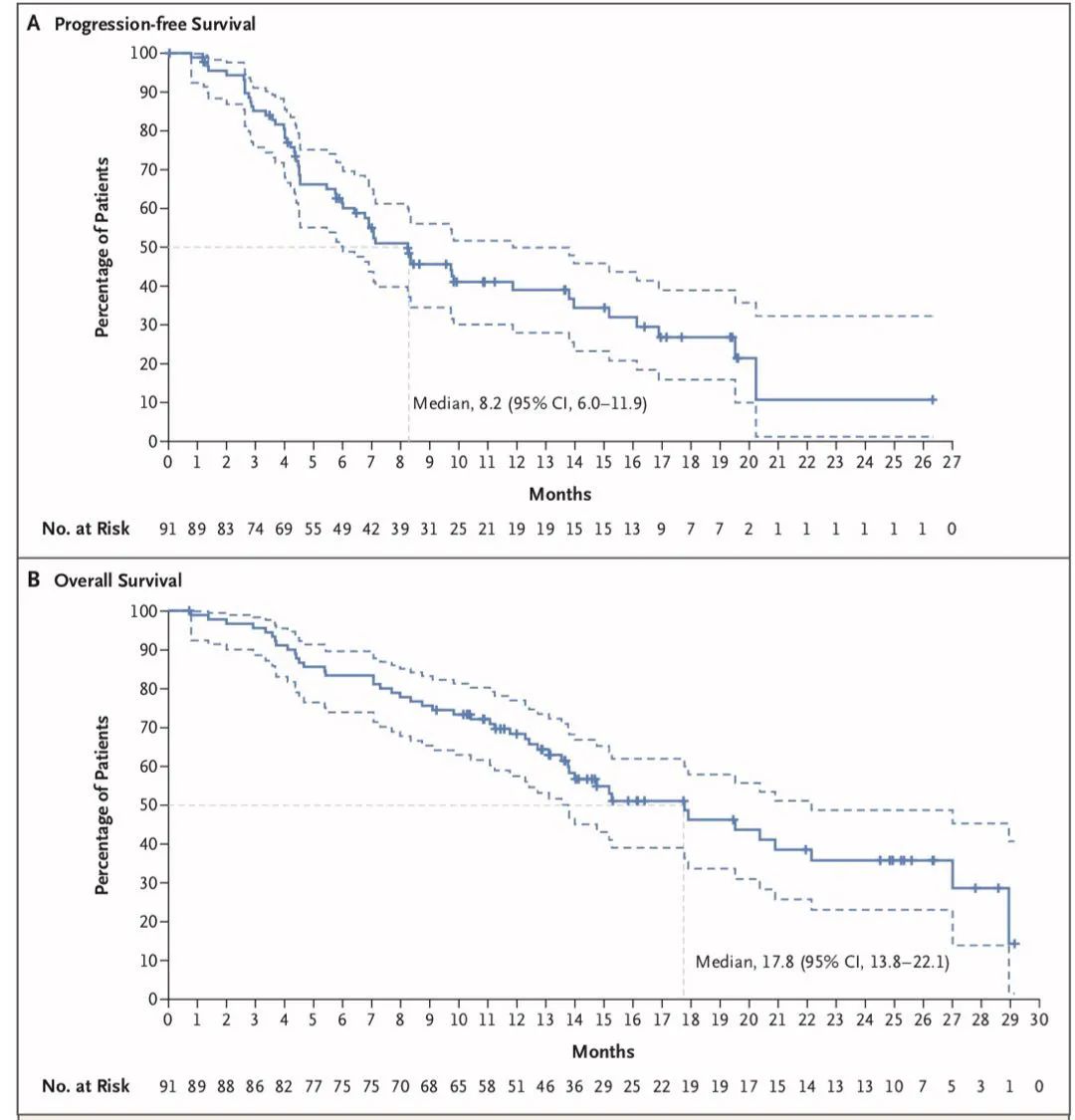
PFS、OS
安全性:其中88 名患者 (97%) 出现与治疗相关的不良事件,最常见的不良反应包括胃肠道和血液系统不良反应、食欲下降、脱发。42 名患者 (46%) 发生了3级以上不良事件,最常见包括中性粒细胞缺乏19%、贫血10% ;13名患者出现5级不良事件,其中两名被认为与药物相关。23 名(25%) 患者因不良反应而终止治疗, 31名 (34%) 患者需要减量。24 名 (26%) 患者出现间质性肺疾病,其中1-5级间质性肺疾病分别有3名、15名、4名和2名。
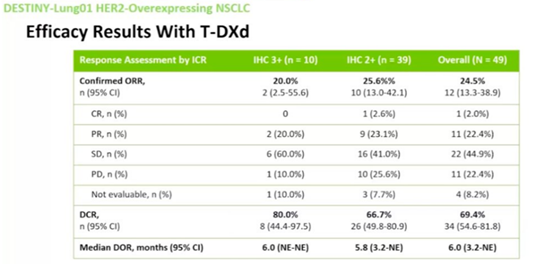
HER2过表达疗效


吡咯替尼是小分子不可逆酪氨酸激酶抑制剂(靶点包括EGFR、HER2和HER4),与胞内激酶区ATP结合位点共价结合,全面阻断HER家族同异源二聚体的形成,抑制肿瘤细胞生长并可透过血脑屏障。
在体内外试验中,吡咯替尼具有抑制HER2外显子20突变NSCLC细胞活性的作用,吡咯替尼在HER2外显子20A775_G776YVMA插入突变肺腺癌类器官模型和裸鼠PDX模型实验中的抗瘤活性显著优于T-DM1和阿法替尼[6]。
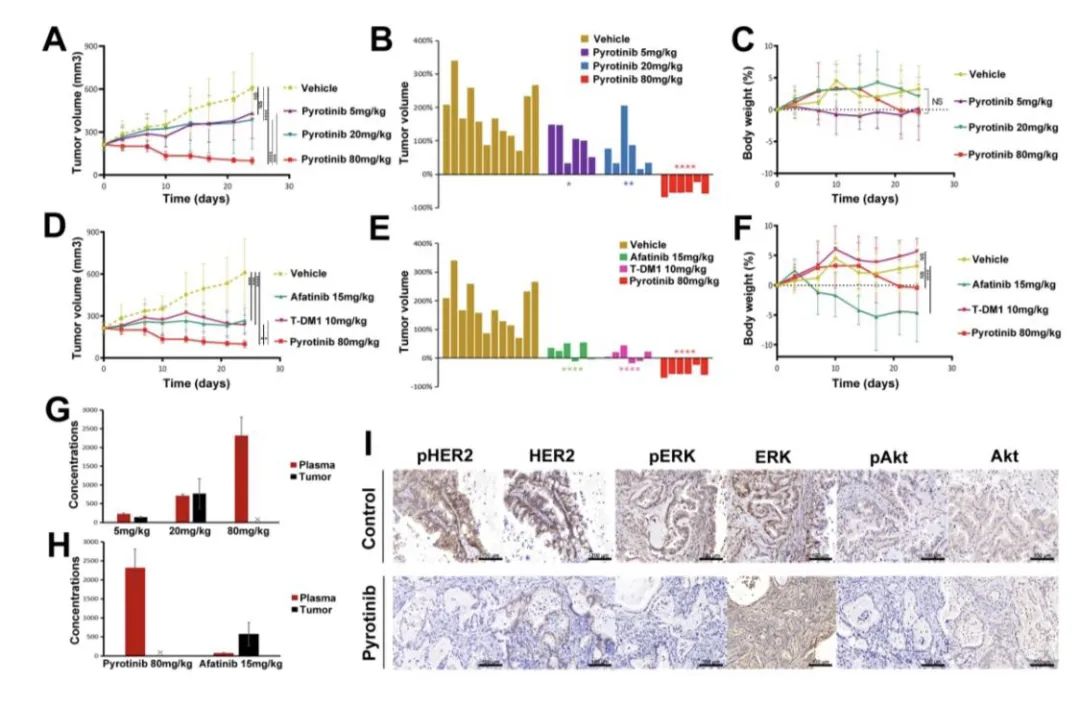
PDX模型中吡咯替尼活性
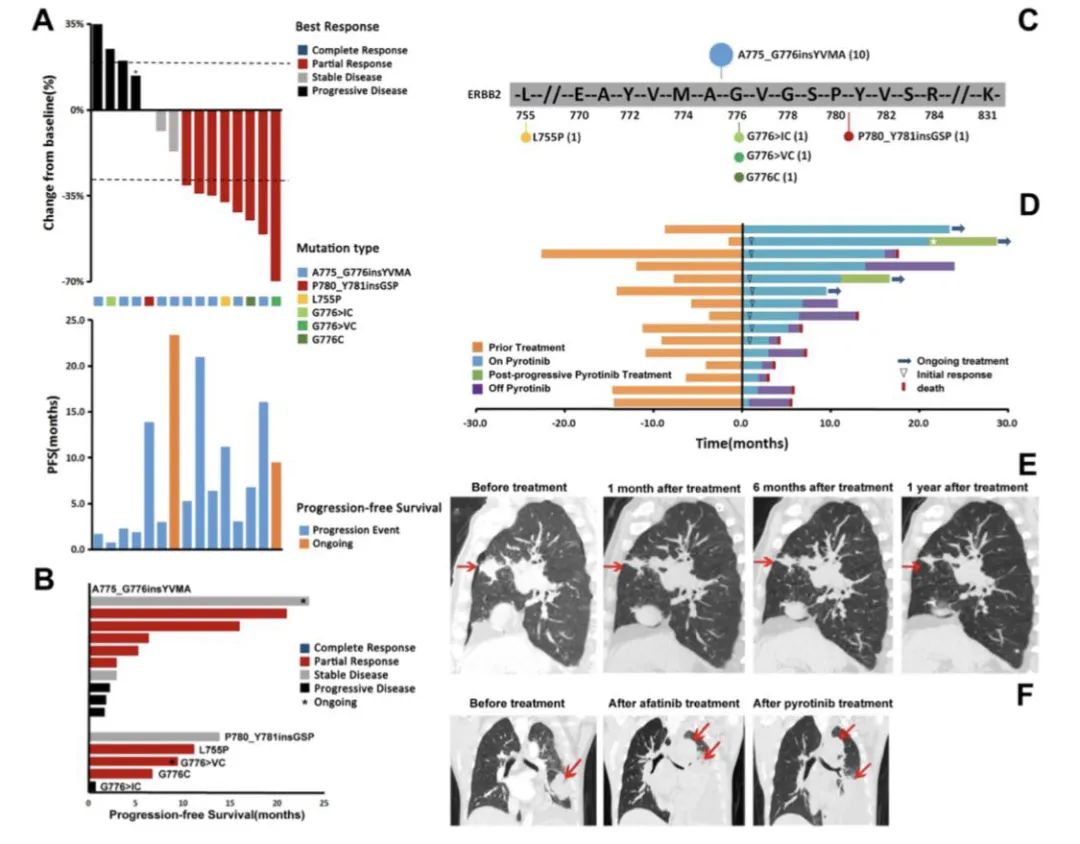
HER2突变,吡咯替尼疗效
HER2突变
2020年发表于J Clin Oncol杂志上的一项单臂、开放标签的多中心II期临床研究[7],共计86例携带HER2突变的患者接受筛查,60例患者入组。41.7%的患者既往接受过至少2种治疗方案,没有患者接受过免疫治疗。患者突变类型如下:外显子20有12个碱基对插入突变(71.3%),G776突变(12%),外显子20有9个碱基对插入突变(8.3%),V777L突变(1.7%),L755P突变(6.7%)。给予吡咯替尼400 mg/d,21天为一周期。中位随访时间为11.7个月,81.7%的患者停止治疗。


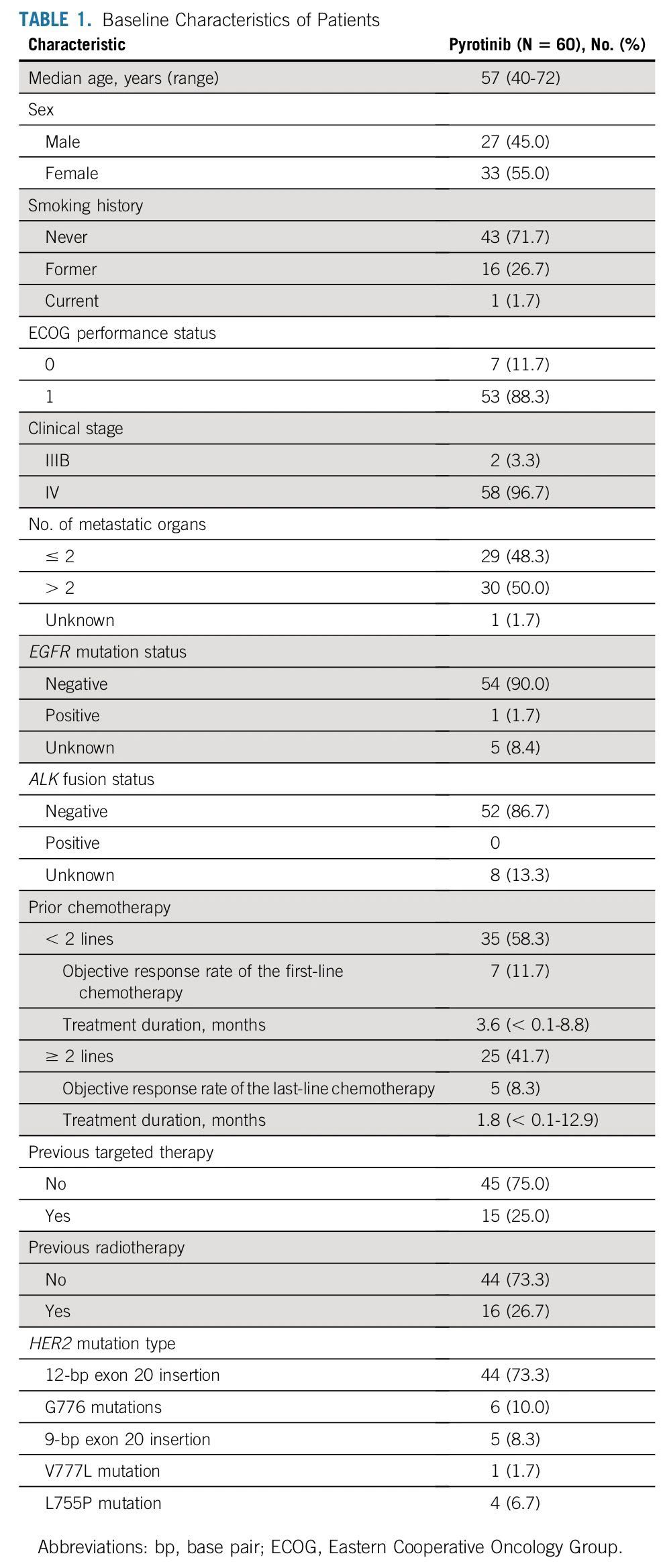
研究者评估的ORR为31.7%,均为PR,反应持续时间为7.0个月,PFS为6.9个月(5.5-8.3),中位OS为14.4个月。3级治疗相关不良事件发生率为26.7%,主要不良事件为腹泻(20%),1例患者出现4级γ-谷氨酰转移酶升高。该研究结果初步验证了吡咯替尼作为单药治疗HER2外显子20突变NSCLC患者的疗效与安全性。

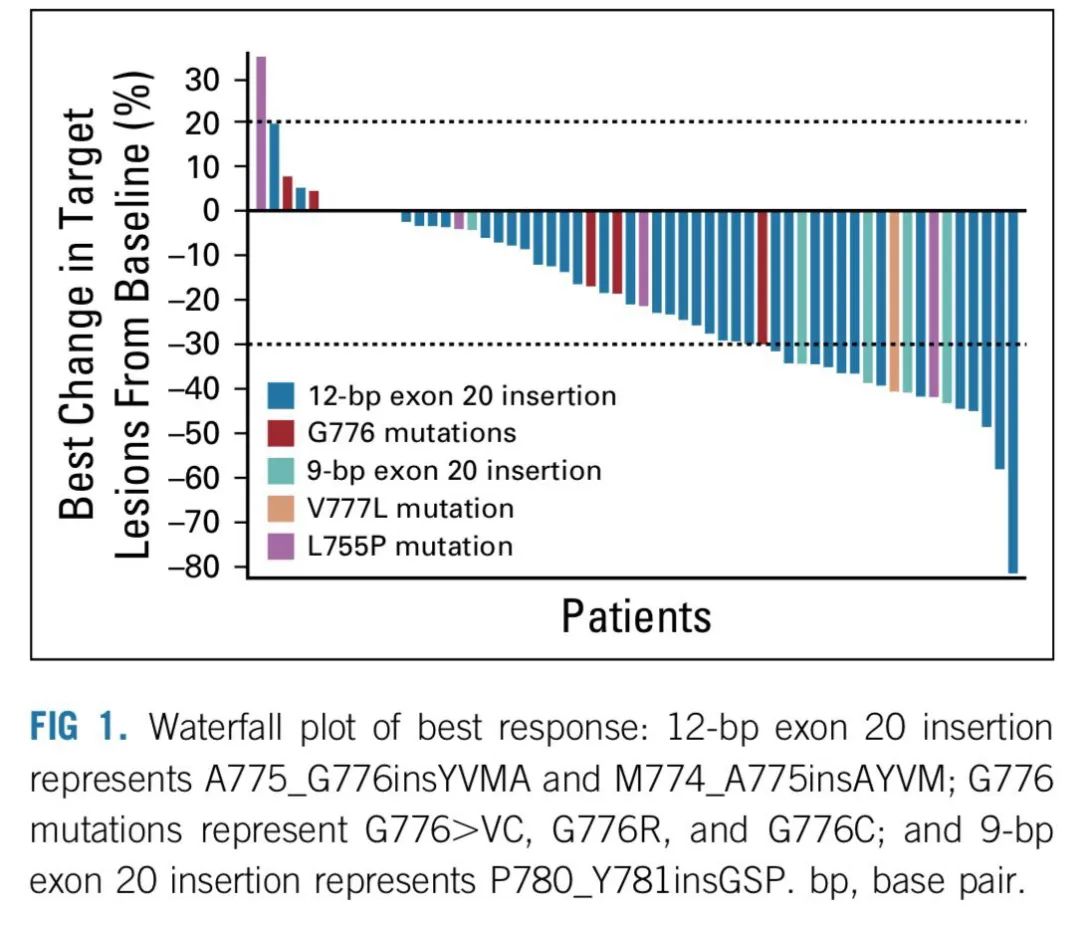
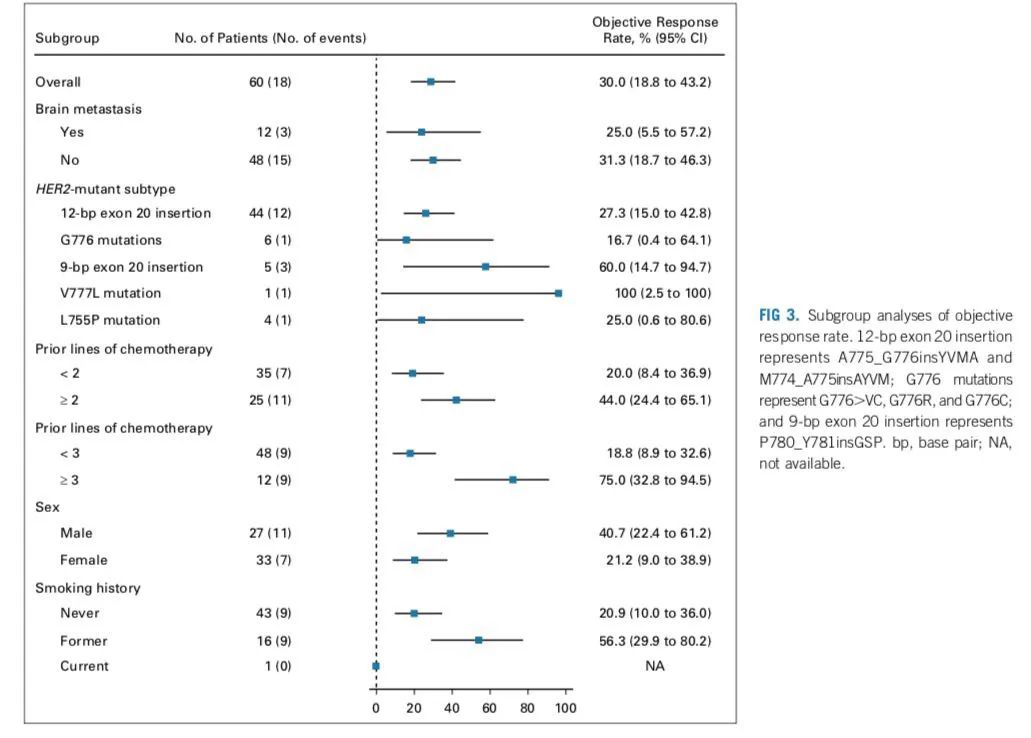

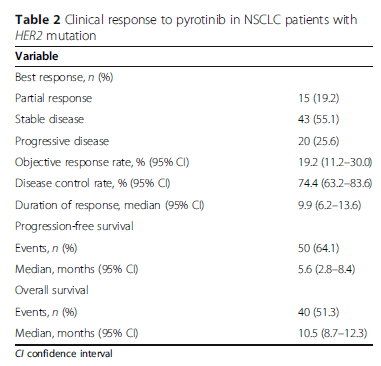



研究结果:1)吡咯替尼的ORR为19.2%(15例PR,其中11例为HER2 20外显子突变,3例10外显子突变,1例17外显子突变),DCR为74.4%,中位PFS为5.6个月,中位OS为10.5个月,6个月的PFS率为49.5%。中位持续有效时间为9.9个月。
2)PS评分为2分的患者较PS评分在0-1的具有较短的OS(mOS,10.7个月 vs 6.1个月,P=0.007)。吡咯替尼作为一线治疗较二线及以上具有更高的ORR(30.4% vs 14.5%)。HER2 20外显子突变与非20外显子突变的ORR无明显差异(17.7% vs 25.0%,P=0.495);在62例HER2 20外显子突变的患者中,Y772_A775dup、G776delinsVC及其他突变类型的ORR分别为23.8%、0.0%、11.1%。在6例19外显子突变的患者中,3例PR,ORR为50%,其中两例患者接受吡咯替尼一线治疗。
4)吡咯替尼作为一线治疗较二线及以上PFS及OS则无显著差异(mPFS, 8.9个月 vs 4.0个月,P=0.144;OS,12.5 个月vs 8.7个月,P=0.125)。同时,20外显子突变和非20外显子突变的患者无显著的PFS及OS差异。在19外显子突变的患者中,3例PR的患者存在TMD突变,其中2例伴有V658E替换的PFS为2.9-5.6个月、OS为5.3-5.6个月,1例伴有I655V突变的患者PFS为0.8个月,OS为1.13个月。
5)伴有驱动基因共突变的患者中,其ORR与野生型患者较为相似(30.0% vs 17.6%,P=0.434),OS较野生型患者短(mOS,6.8个月 vs 11.0个月,P=0.017),mPFS无明显差异(3.0个月 vs 6.7个月,P=0.294)。而伴有EGFR突变的患者较野生型而言,具有较差的临床结果(ORR,0 vs 20.8%,P=0.590;PFS, 3.0个月 vs 6.4个月,P=0.185)。对基线水平上没有出现HER2扩增的患者较出现扩增而言无ORR及生存差异(19.4% vs 16.7%,P=1.000;PFS,5.4个月 vs 14.0个月,P=0.421;OS,10.5个月 vs NR,P=0.558)。
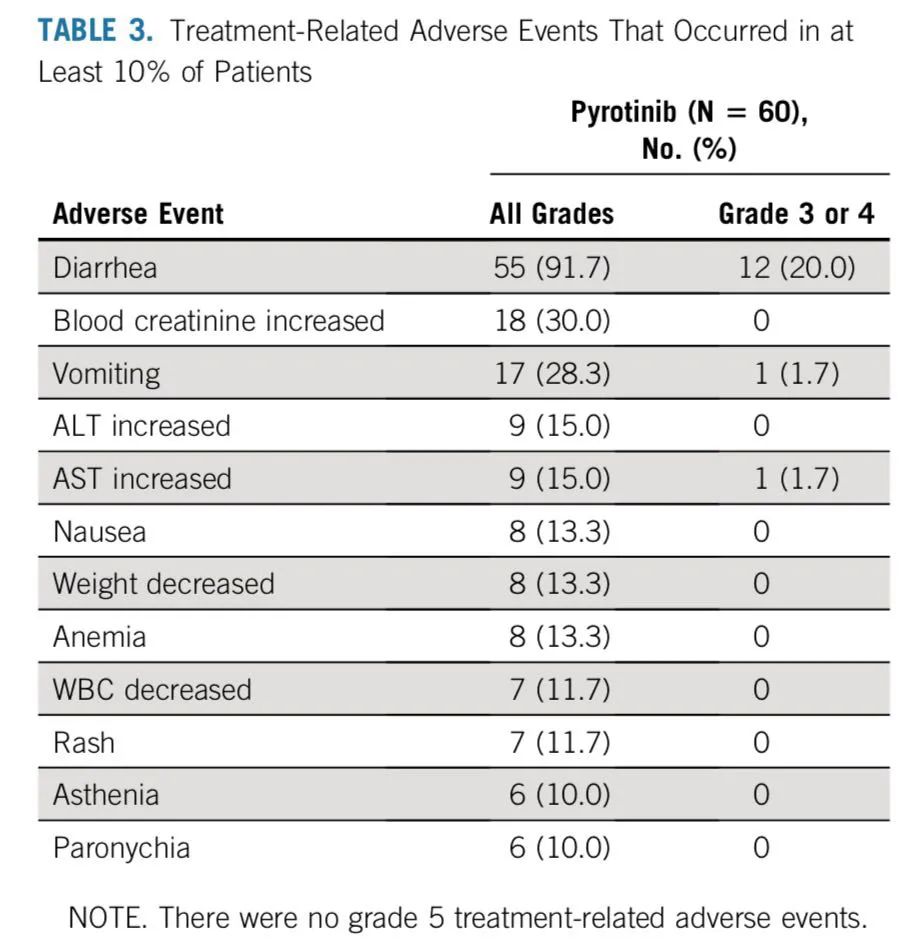
6)安全性分析:在78例患者中,71例患者(91.0%)出现了治疗相关的不良反应(TRAEs),大多数为1-2级TRAEs。腹泻是最常见的TRAE(85.9%),随后依次是乏力(57.7%)、贫血(35.9%)、眩晕(33.3%)、食欲下降(32.1%)、手足综合征(32.1%)、恶心(32.1%)。16例(20.5%)患者出现3级TRAEs,包括13例(16.7%)腹泻,2例(2.6%)贫血,1例(1.3%)乏力的情况。没有4级及以上级别的不良反应出现。在治疗过程中,4例患者由于出现不良反应停止治疗,其中2例患者出现3级腹泻,1例患者出现2级乏力,1例患者出现2级食欲减退、恶心及呕吐。2例患者由于不能耐受毒性而减量。
7)通过使用ctDNA检测方式去监测其在疾病进展中的预测作用及可行性分析,探索出ctDNA的预测价值并对吡咯替尼的耐药性进行分析。在78例患者中,12例患者出现了使用吡咯替尼后的获得性耐药,通过对这部分患者基线水平及疾病进展后的血样本进行NGS检测分析,来检测疾病的进展。在2名无基线血样的同时出现EGFR与HER2扩增的患者中,检测出其最佳疗效为PD,由此我们推测同时有EGFR与HER2扩增在吡咯替尼的耐药中会发挥一定作用。在另外4例出现HER2突变缺失的患者中,其最佳疗效为PD,我们推测HER2突变缺失也可能与吡咯替尼的耐药有关。除此之外,EGFR (p.E330K), KRAS (p.G12D), MET扩增以及BRAF扩增也在3例PD的患者中被检出。由于KRAS和BRAF都是RAS/RAF信号通路中HER2的下游信号,所以我们的结果表明RAS/RAF信号通路中基因的改变是一个潜在的吡咯替尼的耐药机制。
HER2扩增



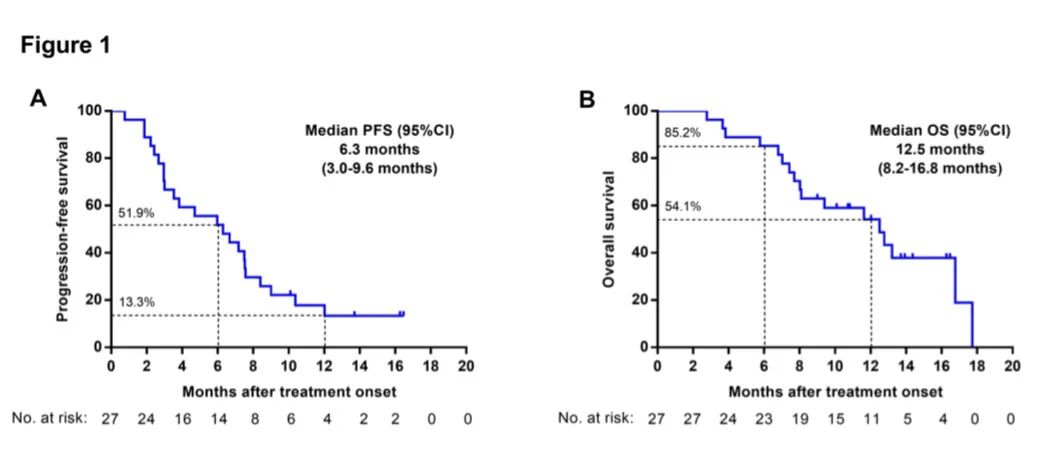
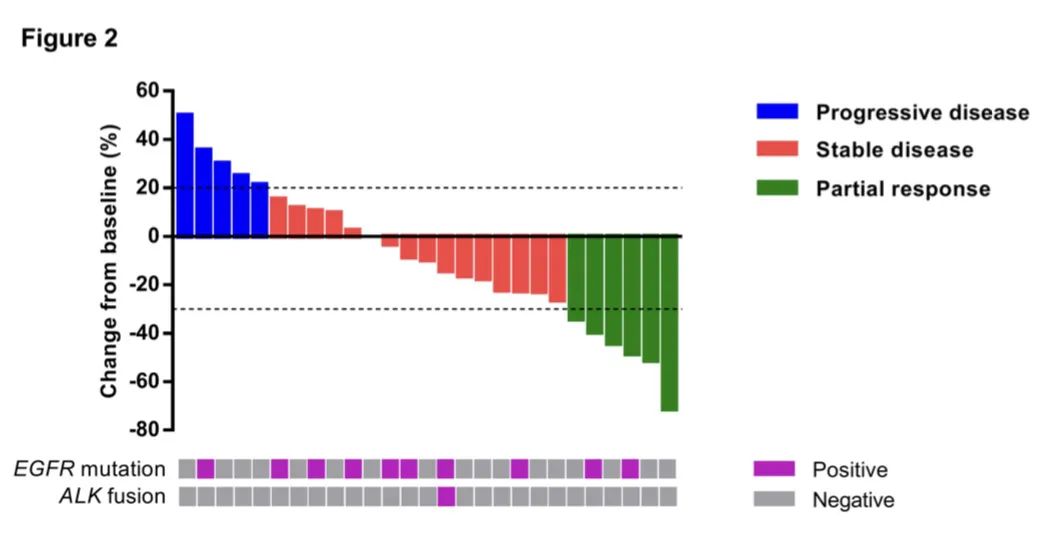
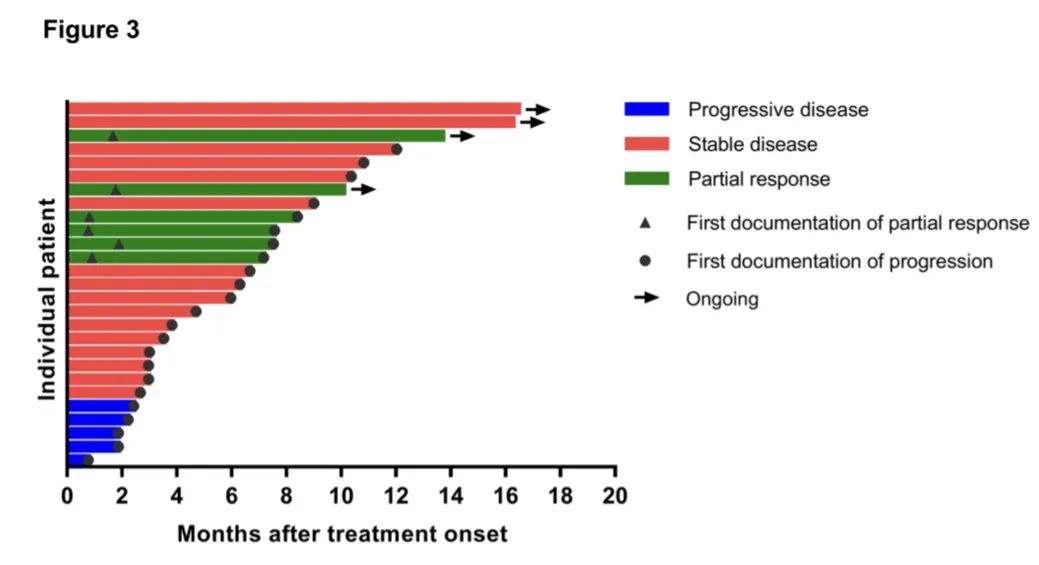

研究结果:1) 吡咯替尼的ORR为22.2%,中位PFS为6.3个月,中位OS为12.5个月。6个月PFS率为51.9% 。2) 肺腺癌患者的中位总生存期显著长于肺鳞癌患者,12.8 vs 4.9月。3) 吡咯替尼作为一线治疗患者的中位无进展生存期显著长于二线以上治疗患者,12.4月 vs 4.7月,中位总生存期则无显著性差异。4) 13例之前接受过EGFR抑制剂治疗的患者,客观有效率30.8%,中位无进展生存期7.2月,中位总生存期12.8月。5) 5例脑转移患者,有2例部分缓解,客观有效率40%,其中1例颅内病灶部分缓解,另1例颅内病灶稳定。6) 在疾病进展时检测到 HER2 扩增转阴。7) 所有患者均发生治疗相关不良事件 (TRAE)(3 级,22.2%),但没有记录到 4 级或更高级别的 TRAE。腹泻是最常见的 TRAE(全部为 92.6%;3 级为 7.4%)。
阿法替尼虽为EGFR和HER2酪氨酸激酶的强效、不可逆的双重抑制剂,其临床疗效不确切。中山大学附属医院张力教授团队在Oncologist发表一项真实世界的研究[10],此研究中纳入32例多线治疗失败后接受阿法替尼治疗的HER2突变肺癌患者,总体ORR和DCR分别为16%和69%。研究者进一步将不同HER2突变类型的疗效细分,结果发现:A775_G776insYVMA突变类型的患者阿法替尼的ORR为0%(0/14),DCR为35.7%,而G778_P780dup或G776delinsVC突变类型的患者中阿法替尼的有效率则为40%(4/10),DCR为100%。A775_G776insYVMA突变患者的中位PFS仅为1.2个月,G778_P780dup或G776delinsVC突变患者中位PFS达到了7.6个月(P=0.015)。这一数据为阿法替尼在治疗HER2突变的NSCLC中筛选出可获益的靶点,更加证实了HER2突变型肺癌具有显著的异质性。
2015年,在Ann Oncol上报道一项达克替尼治疗HER2突变或扩增肺癌的II期临床研究[11],结果显示:30例HER2扩增或者HER2激活突变的晚期肺癌患者,接受达克替尼治疗,其中26例为HER2的外显子20突变患者,3例患者治疗有效,客观有效率仅为12%,而4例HER2扩增患者都未达到客观缓解。
JCO丨肺癌HER2 ex20插入突变,波奇替尼后线治疗OS为15个月
Poziotinib是一种有效且不可逆的EGFR和HER2基因20号外显子突变TKI,目前正在进行多队列、多中心、II期研究(ZENITH20)。2020年WCLC大会上介绍了EGFR和HER2基因20号外显子突变亚组的最新疗效结果。ZENITH20研究纳入EGFR/HER2 20ins患者,使用Poziotinib治疗(16mg口服,每日一次)。在这项正在进行的研究中,205名患者被纳入了前2个队列(分别是115名EGFR20ins和90名HER2 20ins)。94%的患者曾接受过化疗/铂类药物治疗;65%的患者接受过免疫治疗,包括检查点抑制剂;28%的患者接受过单克隆抗体治疗;20%的患者接受过TKI治疗。
研究结果:1)接受治疗的总体人群ORR为14.8%/27.8%,中位缓解持续时间(DOR)分别为7.4个月和5.1个月。在可评估的患者群体中,ORR分别为18.3%/35.1%。无论是既往接受过二线或三线治疗,患者的疗效相似。2)在可评估的患者群体中,EGFR组的ORR为18.3%,HER2组ORR为35.1%。其中Poziotinib二线或三线治疗EGFR20ins的ORRs为15%、16%,Poziotinib二线或三线治疗HER2 20ins的ORRs为30%、39%。3)最常见的≥3级AEs是皮疹(29%)、腹泻(26%)和黏膜炎症(10%)。
小结:波齐替尼治疗EGFR ex20ins疗效差,HER2 ex20ins疗效尚可,但不良反应较多,耐受性较差。
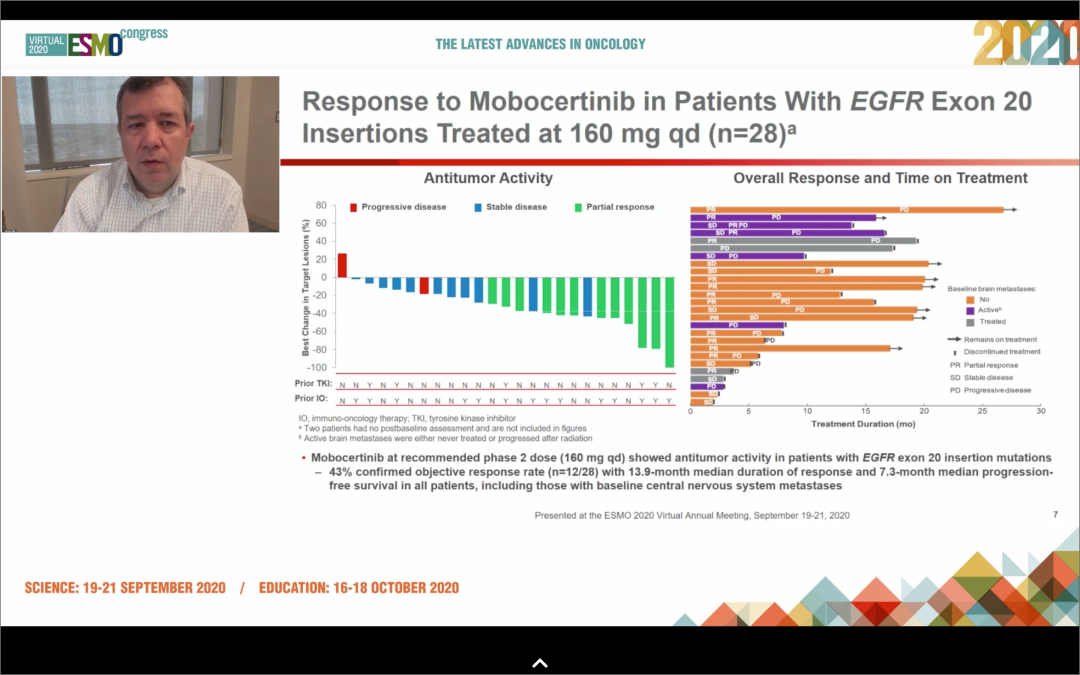
治疗HER2突变乳腺癌最有效的策略之一是将两种HER2抗体pertuzumab和trastuzumab与传统化疗药物多西他赛联合使用,众所周知,多西他赛是乳腺癌和肺癌的标准治疗方案。因此,研究者假设这种三联疗法可能对NSCLC有效。
IFCT 1703-R2D2试验[12]是一项多中心、非随机的II期研究。研究纳入了经≥1线含铂方案治疗后进展的HER2突变晚期NSCLC患者。患者接受帕妥珠单抗的剂量为840mg负荷剂量,后续420mg; 曲妥珠单抗的剂量为8mg/kg负荷剂量,后续为6mg/kg; 多西他赛的剂量为75mg/m2;每3周一次。主要研究终点是客观缓解率(ORR)。
45例患者入组并接受治疗。患者中位年龄为64.5岁(范围,31-84岁),35%为吸烟者,72%为女性,15%ECOG评分2分,30%有脑转移。客观缓解率为29%(n = 13),58%的患疗效评价SD(n = 26)。中位无进展生存期为6.8个月(95%CI,4.0-8.5)。确认缓解(n = 13)患者的中位持续缓解时间为11个月(95%CI,2.9-14.9)。在64%的患者中观察到3/4级治疗相关的不良事件;没有患者因毒性而停止治疗。最常见的≥3级治疗相关不良事件是中性粒细胞减少症(33%),腹泻(13%)和贫血(9%)。
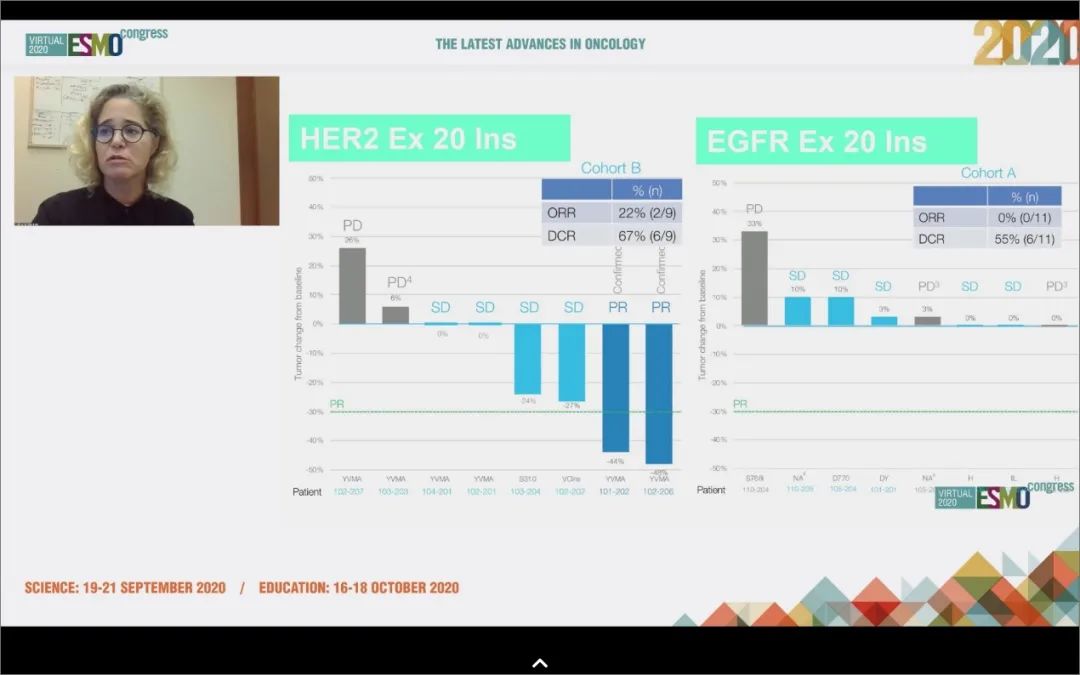
治疗后肿瘤变化瀑布图
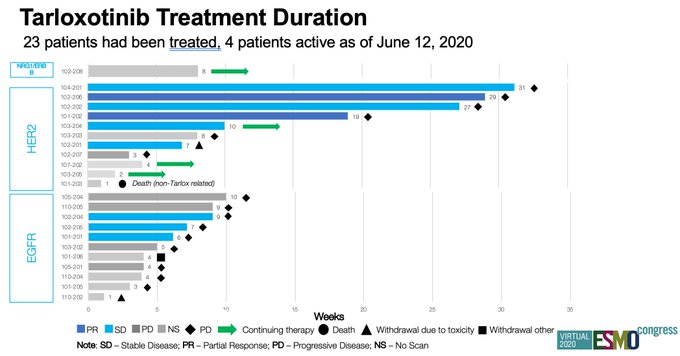
Tarloxotinib治疗持续时间
EGFR TKI或含铂化疗治疗进展后EGFR突变NSCLC患者的治疗方案有限。Patritumab Deruxtecan(U3-1402)是一种靶向HER3的抗体偶联药物, 2020年ESMO大会上公布了I期研究初步结果,推荐扩增阶段使用剂量为5.6 mg/kg。2020WCLC会议上,研究者公布了I期研究剂量扩增阶段的研究结果。

2020年4月30日数据截止时,57例患者接受U3-1402(5.6 mg/kg)治疗,其中56例患者可进行评估。数据截止时,在28例仍在接受治疗的患者中,6例患者中仅1例可评估,中位抗肿瘤治疗方案数为4,51例(90%)患者既往接受了含铂化疗,中位EGFR TKI方案数为2,49例(86%)患者既往接受了奥希替尼治疗,27例(47%)患者有中枢神经系统(CNS)转移病史。中位治疗持续时间为3.5个月,中位随访时间为5.4个月。56例可评估疗效患者的ORR为25%,DCR为70%,中位缓解持续时间(DOR)为7个月。
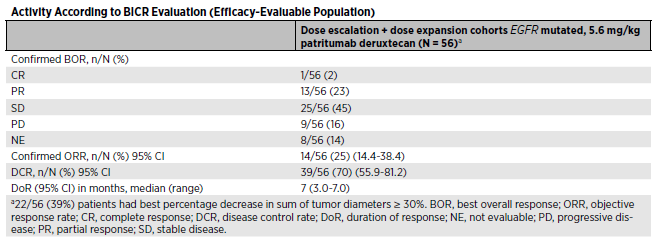
最常见的≥3级治疗紧急不良事件是血小板计数下降(25%)和中性粒细胞计数下降(16%)。几乎所有肿瘤中都有HER3表达。这项研究在多种EGFR TKI耐药机制的患者中观察疗效,包括EGFR C797S突变、MET扩增、HER2突变、BRAF融合、PIK3CA突变。
参考资料
[1]Hotta K, Aoe K, Kozuki T, et al. A Phase II Study of Trastuzumab Emtansine in HER2-Positive Non-Small Cell Lung Cancer. J Thorac Oncol. 2018 Feb;13(2):273-279. doi: 10.1016/j.jtho.2017.10.032.
[2]Peters S, Stahel R, Bubendorf L, et al. Trastuzumab Emtansine (T-DM1) in Patients with Previously Treated HER2-Overexpressing Metastatic Non-Small Cell Lung Cancer: Efficacy, Safety, and Biomarkers. Clin Cancer Res. 2019 Jan 1;25(1):64-72. doi: 10.1158/1078-0432.CCR-18-1590.
[3]Li BT, Shen R, Buonocore D, et al. Ado-Trastuzumab Emtansine for Patients With HER2-Mutant Lung Cancers: Results From a Phase II Basket Trial. J Clin Oncol. 2018 Aug 20;36(24):2532-2537. doi: 10.1200/JCO.2018.77.9777.
[4]Li BT, Smit EF, Goto Y, et al. Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2021 Sep 18. doi: 10.1056/NEJMoa2112431.
[5]OA04.05 - Trastuzumab Deruxtecan in HER2-Overexpressing Metastatic Non-Small Cell Lung Cancer: Interim Results of DESTINY-Lung01. Presented at: WCLC 2020 Virtual; January 28-31, 2021.
[6]Wang Y, Jiang T, Qin Z, et al. HER2 exon 20 insertions in non-small-cell lung cancer are sensitive to the irreversible pan-HER receptor tyrosine kinase inhibitor pyrotinib. Ann Oncol. 2019 Mar 1;30(3):447-455. doi: 10.1093/annonc/mdy542.
[7]Zhou C, Li X, Wang Q, et al. Pyrotinib in HER2-Mutant Advanced Lung Adenocarcinoma After Platinum-Based Chemotherapy: A Multicenter, Open-Label, Single-Arm, Phase II Study. J Clin Oncol. 2020 Aug 20;38(24):2753-2761. doi: 10.1200/JCO.20.00297.
[8]Song Z, Li YP, Chen SQ, et al. Efficacy and safety of pyrotinib in advanced lung adenocarcinoma with HER2 mutations: a multicenter, single-arm, phase II trial. Clin Cancer Res. 2022 Feb 1; 20: 42. doi: 10.1186/s12916-022-02245-z.
[9]Song Z, Lv D, Chen SQ, et al. Pyrotinib in Patients with HER2-Amplified Advanced Non-Small Cell Lung Cancer: A Prospective, Multicenter, Single-Arm Trial. Clin Cancer Res. 2022 Feb 1;28(3):461-467. doi: 10.1158/1078-0432.CCR-21-2936.
[10]Fang W, Zhao S, Liang Y, et al. Mutation Variants and Co-Mutations as Genomic Modifiers of Response to Afatinib in HER2-Mutant Lung Adenocarcinoma. Oncologist. 2020 Mar;25(3):e545-e554. doi: 10.1634/theoncologist.2019-0547.
[11]Kris MG, Camidge DR, Giaccone G, et al. Targeting HER2 aberrations as actionable drivers in lung cancers: phase II trial of the pan-HER tyrosine kinase inhibitor dacomitinib in patients with HER2-mutant or amplified tumors. Ann Oncol. 2015 Jul;26(7):1421-7. doi: 10.1093/annonc/mdv186.
[12]Mazieres J, et al. Combination of Trastuzumab, Pertuzumab, and Docetaxel in Patients With Advanced Non-Small-Cell Lung Cancer Harboring HER2Mutations: Results From the IFCT-1703 R2D2 Trial. J Clin Oncol. 2022 Jan 24:JCO2101455. doi: 10.1200/JCO.21.01455.


服务:
本公众号免费接受科研团队/单位的研究进展、研发故事等非商业/非盈利目的投稿,及免费发布科研团队的招聘广告等,欢迎后台联系。
声明:发表/转载本文仅仅是出于传播信息的需要,并不意味着代表本公众号观点或证实其内容的真实性。据此内容作出的任何判断,后果自负。若有侵权,告知必删!
长按关注本公众号


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言