综述目的:
在缺乏组织病理学证据的情况下,侵袭性肺曲霉菌病(IPA)的诊断通常是基于真菌学(而不是组织)、医学影像学以及患者获得侵袭性真菌病的危险因素。在这里,我们回顾了在过去的几十年里对于IPA的危险因素的认识的变化 。
最新进展:
在21世纪初,IPA仅被认为在免疫功能低下的患者才会得的疾病。特别是在危重疾病的状态下,风险范围已经逐步扩大 ,如今,由流感或SARS-Cov-2引起的急性病毒感染已被公认的IPA的危险因素。
总结:
研究表明免疫功能低下状态的经典风险范围(“宿主因素”)首先因一系列慢性疾病而扩大,如:艾滋病、肝硬化和慢性阻塞性肺疾病。在出现危重症时,特别是处于脓毒症和/或严重呼吸窘迫为特征的疾病状态时,如果合并有任何慢性疾病都可能增加IPA的发生风险。最近,急性病毒感染常与IPA联系起来,从而出现流感相关性IPA和covid-19相关性IPA的概念。这些病毒感染可能会影响到没有基础疾病的患者。因此,即使在没有任何慢性病的情况下,IPA的风险现在对ICU患者来说也是现实
关键词:
曲霉菌、COVID-19、流感、侵袭性肺曲霉菌病、危险因素
前言
侵袭性曲霉菌病是吸入腐生透明霉菌的分生孢子或孢子的孢子后发生的机会性感染。首先被感染的通常是肺(>90%),然而,通过血行播散,曲霉菌可以影响任何器官,包括大脑、肝脏和心脏。其中烟曲霉仍然是最常见的分离菌种(80-90%)和致病菌种,黄曲霉是第二常见。土曲霉感染的发生率正在增加,其临床范围也在扩大。在肺部,曲霉引起气道炎症和大量的粘液产生,而肺泡中的菌丝生长导致侵袭性肺炎。ICU患者的IPA预后极差;死亡率很高,常常大于65%。通常情况下,曲霉易发生在发病前就身体虚弱且预后不良的患者。因此,需要对相关死亡率和归因死亡率进行区分。在一项匹配队列研究中与IPA相关的死亡率为75.7%,而在高度匹配的对照组患者中为56.8%,导致的归因死亡率为18.9% [95%CI 1-36.7] 。无论如何,IPA的真正影响很难评估,因为它是由当地的病例构成决定的。此外,由IPA的诊断具有较大难度,IPA的发病率也难以调查,且在文献中范围较宽。IPA确诊需要肺活检和组织病理学检查,培养结果阳性和侵袭性生长。
肺组织活检对于呼吸窘迫、血流动力学不稳定和凝血功能障碍的危重症患者存在较大风险,不应作为额外的诊断方法。因此,在缺乏组织病理学检查的金标准的情况下,已经开发出了包括患者的风险评估的IP诊断方。然而,在过去的20年里,ICU患者的风险范围似乎在不断扩大。
风险范围的历史:风险范围的扩大和当地病例构成的重要性
EORTC/MSG诊断标准:确诊、很可能、可能
传统观念认为,曲霉被认为是一种机会致病菌,IPA被认为是一种针对免疫功能低下患者的感染性疾病,免疫功能低下的特征有:严重中性粒细胞减少(<500个/立方毫米,且持续>10天),或其他原因导致的严重免疫抑制,如血液系统恶性肿瘤、异体干细胞移植或器官移植,长期使用糖皮质激素(≥0.3mg/kg时间在3周至60天),使用免疫抑制剂,如钙调神经磷酸酶抑制剂,肿瘤坏死因子(TNFa)阻滞剂,淋巴细胞特异性单克隆抗体,核苷类似物,布鲁顿酪氨酸激酶抑制剂;严重遗传免疫缺陷。这些危险因素已被欧洲癌症研究和治疗组织/真菌病研究小组(EORTC/MSG)定义为“宿主因素”,它反映了患者免疫状态严重受损的状况。当IPA的诊断未明确时, “宿主因素”被引入诊断流程,但当患者具有阳性的真菌学结果和有力的医学影像表现,这对侵袭性真菌病有着很强的提示作用( 影像表现:致密、边界清楚的病变伴有/无光晕征、空气新月征、空洞、楔形、节段或大叶性实变)。任何阳性真菌学检查结果,加上胸部CT上有提示性的影像学表现,以及“宿主因素”的存在,三者结合就可得出IPA的很可能诊断。此外,根据EORTC/MG标准,阳性CT表现与“宿主因素”相结合,但在缺乏真菌学证据的情况下,就可得出IPA很可能诊断。.值得注意的是,制定这些标准是为了将患者纳入临床试验,而不是为了指导临床开始抗真菌治疗的。值得一提的是,当可疑IPA并且病人的条件允许时,应尽早的进行支气管镜检查获取气道影像(可见真菌性气管炎的菌斑)和采集样本来协助诊断,也就是说,可以直接从斑块取样或者行支气管肺泡灌洗(BAL)样本中真菌生物标志物进行PCR或直接染色/培养。然而,对于没有气管支气管炎的侵袭性曲霉病患者,支气管镜下还缺乏特定的发现。此外,支气管镜检查对于有高氧浓度和高PEEP等通气支持的ICU患者可能并不可行,因为它可能会导致患者呼吸状况进一步恶化。血流动力学不稳定使有创操作增加额外的风险。在这种情况下,可以使用其他方式获取的标本(如:气管内吸出物和非支气管镜下BAL), 但是与BAL相比,它们的敏感性和特异性较低;当可行时支气管镜检查和BAL肯定是首选。
ICU患者“患者因素”的范围扩大
在一项里程碑式的研究中,Meersseman 团队将BAL液中的半乳甘露聚糖(GM)抗原检测列为诊断ICU患者IPA的有价值的真菌学检测方法。他们把BAL液中GM抗原检测适用范围扩大,包括非中性粒细胞减少患者,因为血清中的GM抗原会被循环的中性粒细胞清除,使得该试验在非中性粒细胞减少患者的血清中完全无效。值得注意的是,在这项非常重要的研究中,这些研究者在早期的研究成果之上,把宿主因素范围扩大了,纳入了Child C型肝硬化和HIV患者。其他流行病学研究表明并证实患有慢性阻塞性肺疾病(COPD)的危重患者也易发生IPA。
侵袭性肺曲霉菌病的推断:鉴别曲霉定植和侵袭性肺曲霉菌病的临床流程
为了响应严格的EORTC/MSG标准,该标准不允许在没有组织病理学证据的情况下对免疫功能正常的患者中诊断IPA,Vandewoude 团队基于现有数据开发了一个临床诊断对流程。由于流程开发是用于曲霉气道定植和IPA进行鉴别的,因此进入流程的标准是呼吸道分泌物检测到曲霉菌(图 1)。在一项国际外部验证研究中,与EORTC/MSG标准相比,该流程纳入了更多可以诊断为IPA的患者(例如:大多数ICU患者没有“宿主因素”)。为区别于其他类型的诊断确定性(证实、可能、很可能),根据该流程诊断的IPA被称为“推断”IPA。虽然该流程的预测操作特征反映了一个非常高的阴性预测值,但仍存在假阳性的问题,从而可能导致非IAP患者接受了抗真菌治疗。另一方面,在危重症中呼吸道感染曲霉菌的病人进行抗真菌治疗的临床价值仍未被证实。这样的(“抢先治疗”) 策略可以降低细菌定植发展为侵袭性疾病的风险,并且是一种用在ICU有明确念珠菌定植的高危患者中的既定策略。在没有BAL液曲霉菌培养阳性和直接显微镜检查阳性的情况下,这个临床流程要求的“宿主因素”基本上与与EORTC标准定义的“宿主因素”相同,但对中性粒细胞减少症的持续时间和皮质类固醇治疗的持续时间没有具体的要求,然而,在有BAL液阳性培养结果和直接镜检阳性结果的情况下,不需要“宿主因素”来诊断“推断IPA”。研究显示许多常见的基础疾病(如:慢性阻塞性肺疾病、长期血液透析、营养不良和糖尿病)常与ICU患者的IPA相关。事实上,每一个“推断”IPA患者至少有一个基础疾病。除了慢性疾病,ICU中发生IPA的患者通常有严重的呼吸窘迫【ARDS,细菌性肺炎】和/或脓毒症,以及SOFA评分评估的器官功能障碍指数高。这些观察结果导致了这样的见解,即基本上每个具有“一些”基础病,并且具有实质性器官衰竭的ICU患者都可能处于这种危及生命的真菌并发症的风险中。此外,研究表明,CT影像中侵袭性真菌病特征性表现在一般ICU人群中很少见。在确诊为IPA的患者中,最常见非特异性浸润或实变(68%),而只有26%的患者表现为特征性的结节,高度特异性的表现如新月征、晕轮征和空洞很少被发现(分别为1%、7%和10%),事实上,在非粒细胞减少的患者中,晕轮征的敏感性(5-24%)明显低于恶性血液病中性粒细胞减少患者(82%),这些研究结果表明,EORTC/MSG标准定义的CT特征性影像表现不能作为诊断非中性粒细胞减少ICU患者IPA的必要条件,并强调需要对医学影像学结果进行有灵活解释的替代诊断方法。
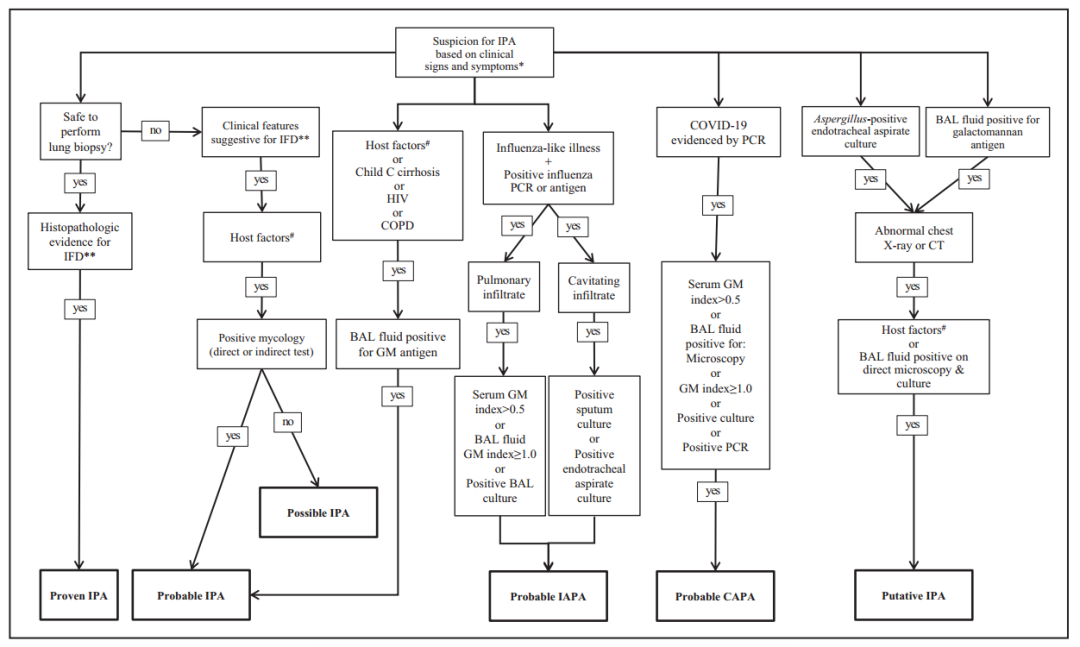
图1: 侵袭性肺曲霉菌病的诊断流程。BAL:支气管肺泡灌洗;CAPA:COVID19相关肺曲霉菌病;GM:半乳甘露聚糖抗原;HIV:人类免疫缺陷病毒;IAPA:流感相关肺曲霉菌病;IFD:侵袭性真菌疾病;IPA:侵袭性肺曲霉菌病;PCR:聚合酶链反应试验;*以下之一:在是的的抗生素治疗下仍存在顽固性发热至少3天,在退热期持续的抗生素治疗下再次出现发热持续至少48小时且找不到其他明显原因,胸膜炎胸痛,胸膜炎摩擦,呼吸困难,咯血,在适当的抗生素治疗和通气支持下呼吸功能持续恶化。**在胸部CT扫描中至少存在三种真菌感染影像学表现中的一种(致密、边界清楚的病变,有或没有晕征、空气新月征或空洞)。#以下情况之一:近期有严重中性粒细胞减少病史(中性粒细胞<500 /ml,≥10天,异体干细胞移植受者,长期使用糖皮质激素(剂量≥0.3mg/kg/天强的松当量,≥3周),3个月有使用T细胞免疫抑制剂(e。g., 环孢霉素、TNF-阻断剂、特异性单克隆抗体或核苷类似物),严重的遗传免疫缺陷。
侵袭性肺曲霉菌病的推断:鉴别曲霉定植和侵袭性肺曲霉菌病的临床流程
为了响应严格的EORTC/MSG标准,该标准不允许在没有组织病理学证据的情况下对免疫功能正常的患者中诊断IPA,Vandewoude 团队基于现有数据开发了一个临床诊断对流程。由于流程开发是用于曲霉气道定植和IPA进行鉴别的,因此进入流程的标准是呼吸道分泌物检测到曲霉菌(图 1)。在一项国际外部验证研究中,与EORTC/MSG标准相比,该流程纳入了更多可以诊断为IPA的患者(例如:大多数ICU患者没有“宿主因素”)。为区别于其他类型的诊断确定性(证实、可能、很可能),根据该流程诊断的IPA被称为“推断”IPA。虽然该流程的预测操作特征反映了一个非常高的阴性预测值,但仍存在假阳性的问题,从而可能导致非IAP患者接受了抗真菌治疗。另一方面,在危重症中呼吸道感染曲霉菌的病人进行抗真菌治疗的临床价值仍未被证实。这样的(“抢先治疗”) 策略可以降低细菌定植发展为侵袭性疾病的风险,并且是一种用在ICU有明确念珠菌定植的高危患者中的既定策略。在没有BAL液曲霉菌培养阳性和直接显微镜检查阳性的情况下,这个临床流程要求的“宿主因素”基本上与与EORTC标准定义的“宿主因素”相同,但对中性粒细胞减少症的持续时间和皮质类固醇治疗的持续时间没有具体的要求,然而,在有BAL液阳性培养结果和直接镜检阳性结果的情况下,不需要“宿主因素”来诊断“推断IPA”。研究显示许多常见的基础疾病(如:慢性阻塞性肺疾病、长期血液透析、营养不良和糖尿病)常与ICU患者的IPA相关。事实上,每一个“推断”IPA患者至少有一个基础疾病。除了慢性疾病,ICU中发生IPA的患者通常有严重的呼吸窘迫【ARDS,细菌性肺炎】和/或脓毒症,以及SOFA评分评估的器官功能障碍指数高。这些观察结果导致了这样的见解,即基本上每个具有“一些”基础病,并且具有实质性器官衰竭的ICU患者都可能处于这种危及生命的真菌并发症的风险中。此外,研究表明,CT影像中侵袭性真菌病特征性表现在一般ICU人群中很少见。在确诊为IPA的患者中,最常见非特异性浸润或实变(68%),而只有26%的患者表现为特征性的结节,高度特异性的表现如新月征、晕轮征和空洞很少被发现(分别为1%、7%和10%),事实上,在非粒细胞减少的患者中,晕轮征的敏感性(5-24%)明显低于恶性血液病中性粒细胞减少患者(82%),这些研究结果表明,EORTC/MSG标准定义的CT特征性影像表现不能作为诊断非中性粒细胞减少ICU患者IPA的必要条件,并强调需要对医学影像学结果进行有灵活解释的替代诊断方法。
临床流程入选标准的偏移
这个临床流程最初的目的是为了区分曲霉菌定植与侵袭性感染,然而IPA患者曲霉菌培养可能为阴性,随着BAL液GM检测变得越来越普遍,Schroeder团队研究了使用单一BAL液GM试验阳性作为进入临床流程(图1)的标准。他们的研究表明,使用BAL液GM检测结果作为进入该临床流程的替代标准,可能会增加危重患者IPA的诊断敏感性。
流感相关性肺曲霉病
过去认为IPA仅发生在具有“宿主因素”的免疫功能低下患者中,这一经典概念受到以下报道的挑战,但有报道称,流感患者的临床表现出现了意外的恶化,并从呼吸道样本中分离出曲霉菌,这最终导致了关于这些患者有IPA风险的概念上的改变。由于流感是一种可能影响所有人的常见病毒性疾病,有一项专家共识建议在诊断工作中去除“宿主因素”,并以另一个进入标准取代之(即流感:“因呼吸窘迫需要入住ICU的患者,流感抗原检测阳性“)(图1),这是决定性的一步,不再将IPA视为免疫功能低下患者、或患有基础疾病和急性器官功能紊乱的重症ICU患者的感染性并发症。
流感相关性肺曲霉病(IAPA)的发病机制尚未完全阐明,可以基本确定的机制有:肺上皮损伤(通过病毒血凝素结合呼吸道上皮细胞表面)NADPH氧化酶损伤和病毒对免疫应答的直接调节,流感病毒对气管粘膜上皮细胞的溶解作用为组织侵润提供了的切入点流感病毒对气管支气管上皮细胞的溶解作用是组织侵入的切入点。IAPA发病较早,通常发病时间中位数为在收住ICU后3天,这可能是预防性抗真菌治疗未能降低IAPA发生率的部分原因。
在不同的报告中ICU流感患者的IAPA发生率有所不同,从10%到32%不等,取决于研究的病例构成和所使用的标准。最近的一项荟萃分析报道称,ICU患者中IAPA的总体发病率为11%(95% CI 6-18%)。IAPA发生的危险因素包括吸烟史、男性、慢性肺病和慢性肾病。另外,使用激素可能是IAPA的诱因,并不推荐给流感患者使用激素;这包括长期维持治疗以及用于急性疾病(如:脓毒症、AECOPD和流感)本身的治疗的。报道称IAPA的死亡率一直居高不下,与没有IAPA的流感ICU患者相比,死亡率翻倍(51% vs 28%);先前提到的荟萃分析报告了ICU 患者合并IAPA的死亡率为54%(所有亚组分析死亡率>50%);有趣的是,甲型流感亚型与IAPA的发病率增加和发生IAPA的患者的较高死亡率相关。Waldeck 团队进行的一项瑞士多中心回顾性研究,研究表明在2017/2018至2019/2020流感季节期间通过PCR确诊流感的ICU患者中,有哮喘基础病[OR12.0,95%CI 2.1-67.2]和机械通气天数(OR 1.0,95%CI 1.1-1.2)与IAPA发生风险增加相关,但应该注意的是,在哮喘病例中观察到较高的IAPA发生风险,这一现象尽管具有生物学合理性,但这项研究本身并不能证明因果关系;这种因果关系需要在更多的前瞻性研究中得到证实。此外,在统计中IAPA患者的机械通气持续时间中位数显著更延长(14天[四分位距(IQR):11- 20]与2天[IQR:0-9])、ICU住院时间更长中数位(29天[95% CI 11-17] vs. 5天[95%CI 4-8],需要血管活性药物支持比例更高(75% vs. 46%),并发症的发生率更高(如ARDS [65% vs 37%]和细菌性肺部感染[35% vs. 16.4%])和死亡率更高(94% vs. 46%)。
COVID-19相关肺曲霉病
COVID-19大流行“揭示”了侵袭性曲霉病的另一个危险因素,即SARS-CoV-2的严重感染,特别是当引起呼吸窘迫需要入住ICU时。SARS-CoV-2引起的肺上皮损伤和免疫失调均易导致引起曲霉菌的协同感染;具体而言,病毒引起的直接损伤作用(通过与表达血管紧张素转换酶2和跨膜蛋白酶丝氨酸2的肺细胞结合);细胞因子风暴[白细胞介素(IL)-1、IL-6、肿瘤坏死因子(TNF)、干扰素(INF)]一起导致组织和血管源性损伤,促进了曲霉菌定殖分生孢子萌发和侵入肺组织。与IAPA相反,血管浸润在CAPA中并不常见[CAPA 20% vs. IAPA 60%]。此外,SARS-CoV-2能引起的垂死细胞释放的危险相关因子机制(DAMP)可导致肺上皮损伤和进一步的炎症反应。另一方面,抗病毒免疫所需的宿主识别途径,导致的被放任的炎症环境,有利于曲霉病的发生。关于COVID 19治疗手段(如:应用皮质激素和抗白细胞介素-6药物)导致曲霉病风险因素的机制,同样涉及CAPA的病理生理学。这项从下呼吸道样本中使用转录组学和蛋白质组学方法得出免疫表型的回顾性研究显示,CAPA患者的抗真菌免疫力在三个水平上受损:上皮细胞、吞噬细胞(调理作用、识别和杀死曲霉菌分生孢子)和中性粒细胞(脱粒和迁移减少),在IAPA患者的样本中发现了类似的三个水平的破坏。
大多数发生CAPA的患者缺乏经典的“宿主因素”, 已发现结构性肺部疾病基础、长期或大剂量皮质激素的使用和使用其他免疫调节剂易导致CAPA发生。仅有6.7%的CAPA患者存在经典“宿主因素”的免疫抑制,70%的病例是应用免疫调节治疗单独或联合使用[皮质类固醇、托珠单抗(抗IL-6)、阿那白滞素(抗IL-1)],然而,一项荷兰-比利时多中心、回顾性的研究发现,在他们的队列中,无论是单独的抗IL-6还是与皮质激素的组合,CAPA发生前的患者使用药物的累积剂量大小与CAPA发生率无关。目前的建议是不停止对COVID-19患者进行地塞米松或皮质醇激素治疗,尽管建议的强度很弱,并且证据非常少。CAPA公认的风险因素有:高龄、男性和入住ICU时病情危重。
缺乏“宿主因素”,且肺部CT对于排除CAPA方面的价值有限(与IAPA相同,但更常见的是缺乏典型体征,并与原发的病毒性疾病的体征重叠),使得CAPA诊断困难。此外,可能由于CAPA的血管侵袭较少,85%的病例血清生物标志物为阴性。另一方面,BAL液的 GM具有相当高的敏感性(74% vs 53%,BAL液培养)和非常高的特异性(99%,与BAL培养的特异性相似)。不同的研究报告的CAPA发生率差异很大,从0%到33%不等,这种差异可能归因于前面所提到的CAPA诊断的难度、用于CAPA诊断的标准的异质性、不同的风险条件和监督实践的差异。总而言之,在Kariyawasam的荟萃分析中,ICU患者中CAPA的患病率为10%(95% CI 8- 13%,I^2信息增益率 86%),其中机械通气患者亚组中为11%(95% CI 9- 15%, I^2信息增益率 86%)。
与IAPA相比,CAPA发病时间更晚; 通常从ICU入院开始发病> 7天(中位数8天,IQR 5-15),尽管有一项采用入院后直接进行BAL的策略的研究报告了更早的发病时间(4天)。但是,应强调的是,CAPA的真实患病率和发作时间仍有待进一步确定,因为大多数研究都是依赖于病情恶化的患者或上呼吸道分泌物标本培养阳性的患者的诊断。
与未并发IPA的COVID-19病例相比,CAPA与总体结局更差相关,需要ECMO的患者亚组也是如此。CAPA的死亡率较高,但现有的研究报告的死亡率变异较大,在36%-74%之间,CAPA的归因死亡率尚未完全阐明。CAPA已被认为是一种具有连续谱系的疾病,并且已有一项研究证明了这一观点,该研究显示,当诊断试验表明真菌载量较高时,死亡率也较高。
总结
总之,IPA的危险因素正在不断扩大,医生应警惕识别IPA的非经典和不断变化的危险因素。IPA在ICU的发病率很难确定,因为它高度依赖于当地的病例组合(ICU概况)。无论如何,考虑到最近的研究报告,并考虑到诊断的困难性(经常延误或错过)和极端的死亡率。总体而言,可以认为IPA是ICU中的头号真菌问题,已经超过了念珠菌血症。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







