指南与共识:中国成人糖尿病肾脏疾病医学营养治疗专家共识
2023-02-27 代谢网 代谢网 发表于安徽省
糖尿病肾脏疾病:是糖尿病主要微血管并发症之一,表现为持续性尿白蛋白排泄率增加和(或)肾小球滤过率进行性下降,最终发展为终末期肾脏疾病严重影响患者健康及生活质量。
摘要
糖尿病肾脏疾病(diabetic kidney disease,DKD)是糖尿病主要微血管并发症之一,表现为持续性尿白蛋白排泄率增加和(或)肾小球滤过率进行性下降,最终发展为终末期肾脏疾病(end stage renal disease,ESRD),严重影响患者健康及生活质量。营养不良在DKD中较为常见,可显著增加糖尿病患者全因死亡风险。医学营养治疗(medical nutrition therapy,MNT)可延缓DKD进展、降低ESRD比例,还可防治DKD导致的营养不良或蛋白质能量消耗。中华医学会内分泌学分会为制定符合中国DKD患者需求的MNT规范,组织专题讨论并制定本共识,旨在为临床工作者提供基于证据的DKD个体化MNT指导,进而延缓DKD进展、提高生存率。一、概述
糖尿病肾脏疾病(diabetic kidney disease,DKD)是指由糖尿病导致的慢性肾脏疾病(chronic kidney disease,CKD),是糖尿病主要微血管并发症之一[1]。约30%~40%的糖尿病患者可罹患DKD,主要表现为持续性尿白蛋白排泄率增加和(或)肾小球滤过率(glomerular filtration rate,GFR)进行性下降,最终发展为终末期肾脏疾病(end stage renal disease,ESRD),严重影响患者健康及生活质量。
医学营养治疗(medical nutrition therapy,MNT)是糖尿病整体治疗的基础[2],需在合理控制总热量的基础上均衡各营养素含量。DKD作为糖尿病的常见并发症之一,膳食营养与肾脏生理负荷之间的平衡对于维持患者的生活质量及临床结局至关重要。营养不良在DKD患者中较为常见,且在诸多死亡相关因素中占据重要地位。MNT不仅可延缓DKD进展,降低ESRD比率,还可防治DKD导致的营养不良或蛋白质能量消耗(protein-energy wasting,PEW)[3]。因此,中华医学会内分泌分会为制定符合中国DKD患者需求的MNT规范,组织了专题讨论并制定本共识,旨在为临床工作者提供基于证据的DKD患者个体化的MNT指导,进而延缓DKD进展、提高生存率。
本共识参照《中国2型糖尿病防治指南(2020年版)》中按GFR和尿白蛋白/肌酐比值(urinary albumin-to-creatinine ratio,UACR)分级的CKD分期(表1)[4],对DKD所致CKD(简写为DKD-CKD)不同分期患者的MNT作出建议。目前国内ESRD的糖尿病患者进行肾移植的比例较少,本共识中暂不涉及肾移植患者。本共识采用国际上通用的表述推荐强度及证据质量的方法。强推荐使用"推荐"和数字1表示,弱推荐使用"建议"和数字2表示。证据质量:●○○○,表示极低质量证据;●●○○,表示低质量证据;●●●○,表示中等质量证据;●●●●,表示高质量证据。通常按照"强推荐"规范进行处理利大于弊,"弱推荐"则需要依据患者个体情况来决定最佳方案。
二、DKD的医学营养治疗
(一)营养筛查与评估
营养筛查和评估是对DKD患者制定个体化MNT方案的前提和基础,应结合患者蛋白尿、肾功能受损程度,以及体重指数(body mass index,BMI)、血清白蛋白等相关影响因素,定期全面评估患者的营养状况并综合分析,包括人体测量(身高、体重及其近期变化、BMI、上臂肌围、握力等)、人体成分分析(生物电阻抗法)、生化指标(血清总蛋白、白蛋白、前白蛋白及总胆固醇等)、主观综合评估(subjective comprehensive assessment,SGA)结果等,制定并及时调整MNT方案。全面的MNT方案制定还需兼顾患者降糖方案、糖尿病相关并发症及合并症情况、改变膳食习惯的积极性以及临床和营养的干预目标。
(二) MNT的营养素推荐和膳食指导
根据DKD-CKD分期制定个体化方案是MNT的主旨,其重点是调整不同营养素的结构、控制能量摄入,从而有效改善人体血糖、血脂、血压等多个代谢组分,进而改善DKD患者的临床结局。
1.能量
① DKD患者总能量摄入量统一推荐标准为30~35 kcal·kg-1·d-1,根据具体活动强度与时间调整(1|●●●○)。
②超重或肥胖的DKD-CKD G1-2期患者,建议每日总能量摄入减少500~750 kcal(2|●●○○)。
DKD患者总能量摄入量统一推荐标准为30~35 kcal·kg-1·d-1,根据具体活动强度与时间调整,这一建议适用于所有透析和非透析的DKD-CKD患者[3]。与不伴CKD的单纯糖尿病患者更为关注超重/肥胖和营养过剩不同,DKD患者更易出现营养不良,尤其是PEW[5]。因此,保持足够能量摄入是预防PEW的必要条件。多项关于透析前后CKD患者的研究表明,30~35 kcal·kg-1·d-1的能量摄入有助于维持中性氮平衡和良好的营养状况[6,7,8]。血液透析(hemodialysis,HD)患者的能量需求与健康人群相当,而腹膜透析(peritoneal dialysis,PD)患者因腹透液中葡萄糖的持续吸收可影响血脂、血糖等指标,因此在计算总能量时,应减去腹膜透析液中所含葡萄糖被人体吸收的热量。
观察性研究表明,肥胖与CKD发病率升高相关,并建议肥胖的CKD患者适度减重(3~6个月减轻体重的5%~10%)以减缓肾脏疾病的进展[9]。因此,对于超重或肥胖的DKD-CKD G1-2期患者,建议每日总能量摄入减少500~750 kcal,即女性每天1 200~1 500 kcal的能量摄入,男性每天1 500~1 800 kcal的能量摄入[10,11,12]。对于久坐不动的老年患者,推荐30 kcal·kg-1·d-1的能量摄入。
膳食指导:对于碳水化合物、脂肪、蛋白质三大宏量营养素目前尚无最佳摄入比例。在控制总能量的前提下,DKD患者NMT的制定需强调食物的合理性和个体化,并结合饮食行为习惯、饮食偏好及代谢目标[13]。建议定时定量进餐,合理分配三餐的能量,蛋白质总量均衡分配于三餐,以利于血糖平稳。
食物种类可以多样化:合理控制碳水化合物摄入量;蛋白质的摄入目标根据DKD-CKD分期具体而定,不建议极低蛋白饮食;脂肪摄入类型较为重要,需减少饱和脂肪酸及反式脂肪酸的摄入;提高膳食纤维摄入;减少钠盐摄入;关注维生素及微量元素摄入等。
2.碳水化合物
①建议每日摄入碳水化合物提供的能量占总能量的45%~60%(2|●●○○)。
②建议选择血糖指数(glycemic index,GI)较低的碳水化合物(2|●●○○)。
碳水化合物是为人体生命活动供能的主要来源,DKD患者每日碳水化合物所提供的能量,建议占总摄入能量的45%~60%[3]。近些年,低碳水化合物和低蛋白质比例的生酮饮食在糖尿病人群中悄然流行。虽然生酮饮食中的低碳水化合物比例可显著改善血糖、血脂、胰岛素抵抗和体重,从而有利于延缓DKD的进展[14,15],但较高的脂肪比例和极端模式使其远期疗效存在较大争议[16,17]。动物研究表明,相较于接受低碳水化合物、高蛋白饮食的小鼠,接受高碳水化合物、低蛋白饮食的小鼠血压、葡萄糖耐量及血清胆固醇水平等代谢指标控制得更为良好,并拥有更长的寿命[18]。此外,需限制蛋白质摄入量的DKD患者如长期过低碳水化合物摄入,PEW发生率将明显增加,因此,不建议DKD患者过低的碳水化合物摄入。另外,鉴于约45%~60%的能量摄入来自碳水化合物,建议仔细考虑膳食碳水化合物的来源,如来自糖类的碳水化合物应限制在能量摄入的10%以下。尽量选取低GI食物,碳水化合物GI值越低,其供能比例可适当增加,最高可达60%(表2)。 膳食指导:DKD患者减少膳食蛋白摄入的同时,碳水化合物的比例将相应增加,建议选择GI较低的食物。一般情况下,膳食纤维含量越高,GI越低。因此,建议适当增加膳食纤维,如增加全谷物摄入。全谷物食物(如糙米、全麦面包等)的纤维和水分含量较高,与等体积的相应精致谷物食物相比,全谷物食物所含的能量较低,除有助于稳定血糖,还可降低人群全因死亡风险[19]。此外,还应保持碳水化合物摄入的一致性,有助于维持血糖稳定和预防低血糖发生。
膳食指导:DKD患者减少膳食蛋白摄入的同时,碳水化合物的比例将相应增加,建议选择GI较低的食物。一般情况下,膳食纤维含量越高,GI越低。因此,建议适当增加膳食纤维,如增加全谷物摄入。全谷物食物(如糙米、全麦面包等)的纤维和水分含量较高,与等体积的相应精致谷物食物相比,全谷物食物所含的能量较低,除有助于稳定血糖,还可降低人群全因死亡风险[19]。此外,还应保持碳水化合物摄入的一致性,有助于维持血糖稳定和预防低血糖发生。
3.蛋白质
限制蛋白质摄入是DKD患者重要的治疗手段之一。研究显示,低优质蛋白饮食可以减少DKD患者蛋白尿,改善肾脏功能[21,22]。但是,过低(<0.8 g·kg-1·d-1)或过高(超过1.4 g·kg-1·d-1)的蛋白质摄入与死亡风险增加有关[23,24]。而对于超重或者肥胖患者,建议使用理想体重而非实际体重计算每日蛋白质摄入量,以避免过高的蛋白质摄入量(表3)。
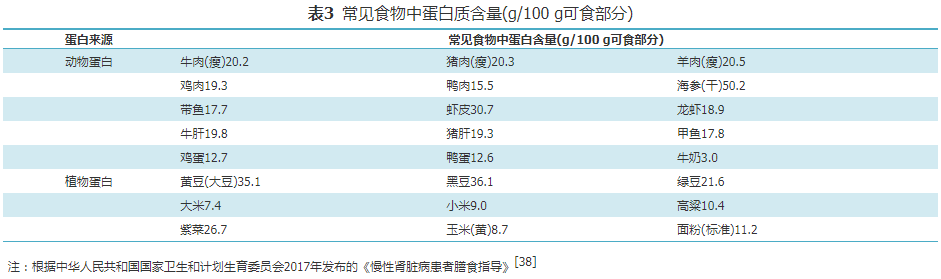 (1)DKD-CKD G1-2期患者
(1)DKD-CKD G1-2期患者
推荐DKD-CKD G1-2期患者蛋白质的摄入量为0.8 g·kg-1·d-1(1|●●●○)。
WHO推荐健康成年人群0.8 g·kg-1·d-1的蛋白质摄入量[25],而成人糖尿病患者同样需要0.8 g·kg-1·d-1的蛋白质摄入即可维持氮平衡[26]。与0.8 g·kg-1·d-1的标准膳食蛋白质摄入量相比,低膳食蛋白质摄入量可能可以减少肾小球滤过率,减缓CKD的进展[27]。但是对于DKD患者,由于还需要限制碳水化合物总量以及脂肪的摄入,过低的蛋白质摄入量势必会导致每日总能量减少,将增加PEW风险。因此,对于稳定的DKD-CKD G1-2期患者,建议0.8 g·kg-1·d-1的蛋白质摄入量。同时,蛋白质的摄入对于预防DKD患者低血糖的发生尤为重要。而过高蛋白质饮食(>1.3 g·kg-1·d-1)不利于DKD患者,会增加轻度肾损伤患者肾功能进一步受损的风险[28,29,30]。研究显示,将伴有大量白蛋白尿(A3期)DKD患者的蛋白质摄入量减至0.8 g·kg-1·d-1以下,可明显延缓肾功能减退[28]。因此,DKD-CKD早期低蛋白饮食管理十分重要,即使是A1-2期轻度肾功能受损的DKD患者,也不建议在0.8 g·kg-1·d-1基础上增加蛋白质摄入。
(2)DKD-CKD G3-5期非透析患者
推荐DKD-CKD G3-5期非透析患者蛋白质摄入量为0.6~0.8 g·kg-1·d-1,并补充复方α-酮酸制剂0.12 g·kg-1·d-1(1|●●●○)。
DKD-CKD G3-5期患者更易出现ESRD,积极限制蛋白质摄入显得尤为重要。目前在DKD人群中,缺乏比较不同蛋白质摄入量对临床结局影响的临床试验,根据WHO对普通人群蛋白质摄入量的建议(0.8 g·kg-1·d-1),推荐非透析DKD患者均采用0.8 g·kg-1·d-1的蛋白质摄入量[31]。但多个RCT研究显示,对于CKD G3-5期患者0.55~0.60 g·kg-1·d-1的蛋白质摄入量优于0.8 g·kg-1·d-1的推荐量,更低的蛋白质摄入量可带来生存质量和eGFR的获益[8,32,33]。目前认为,0.6~0.8 g·kg-1·d-1的蛋白质摄入量可为DKD-CKD G3-5期患者带来肾功能获益,同时可补充复方α-酮酸进一步改善肾功能并维持良好的营养状况[34,35]。而极低蛋白质饮食(0.28~0.40 g·kg-1·d-1)对于DKD患者肾功能的影响缺乏大规模的循证医学证据。考虑到糖尿病患者在进行低蛋白饮食过程中,更易出现PEW,因此,建议可同时补充酮酸制剂0.12 g·kg-1·d-1。
(3)DKD-CKD G5期透析患者
建议DKD-CKD G5期透析患者蛋白质摄入量为1.0~1.2 g·kg-1·d-1(2|●●○○)。
对于接受透析的DKD患者,观察性研究表明,低膳食蛋白质摄入与较高的住院率和较高的死亡率相关[36]。尿毒症本身也会导致食欲下降、分解代谢增加和肌肉质量下降,透析时会丢失一部分氨基酸、多肽和少量血液,所以透析患者的蛋白摄入量要高于非透析患者。此外,考虑到糖尿病患者糖异生减少,略增加透析的DKD患者蛋白质摄入量有利于预防低血糖症。Ko等[3]通过对DKD现有指南和相关研究的meta分析,建议对于接受透析的DKD患者摄入1.2 g·kg-1·d-1的膳食蛋白质。2020年KDIGO和KDOQI指南均推荐,DKD透析患者蛋白质的摄入应维持在1.0~1.2 g·kg-1·d-1,同时,优质蛋白质的比例应占到50%以上[31,37,38]。
膳食指导:通常动物蛋白营养价值优于植物蛋白。肉、蛋、奶和大豆类食物中所含有的必需氨基酸可满足人体需要,在医学上称为优质蛋白质或完全蛋白质。新鲜肌肉类含蛋白质15%~22%,蛋类含蛋白质11%~14%,乳类含蛋白质3%~3.5%,谷类含蛋白质8%左右,豆类的蛋白质丰富,尤其是大豆含量高达35%~40%。推荐DKD患者以白肉(鱼和鸡肉类)、蛋类、蔬菜和奶类为主要来源的低蛋白质饮食。从牛奶中提取的乳清蛋白,因其纯度高、吸收率高、氨基酸组成最合理等,蛋白质中营养价值最高,还可降低超重糖尿病患者餐后糖负荷,从而有效减少肥胖相关性疾病的发生风险[39,40]。建议适当的大豆蛋白摄入,比动物蛋白更有利于血脂控制[41,42]。建议减少红肉摄入,大量食用红肉和加工肉类与CKD进展和死亡风险增加有关[43,44]。同时,为了避免蛋白质摄入过量或优质蛋白质摄入不足,可适当选择低蛋白质主食代替传统主食。
4.脂肪
①推荐调整DKD患者脂肪摄入的构成比例,减少饱和脂肪酸和反式脂肪酸摄入,适当增加多不饱和脂肪酸摄入(1|●●●○)。
②建议DKD患者饱和脂肪酸和反式脂肪酸摄入量占每日总能量的比例不应超过10%(2|●●●○)。
③建议DKD患者MUFA摄入在脂肪摄入总量中的比例宜为10%~20%(2|●●○○)。
限制脂肪摄入是DKD患者MNT制定的重要环节,长期高脂饮食可导致肾小球胶原纤维增生、促进炎症的发生发展以及全身脏器的损伤。然而,目前DKD患者的最佳推荐脂肪摄入量尚不确定(表4)。 不同类型脂肪对代谢状态的影响不同,需注意调整摄入脂肪的构成比例。2017年卫生部制定的《慢性肾脏病患者膳食指导》建议减少饱和脂肪酸(saturated fatty acid,SFA)和反式脂肪酸(trans-fatty acids,TFA)摄入,适当提高ω-3多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)和单不饱和脂肪酸(monounsaturated fatty acid,MUFA)的摄入[38]。研究发现,SFA及TFA是血低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)升高的主要因素,减少二者摄入有利于维持DKD患者心血管系统健康,建议摄入占每日总能量的比例不超过10%[1,45]。多项研究表明,富含ω-3、ω-6等PUFA的膳食可减轻炎症和内皮功能障碍、改善血压血脂[46]、降低心血管疾病发生率、保护DKD患者肾功能、减少蛋白尿发生[47]。队列研究显示,膳食中PUFA摄入量与DKD患者的ESRD发病率显著负相关[3,48];SFA/PUFA的比值越高,蛋白尿升高越显著[49]。因此建议适当增加PUFA摄入量。膳食中MUFA也可改善血脂和脂蛋白水平[45],其比例增加还助于改善糖耐量。但MUFA摄入过量可能会导致体重增加,因此在脂肪摄入总量中的比例宜为10%~20%。胆固醇过量摄入可增加动脉硬化及缺血性心脑血管疾病的风险,建议限制胆固醇摄入,每日控制在300 mg以内。
不同类型脂肪对代谢状态的影响不同,需注意调整摄入脂肪的构成比例。2017年卫生部制定的《慢性肾脏病患者膳食指导》建议减少饱和脂肪酸(saturated fatty acid,SFA)和反式脂肪酸(trans-fatty acids,TFA)摄入,适当提高ω-3多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)和单不饱和脂肪酸(monounsaturated fatty acid,MUFA)的摄入[38]。研究发现,SFA及TFA是血低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)升高的主要因素,减少二者摄入有利于维持DKD患者心血管系统健康,建议摄入占每日总能量的比例不超过10%[1,45]。多项研究表明,富含ω-3、ω-6等PUFA的膳食可减轻炎症和内皮功能障碍、改善血压血脂[46]、降低心血管疾病发生率、保护DKD患者肾功能、减少蛋白尿发生[47]。队列研究显示,膳食中PUFA摄入量与DKD患者的ESRD发病率显著负相关[3,48];SFA/PUFA的比值越高,蛋白尿升高越显著[49]。因此建议适当增加PUFA摄入量。膳食中MUFA也可改善血脂和脂蛋白水平[45],其比例增加还助于改善糖耐量。但MUFA摄入过量可能会导致体重增加,因此在脂肪摄入总量中的比例宜为10%~20%。胆固醇过量摄入可增加动脉硬化及缺血性心脑血管疾病的风险,建议限制胆固醇摄入,每日控制在300 mg以内。
膳食指导:膳食脂肪主要来源于动物的脂肪组织和肉类、坚果和植物的种子。大多数动物性脂肪含40%~60%的SFA、30%~50%的MUFA及少量的PUFA;而植物油中含10%~20%的SFA、80%~90%的UFA[50]。建议DKD患者每周可吃2~3次鱼(最好每周吃1次ω-3脂肪酸含量丰富的海鱼)或尽可能选用花生油、大豆油、葵花籽油及橄榄油等富含PUFA的植物油。但每日植物油的摄入也应控制在50 g以下。尽量避免食用富含反式脂肪酸(如油炸食品、烘焙甜点等)和饱和脂肪酸(如猪油、牛油等)的食物。
5.无机盐
(1)钠
①建议各期DKD-CKD患者钠摄入量1.2~2.0 g/d(食盐3.0~5.0 g/d)(2|●●●○)。
②建议合并高血压的DKD患者,膳食钠摄入量应个体化管理(2|●●○○)。
观察性研究显示,DKD患者多伴有高血压,钠盐摄入是DKD患者GFR逐年下降的独立危险因素。高钠饮食与DKD患者ESRD阶段的高死亡风险密切相关,并可造成透析间期体重增长过多。一项基于多项RCT研究的meta分析显示,低钠饮食(平均每日食盐摄入5.4 g)可通过改善血压、蛋白尿排泄来延缓DKD患者肾功能下降,进而延缓其发展为ESRD的可能性[51]。然而,严格低钠饮食可能会引起肾素-血管紧张素-醛固酮系统(renin angiotensin aldosterone system,RAAS)和交感神经系统激活,进一步降低胰岛素敏感性,影响糖代谢[52];极低钠盐摄入可增加ESRD比率及其死亡风险,通常不应低于1.2 g/d(食盐3 g/d)[53]。结合世界卫生组织及《中国居民膳食指南(2022版)》对于成人日常食盐摄入的最新要求,本共识推荐各期的DKD-CKD患者钠摄入量1.2~2.0 g/d(食盐3.0~5.0 g/d)。对于合并高血压的DKD患者,膳食钠摄入量应个体化管理。
膳食指导:钠在天然食物中含量并不高,膳食钠的主要来源为食盐、盐渍及腌制肉或烟熏肉、酱菜咸菜,含钠的调味品(如酱油、味精)及加工食品[50]。每日推荐的钠摄入量需将食盐、调味品及加工食品中的钠都包含在内。建议DKD患者尽量食用新鲜食材,同时避免食用含钠高的调味品或加工食品。常用换算:1 g钠约等于2.5 g氯化钠或食盐的量,6 mL酱油约等于1 g食盐的量(表5)。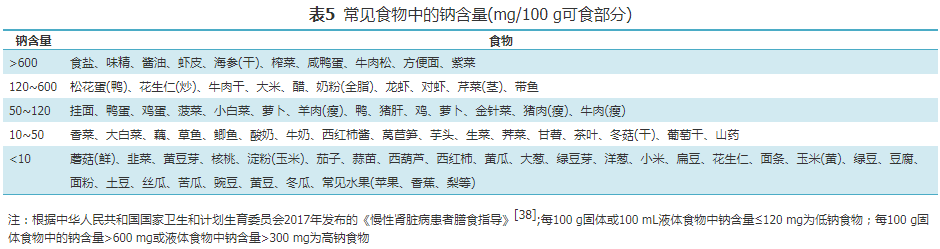 (2)钾
(2)钾
建议各期DKD-CKD患者结合肾功能个体化调整饮食中钾的摄入,以保证血钾在正常范围(2|●●○○)。
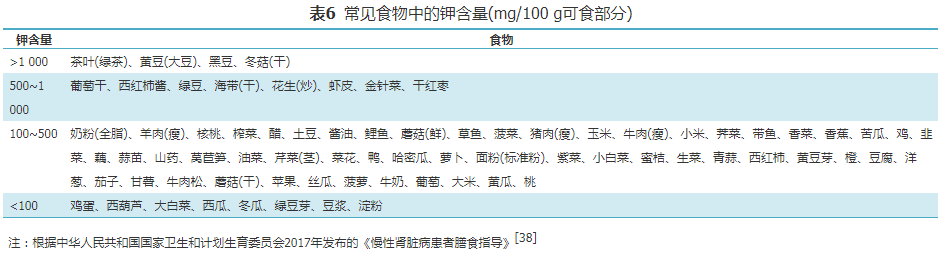
观察性研究显示,DKD-CKD G3-5期患者可反复出现高钾血症,随着肾功能恶化,DKD患者高钾血症的患病率逐渐升高[54]。DKD-CKD G4-5期RAAS抑制剂的使用因高钾血症被限制后,DKD进展风险进一步增加。目前关于DKD-CKD G3-5期患者钾的摄入量尚缺乏高质量循证医学证据。2021年《中国慢性肾脏病营养治疗临床实践指南(2021版)》建议CKD G3-5期糖尿病伴高钾血症患者减少饮食中钾的摄入,必要时口服降钾药物[12]。
因此,DKD-CKD G3-5期患者如出现高钾血症,需个体化调整饮食中钾的摄入,以维持血钾在正常范围。需定期监测血钾水平,并根据血钾调整膳食钾的摄入,每日尿量大于1 500 mL和血钾正常时,不必限制钾的摄入。血钾>5.0 mmol/L时,即需限制高钾食物的摄入,血钾>5.5 mmol/L的肾功能衰竭患者,推荐饮食钾摄入量应<3 g/d(<77 mmol/d)[55]。禁用低钠盐和平衡盐等特殊食盐,少用酱油等调味品。DKD-CKD G5期的HD/PD患者,尤其是PD患者可出现低钾血症,导致其全因死亡风险以及心血管疾病死亡风险显著增加[56]。建议伴有低钾血症的DKD-CKD G5期透析患者适量增加膳食钾的摄入。
膳食指导:针对高钾血症的DKD患者,建议选择钾含量较低的水果和蔬菜,而对谷物、土豆、玉米,大豆、坚果、西红柿、香蕉、蘑菇、橘子、甜瓜、猕猴桃、动物内脏等含钾丰富的食物必须加以限制。另外,一些烹饪方式,如土豆等薯芋类食物切块并用水浸泡冲洗、蔬菜切碎用水冲洗或焯水后烹饪等均可不同程度减少钾含量(表6)。
 (3)钙
(3)钙
建议各期DKD-CKD患者根据血钙水平调整钙的摄入(2|●●○○)。
研究明确显示,DKD是骨质疏松的重要危险因素。DKD-CKD早期患者肾脏1α-羟化酶合成减少,进而导致1,25(OH)2D3合成减少以及血钙水平下降,因此该阶段患者的钙代谢紊乱主要表现为低钙血症。DKD-CKD后期,低钙血症可导致高转化性肾性骨病和继发性甲状旁腺功能亢进症,进而导致死亡率增加;如进展为三发性甲状旁腺功能亢进症患者可出现高钙血症。
流行病学研究显示,血钙紊乱(尤其是高钙血症)明显增加患者心血管事件及死亡风险。DKD-CKD各期患者钙的摄入量大致同NDKD-CKD患者。2019年《中国慢性肾脏疾病矿物质和骨异常诊治指南》建议成人CKD G3-5期患者尽可能避免高钙血症[57]。2020年最新KDOQI CKD营养指南对于CKD G3-4期未接受活性维生素D类似物治疗的患者,建议总钙摄入量为800~1 000 mg/d(包括饮食钙、钙剂、含钙磷结合剂等)以维持钙平衡[31]。部分DKD患者需要补充α-酮酸改善营养状态,需注意的是每片α-酮酸含钙约50 mg,可能增加患者的钙负荷,需密切监测血钙,及时调整膳食钙和维生素D的摄入量。
膳食指导:动物性食物中的贝类、鱼类和蛋类中钙含量较高,畜肉和禽类含钙量低。部分植物性食物虽然钙含量较高,但生物利用度差[50]。牛奶及其制品是膳食钙的最主要来源,鲜乳中钙含量100~120 mg/100 mL。大豆及其制品中钙源也较丰富,豆腐中钙含量100~140 mg/100 g。建议根据血钙、血磷、维生素D水平、蛋白需求调整钙摄入(表7)。
 (4)磷
(4)磷
建议DKD-CKD G3-5期患者尽可能将血磷降至接近正常范围(2|●●○○)。
DKD-CKD G3-5期患者易出现高磷血症,是HD患者死亡和心血管并发症的独立危险因素。观察性研究显示,高磷/蛋白比值与HD患者的死亡率密切相关。由于磷酸盐与骨骼肌钙水平处于稳态平衡,二者失衡会导致显著的钙流失和骨病发生。DKD-CKD G3b-5期患者的血清磷酸盐应维持在0.9~1.5 mmol/L,HD或PD患者的血磷应保持在1.1~1.7 mmol/L。2019年《中国慢性肾脏病矿物质和骨异常诊治指南》建议CKD G3-5期患者,血磷如超过目标值,应限制饮食磷摄入800~1 000 mg/d,或联合其他降磷措施[57]。控制蛋白质摄入(0.8 g·kg-1·d-1)联合复方α酮酸可改善HD患者的高磷血症。膳食磷的摄入还需结合血钙、血甲状旁腺激素综合评估。
膳食指导:磷在动物性及植物性食物中均含量丰富,但常与蛋白质并存。进行限磷饮食时应考虑磷的来源(植物或动物蛋白中的有机磷、食品中的含磷添加剂),应选择磷/蛋白比值低、磷吸收率低的食物,限制含有大量磷酸盐添加剂的食物摄入,如瘦肉、蛋黄、动物内脏、坚果等(表8)。
 6.维生素和微量元素
6.维生素和微量元素
(1)维生素D
建议各期DKD-CKD合并维生素D不足或缺乏的患者适当补充维生素D3或D2(2|●○○○)。
研究显示,维生素D(VitD)缺乏与DKD的发生发展有关,VitD补充有利于改善骨代谢状态及血脂水平[58]。随着eGFR降低,VitD活性代谢物水平逐渐下降。队列研究显示,90%以上DKD-CKD G5期患者存在VitD缺乏。动物研究显示,VitD补充可减慢DKD肾小球硬化和蛋白尿进展,维持足细胞正常[59],其活性代谢物1,25(OH)2D3可抑制肾素基因转录、下调RAAS系统[60]、改善血脂谱和氧化应激;可改善DKD患者的骨质代谢状态,部分程度预防骨折。DKD-CKD早期低钙血症时建议适当增加富含VitD食物的摄入,以预防继发性甲状旁腺功能亢进症;后期出现高钙血症时VitD补充需慎重。
膳食指导:对于VitD缺乏和(或)合并低钙血症的患者,建议适当增加富含VitD的食物,如鱼类、鱼肝油、动物肝脏、菠菜、西红柿、蛋黄、瘦肉、牛奶、乳酪等,根据病情结合药物补充。
(2)维生素A、B、C、E
①建议DKD-CKD G1-5期的成人患者,如果证实维生素B或C缺乏可给予适当的补充(2|●●○○)。
③不建议常规补充维生素A或E(2|●○○○)。
糖尿病预防计划结果研究(Diabetes Prevention Program Outcomes Study,DPPOS)报告指出,二甲双胍与维生素B12缺乏有关[61];de Jager等[62]研究显示维生素B12浓度的降低随着二甲双胍治疗时间延长发生概率增加,建议长期接受二甲双胍治疗(>4年)或有维生素B12水平低风险的患者考虑定期监测维生素B12水平。DKD患者可能合并维生素B6、叶酸等B族维生素缺乏,尤其是合并周围神经病变的患者建议适当增加富含B族维生素食物摄入。对于有维生素C缺乏风险的HD患者,建议增加富含维生素C食物摄入。
研究显示,尿毒症期患者维生素A或E水平常升高,为避免增加潜在的毒性反应,不建议常规补充维生素A或E。
膳食指导:五谷杂粮、绿叶蔬菜等食物中富含B族维生素,如芦笋、杏仁、瘦肉、菠菜、洋葱、大蒜、蛋、鸡肉、花生、牛奶、动物肝脏等。而绿叶蔬菜和新鲜水果富含维生素C,如芹菜、菠菜、油菜、荠菜、白菜、包菜、西兰花、青椒等。
(3)微量元素
建议仅对伴有微量元素缺乏并引起相关症状或生化指标异常的DKD-CKD G3-5期患者补充微量元素(2|●○○○)。
2020年最新KDOQI营养指南不建议包含DKD在内的CKD成人患者常规补充硒和锌[37]。如长期低蛋白质摄入或血浆载体蛋白水平降低可能导致锌和硒缺乏[63]。横断面研究显示,缺锌可加重一些尿毒症症状,例如失聪、嗅觉敏锐度受损、厌食、伤口愈合延迟等[64]。在透析前DKD-CKD患者中,缺铁很少见,但对于低蛋白饮食和长期素食的患者可能需要补充铁。另外,如出现贫血时,应补充含铁量高的食物。补充铁元素有利于增加促红细胞生成素疗效。
膳食指导:建议存在常见微量元素缺乏的患者,在兼顾血糖的情况下,可适当增加膳食摄入。富含锌的食物有牡蛎、麦芽,其次是瘦肉、鱼类、牛奶、核桃、花生、芝麻、紫菜、动物肝脏等;富含硒量的食物有鱼、龙虾及一些甲壳类水产;富含铁的食物:动物肝脏和血液、红色肉类、鱼虾贝类等。
7.膳食纤维
建议DKD患者适当增加膳食纤维摄入(2|●●○○)。
研究表明,富含膳食纤维的饮食对DKD患者有多方面的益处:减少蛋白质并增加碳水化合物的发酵,调节肠道菌群的新陈代谢[65];增加肠道蠕动、缓解便秘[66];增加短链脂肪酸(short-chain fatty acids,SCFA)的产量,为肠道微生物群供能[67]。研究发现,SCFA还有助于维持肠道屏障的功能和完整性,保持腔内pH值,抑制病原体的生长,影响肠道运动,降低促炎参数、氧化应激和一些肠道来源的尿毒素水平,以及改善胰岛素抵抗、铁代谢和生活质量,从而延缓DKD的进展、降低死亡率[68,69]。队列研究发现,糖尿病患者便秘比率较高,而便秘可加重DKD患者的肠道菌群失调[70],且为DKD进展的危险因素[71]。本共识建议DKD患者适当增加膳食纤维摄入(表9)。
 膳食指导:全谷物类、豆类、水果、蔬菜、马铃薯是膳食纤维的主要来源,坚果和种子中的膳食纤维含量也较高。食物加工越精细,膳食纤维含量越少,建议降低加工食物的精细程度,如避免将水果榨成果汁食用。
膳食指导:全谷物类、豆类、水果、蔬菜、马铃薯是膳食纤维的主要来源,坚果和种子中的膳食纤维含量也较高。食物加工越精细,膳食纤维含量越少,建议降低加工食物的精细程度,如避免将水果榨成果汁食用。
8.酒精
①不建议各期的DKD-CKD患者饮酒(2|●○○○)。
②既往饮酒的患者,建议严格控制饮酒量,每天不超过1个酒精单位[1个酒精单位约合14 g纯酒精,相当于酒精浓度(alcohol by volume,ABV)12%红酒145 mL,ABV 3.5%啤酒497 mL或ABV 40%的白酒43 mL],且限制在总摄入能量的5%(2●|○○○)。
③建议使用胰岛素和(或)促胰岛素分泌剂的DKD患者,饮酒时适当增加碳水化合物,避免低血糖发生(2●|○○○)。
糖尿病患者饮酒可引起血糖较大波动,持续过量饮酒(每天≥3个酒精单位)可引起血糖明显升高,而应用胰岛素和(或)胰岛素促泌剂的患者饮酒后可能出现延迟性低血糖。观察研究表明,饮酒是DKD的独立危险因素[72]。尽管多项meta分析表明,适度饮酒可减缓CKD患者(尤其是男性)GFR下降速率,对其肾功能具有不同程度保护作用[73,74],目前对于DKD-CKD患者是否饮酒以及每日饮酒摄入量仍存在较大争议。2020年《糖尿病肾病多学科诊治与管理专家共识》建议DKD患者限酒,男性每天饮酒量应小于2个酒精单位,女性小于1个酒精单位,同时,要对患者进行饮酒后可能出现低血糖进行宣教,特别是使用胰岛素治疗的患者。《中国居民膳食指南(2022版)》不建议慢性病患者饮酒,成人如饮酒,每天饮酒量不超过15 g(约1个酒精单位)。综上,本共识中不推荐DKD-CKD患者饮酒,如患者既往已习惯性饮酒,建议严格限制饮酒量,每天不超过1个酒精单位。饮酒时把饮酒量计算入总能量范围内,限制在总能量摄入的5%。
膳食指导:不建议DKD患者饮酒,如需饮酒,先行咨询医师或营养师,严格限制饮酒量。建议应用胰岛素和(或)促胰岛素分泌剂的DKD患者,饮酒时应适当增加碳水化合物摄入,避免低血糖发生。
三、结语
DKD作为糖尿病的常见并发症,也是CKD最常见的原因之一,严重影响患者预后及生活质量。除药物治疗外,MNT对于延缓DKD进展、改善预后也发挥着不容小觑的作用。对于DKD患者,根据所处CKD的分期,不同的营养元素摄入均需予以相应的指导。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






