【论著】| 不同部位胃腺癌第12a组淋巴结转移的危险因素分析
2023-08-07 中国癌症杂志 中国癌症杂志 发表于上海
本研究通过观察不同部位胃癌第12a组淋巴结的转移率,探讨不同部位胃癌第12a组淋巴结转移的危险因素。
背景与目的:
胃癌中肝十二指肠韧带内(沿肝动脉)淋巴结(第12a组淋巴结)转移规律尚不明确,其清扫指征仍有争议,目前缺乏大样本的相关临床研究数据。本研究通过观察不同部位胃癌第12a组淋巴结的转移率,探讨不同部位胃癌第12a组淋巴结转移的危险因素。
方法:对河南省人民医院2016年5月—2021年7月胃外科收治的1 112例胃癌患者的病历资料进行回顾性分析,根据肿瘤位置分为胃上部癌(561例)、胃体癌(224例)、胃窦癌(327例),记录不同部位胃癌患者第12a组淋巴结转移率。采用χ2检验或Fisher确切概率检验比较不同部位胃癌患者第12a组淋巴结转移与临床病理学特征的关系,通过多因素logistic回归分析不同部位胃癌患者第12a组淋巴结转移的危险因素。
结果:1 112例胃癌患者中72例发生第12a组淋巴结转移,整体转移率为6.5%。561例胃上部癌中有25例发生第12a组淋巴结转移,转移率为4.5%。224例胃体癌中有17例第12a组淋巴结为阳性,转移率为7.6%;327例胃窦癌中有30例第12a组淋巴结为阳性,转移率为9.2%。以第12a组淋巴结是否转移为因变量,以单因素分析差异有统计学意义的指标为自变量,纳入模型进行多因素logistic回归分析。结果显示,肿瘤直径(OR=3.122,95% CI:2.896~3.366,P<0.001)、T分期(OR=2.406,95% CI:1.705~3.396,P<0.001)及TNM分期(OR=7.91,95% CI:4.755~13.160,P<0.001)是胃上部癌患者第12a组淋巴结转移的危险因素;肿瘤直径(OR=2.757,95% CI:2.495~3.047,P<0.001)、T分期(OR=3.298,95% CI:2.346~4.638,P <0.001)及脉管神经侵犯(OR = 1.839,95% CI:1.368~2.473,P<0.001)是胃体癌患者第12a组淋巴结转移的危险因素;体重指数(body mass index,BMI)(OR=1.098,95% CI:1.023~1.178,P=0.010)、肿瘤直径(OR = 2.865,95% CI:1.778 ~ 4.616,P<0.001)、T分期(OR=13.497,95% CI:8.363~21.783,P<0.001)及TNM分期(OR=3.806,95% CI:3.113~4.653,P <0.001)是胃窦癌患者第12a组淋巴结转移的危险因素。
结论:第12a组淋巴结总转移率较低;肿瘤大小、浸润深度、肿瘤分期是胃癌第12a组淋巴结转移的独立危险因素,同时神经血管侵犯是胃体癌的独立危险因素;胃体、胃窦癌需要常规清扫第12a组淋巴结;胃上部癌第12a组淋巴结转移率低,不需要常规清扫,但当直径≥6 cm、肿瘤浸润深度较深(T3~TBackground and purpose: It is not clear that the pattern of lymph node (group 12a) metastasis within the hepatoduodenal ligament (along the hepatic artery) in gastric cancer, its indications for disp are still controversial, and there is a lack of relevant clinical study data from large samples. This study investigated the risk factors of lymph node group 12a metastasis )、肿瘤分期较晚(Ⅲ ~ Ⅳ)时则需要清扫第12a组淋巴结。
胃癌是严重威胁人类健康的恶性肿瘤。2020年世界卫生组织(World Health Organization, WHO)统计数据[1]显示,全球胃癌发病率位于恶性肿瘤新发病第5位,死亡率位于恶性肿瘤第3位。中国每年新发胃癌患者人数占全球的43.9%,严重威胁中国人民群众生命健康[2]。淋巴结转移是胃癌最常见的转移类型,目前治疗胃癌的根本原则是胃切除术加淋巴结清扫。然而,由于较高的围手术期死亡率,D2淋巴结清扫一直饱受争议[3-4]。但是D2淋巴结清扫可以减轻癌症负担,且可以帮助明确N分期,因此,胃癌根治术联合D2淋巴结清扫已经成为日本晚期胃癌的标准治疗方法[5]。第12a组淋巴结为肝十二指肠韧带内(沿肝动脉)淋巴结。
然而,第12a组淋巴结的转移应该认为是区域性的还是远距离性的,该站是否应被纳入D2淋巴结切除范围仍有争议 [6],尤其是对于胃上部癌而言。第12a淋巴结转移被第7版美国癌症联合会(American Joint Committee on Cancer,AJCC)指南归类为远处转移[7],然而,第8版AJCC指南又重新将其归类为区域淋巴结转移[8]。在远端胃或全胃切除+D2淋巴结清扫时,第1、3、4sb、4d、5、6、 7、8a、9、11p、12a组淋巴结的清扫是必不可少的。但是,两项大型随机试验[9-10]的结果未能证明D2淋巴结清扫较D1淋巴结清扫有明显的生存益处,另外,据报道第12a淋巴结的转移率为1.7%~18.2%[11-14],且其转移主要与胃窦部的肿瘤高度相关[14],那么其他部位的第12a组淋巴结的转移规律又是怎样的,是否各部位胃癌都需要清扫第12a组淋巴结,目前尚不清楚。本研究旨在比较不同位置胃癌患者第12a组淋巴结转移情况,并探讨第12a组淋巴结清扫指征。
1 资料和方法
1.1 一般资料
2016年5月—2021年7月河南省人民医院诊治胃癌患者1 112例,其中男性603例,女性509例;患者年龄25~87岁,其中<65岁649例,≥65岁463例;胃上部癌(贲门癌和胃底癌)561例,胃窦癌(胃角以下部分胃癌)327例,胃体癌224例。
入选标准:
① 行腹腔镜辅助根治性全胃切除/远端胃切除+标准D2/D2+淋巴结清扫术,达到R0切除;
② 手术切除组织经病理学检查证实为胃腺癌;
③ 分组拣取各组淋巴结并送组织病理学检查;
④ 临床病理学资料完整;
⑤ 经河南省人民医院伦理委员会批准,患者均清扫第12a组淋巴结。
排除标准:
① 残胃癌患者;
② 接受新辅助化疗者;
③ 未行根治性切除术者;
④ 切除淋巴结<16枚者;
⑤ 未分组捡取淋巴结者。
第12a组淋巴结定义:第12淋巴结位于肝十二指肠韧带内,沿肝动脉、胆管、门静脉分布的淋巴结。分为下列5个亚组:第12a组淋巴结(肝动脉旁淋巴结),沿肝总动脉的淋巴结;第12b组淋巴结(胆总管旁淋巴结),沿胆总管的淋巴结;第12p组淋巴结(门静脉后淋巴结),沿门静脉的淋巴结;第12h组淋巴结(肝门淋巴结),肝门区的淋巴结;第12c组淋巴结(胆囊管旁淋巴结),沿胆囊管的淋巴结。
1.2 方法
1.2.1 手术方法
手术过程(以Roux-en-Y切除为例):麻醉成功后取平卧分腿位。常规消毒铺巾,建立气腹。游离胃网膜右系膜与结肠肝曲间隙,完整切除胃网膜右系膜,自根部离断胃网膜右血管及幽门下血管。清扫第6组淋巴结,并充分裸化十二指肠。于幽门下方约2 cm处,离断十二指肠并加固残端。在胰腺上缘,游离胃右系膜及胃左系膜,游离、显露肝总动脉、门静脉胃十二指肠动脉及脾动脉,根部离断、夹闭胃右动静脉、清扫第5、8a、12a、12p组淋巴结,根部离断、夹闭胃左动静脉,清扫第7、8、9组淋巴结。显露脾动脉表面离断胃后系膜,根部离断、夹闭胃后血管,清扫第11p组淋巴结。继续向左侧离断胃网膜左系膜根部,离断、夹闭胃网膜左动静脉,清扫第4sb组淋巴结,沿脾动脉各分支至脾脏表面清扫脾门动脉血管前后淋巴脂肪组织(第10组淋巴结)。向上游离胃短系膜,根部离断胃短血管。沿膈肌角向上游离下段食管约5 cm。打开肝胃韧带,夹闭副肝左血管,向上游离至食管右侧缘,向下游离至十二指肠。中转开腹,进入腹腔。于贲门上约5 cm切断食管,移除病变胃组织。距离十二指肠悬韧带20 cm离断空肠系膜,离断空肠。远端空肠与食管残端于结肠前行端侧吻合。残端予以切闭并缝合加固。距食管空肠吻合口约40 cm远端空肠侧壁与近端空肠行侧侧吻合。缝合关闭小肠系膜裂孔。置入双腔鼻肠减压管及营养管。创面彻底止血。于右肝下间隙、左上腹脾窝区各放置引流管。清点手术用品无误后,逐层关腹。
第12a组淋巴结清扫方式:沿胃十二指肠动脉及肝总动脉充分显露胃右动脉及肝固有动脉,于肝总动脉、胃十二指肠动脉及胰腺上缘夹角处打开门静脉前方筋膜,显露门静脉,将肝总动脉向腹前壁挑起。沿门静脉前方分离,清扫门静脉与肝固有动脉间淋巴结。沿门静脉内缘向上分离至肝门部。将肝总动脉向右下牵拉,清扫肝固有动脉内侧及门静脉内侧淋巴脂肪组织。打开肝十二指肠韧带被膜,继续脉络化肝固有动脉前方及外侧,清扫第12a组淋巴结。标本离体30 min内分组拣取淋巴结(图1)。
1.2.2 临床资料
收集患者的临床资料,包括性别、年龄、体重指数(body mass index,BMI)、肿瘤部位、肿瘤大小、分化程度、Borrmann分型、pT分期、pN分期、TNM分期、神经脉管侵犯等。TNM分期参照AJCC第8版分期系统[15]。根据第5版日本胃癌分类标准[6]设定肿瘤的最大直径作为肿瘤长度,根据参考文献的标准[16],肿瘤直径设置以6 cm为界。
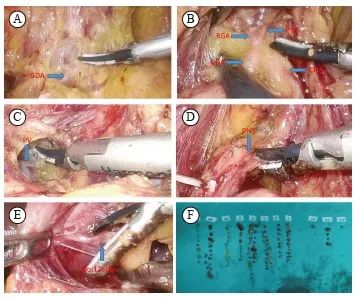
图1 第12a组淋巴结清扫步骤
Fig. 1 Lymph node disp steps in group No.12a
1.3 统计学处理
数据统计分析采用SPSS 21.0软件。计数资料比较采用χ2检验或Fisher确切概率检验;利用多因素logistic回归分析不同部位胃癌患者第12a组淋巴结转移的危险因素。采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 不同部位淋巴结转移情况
1 112例胃癌患者中72例发生第12a组淋巴结转移,整体转移率为6.5%。561例胃上部癌中有25例发生第12a组淋巴结转移,转移率为4.5%。224例胃体癌中有17例第12a组淋巴结为阳性,转移率为7.6%;327例胃窦癌中有30例第12a组淋巴结为阳性,转移率为9.2%。同时,本研究发现无论任何部位,第12a组淋巴结转移的患者都伴有第5组淋巴结转移(图2)。
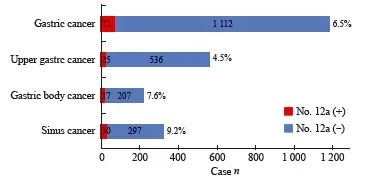
图 2 各部位第12a组淋巴结转移率
Fig. 2 Lymph node metastasis rate of the group 12a lymph node in each location
2.2 不同部位的临床病理学特征
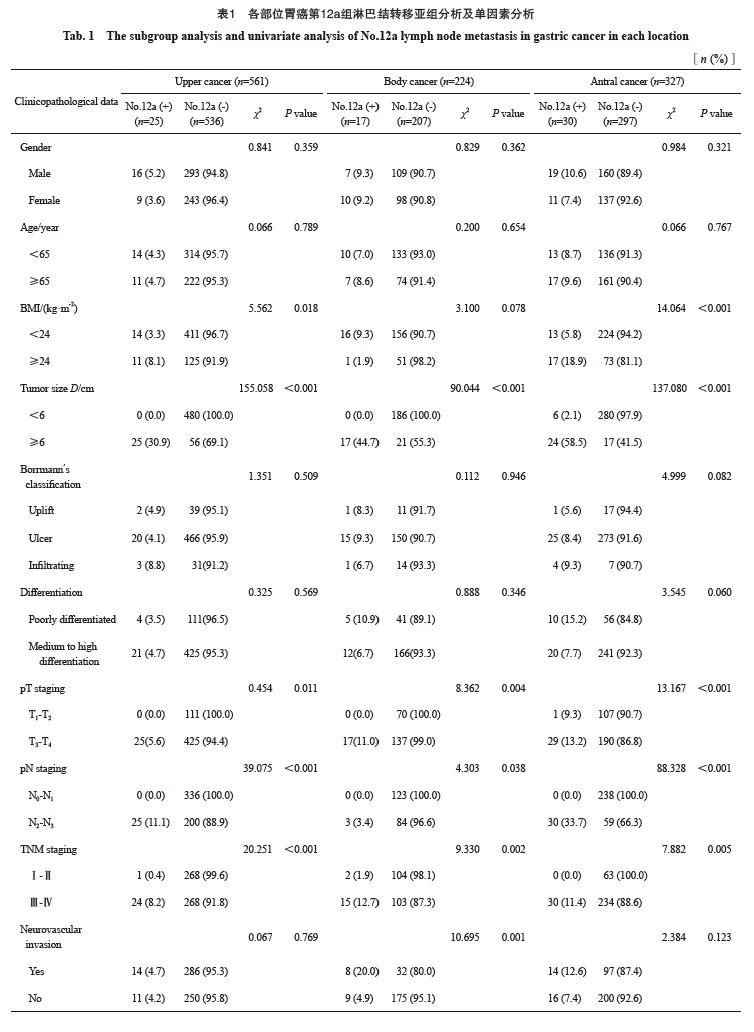
对于胃上部癌,BMI<24 kg/m2、肿瘤直 径≥6 cm、T3~T4期、N2~N3期、Ⅲ~Ⅳ期、有血管神经侵犯的胃上部癌患者第12a组淋巴结转移率分别高于BMI<24 kg/m2、肿瘤直径<6 cm、T1~T2期、N0~N1期、Ⅰ~Ⅱ期、无血管神经侵犯者(P<0.05),而不同性别、年龄、Borrmann分型、分化程度组内比较,差异无统计学意义(P>0.05)。
对于胃体癌,肿瘤直径≥6 cm、T3~T4期、 N2~N3期、Ⅲ~Ⅳ期、有血管神经侵犯的胃上部癌患者第12a组淋巴结转移率分别高于肿瘤直径<6 cm、T1~T2期、N0~N1期、Ⅰ~Ⅱ期、无血管神经侵犯者,差异有统计学意义(P<0.05)。不同性别、年龄、BMI、Borrmann分型、分化程度组内比较,差异无统计学意义(P>0.05)。
对于胃窦癌,肿瘤直径≥6 cm、T3~T4期、N2~N3期、Ⅲ~Ⅳ期患者第12a组淋巴结转移率分别高于肿瘤直径<6 cm、T1~T2期、N0~N1期、Ⅰ~Ⅱ期,差异有统计学意义(P<0.05)。不同性别、年龄、BMI、Borrmann分型、分化程度、神经血管侵犯组内比较,差异无统计学意义(P >0.05,表1)。
2.3 不同部位的多因素logistic分析
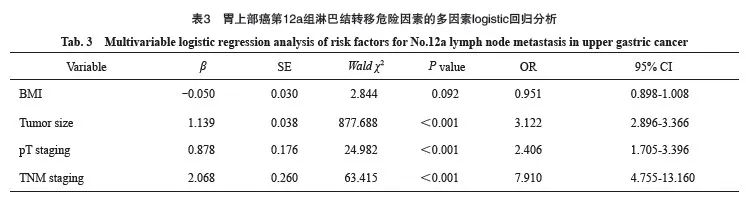
以第12a组淋巴结是否转移为因变量,以单因素分析差异有统计学意义的指标为自变量,纳入模型进行多因素logistic回归分析,为排除变量间共线性,剔除N分期后结果显示:肿瘤直径(OR=3.122,95% CI:2.896~3.366,P<0.001)、T分期(OR=2.406,95% CI:1.705~3.396,P<0.001)及TNM分期(OR=7.91,95% CI:4.755~13.160,P <0.001)是胃上部癌第12a组淋巴结转移的危险因素;肿瘤直径(OR=2.757,95% CI:2.495~3.047,P<0.001)、T分期(OR=3.298,95% CI:2.346~4.638,P<0.001)及脉管神经侵犯(OR=1.839,95% CI:1.368~2.473,P <0.001)是胃体癌第12a组淋巴结转移的危险因素;BMI(OR=1.098,95% CI:1.023~1.178,P=0.010)、肿瘤直径(OR=2.865,95% CI:1.778~4.616,P<0.001)、T分期(OR=13.497,95% CI:8.363~21.783,P<0.001)及TNM分期(OR=3.806,95% CI:3.113~4.653,P<0.001)是胃窦癌第12a组淋巴结转移的危险因素(表2~5)。

3 讨 论
根据日本第5版胃癌诊疗指南[5],无论是全胃切除术还是远端胃切除术,标准D2淋巴结切除术均包括第12a组淋巴结的清扫。然而,常规清扫第12a组淋巴结的益处仍有争议。2022版美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)胃癌治疗指南[17]指出,对远处淋巴结的广泛清扫仅有助于疾病的准确分期,然而,对生存期的延长尚无定论[18-20]。
本研究结果显示,第12a组淋巴结转移患者伴有其他组淋巴结广泛转移,提示第12a组淋巴结阳性患者往往肿瘤分期较晚。本研究中第12a组淋巴结转移的72例患者都伴随第5组淋巴结转移,这可能与淋巴回流方向有关[13,21]。通常根据淋巴结转移率决定是否行淋巴结清扫:转移率>10%则强烈推荐清扫,转移率介于5%~10%则弱推荐清扫,转移率<5%则不推荐清扫[22]。从本研究结果可以看出,胃体癌与胃窦癌第12a组淋巴结转移率分别为7.6%和9.2%。有研究[23]结果同样表明,胃癌第12a组淋巴结转移的总发生率为2.67%,而对于远端胃癌患者第12a组淋巴结转移的发生率增加到10.7%,第12a组淋巴结阳性的患者无复发生存率和总生存率较差。所以,虽然本研究胃体癌与胃窦癌第12a组淋巴结转移率为5% ~ 10%,为弱推荐清扫组,甚至一定条件下的胃体、胃窦癌第12a组淋巴结转率低于5%,但是由于第12a组淋巴结转移患者预后较差[24],所以笔者认为术中应常规对其进行清扫。然而,胃上部癌第12a组淋巴结转移率仅为4.4%。Zheng等[25]的一项研究结果表明,26例第12a组淋巴结切除的胃上部癌患者,没有1例阳性病例。Suh等[26]的研究表明了类似的结果,20例行第12a组淋巴结切除术的胃上部癌患者,0例出现了第12a组淋巴结阳性。Hosoda等[27]的研究中也是没有1例出现第12a组淋巴结转移。Sato等[28]的研究表明,51例第12a组淋巴结切除的患者中仅有1例为阳性。以上研究均表明胃上部癌患者第12a组淋巴结转移率较低,原因可能是位于胃上部的肿瘤距离第12a组淋巴结较远,因此,主要淋巴回流并不优先汇入幽门上部淋巴结再汇入第12a组淋巴结。根据本研究数据及相关研究[14,23- 24]数据,对于胃上部癌来说,第12a组淋巴结具有转移低和预后差的特点,所以我们认为,胃上部癌的第12a组淋巴结转移可考虑为远处转移,不需要行常规清扫。
本研究单因素分析发现胃癌患者的肿瘤直径、浸润深度、肿瘤分期及脉管神经侵犯是第12a组淋巴结转移的危险因素,与部分学者的观点基本一致[25-26]。进一步多因素分析发现,肿瘤直径、T分期、N分期及TNM分期可能是胃上部癌、胃体、胃窦癌第12a组淋巴结转移的独立危险因素;对于胃癌患者,肿瘤越大,提示病程较久,且肿瘤血供丰富,故可为胃周淋巴结转移提供足够的时间。通过对本研究数据亚组分析发现,直径<6 cm的胃上部癌没有出现第12a组淋巴结转移,这与研究报道结果相似[27],另外,肿瘤浸润深度浅(T1~T2期)的胃上部癌也没有出现第12a组淋巴结转移。这再次证明了我们的观点:胃上部癌不需要常规清扫第12a组淋巴结,但当合并某些危险因素时则需要清扫:直径 ≥6 cm、肿瘤浸润深度较深(T3~T4期)、肿瘤分期较晚(Ⅲ~Ⅳ期)。
本研究不足之处是,纳入的胃上部癌中,第12a组淋巴结阳性病例数较少;本研究为回顾性设计,纳入病例时可能存在选择偏倚;本研究的结论需要多中心的数据进一步验证。
本研究分析了各部位胃癌第12a组淋巴结的转移规律。目前的数据表明,第12a组淋巴结总体转移率较低。肿瘤大小、浸润深度及TNM分期是胃癌第12a组淋巴结转移的独立危险因素,同时神经血管侵犯是胃体癌的独立危险因素;胃体、胃窦癌需要常规清扫第12a组淋巴结;胃上部癌第12a组淋巴结转移率低,不需要常规清扫,但当合并某些危险因素,如直径≥6 cm、肿瘤浸润深度较深、分期较晚,则需要清扫第12a组淋巴结。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] 李国新. 胃癌外科2021年研究进展及学科展望[J]. 中华胃肠外科杂志, 2022, 25(1): 15-21.
LI G X. Research progress and prospect of gastric cancer surgery in 2021[J]. Chin J Gastrointest Surg, 2022, 25(1): 15-21.
[3] DONG Y P, CAI F L, WU Z Z, et al. Risk of station 12a lymph node metastasis in patients with lower-third gastric cancer[J]. World J Gastrointest Surg, 2021, 13(11): 1390-1404.
[4] SIERRA A, REGUEIRA F M, HERNÁNDEZ-LIZOÁIN J L, et al. Role of the extended lymphadenectomy in gastric cancer surgery: experience in a single institution[J]. Ann Surg Oncol, 2003, 10(3): 219-226.
[5] JAPANESE GASTRIC CANCER ASSOCIATION. Japanese gastric cancer treatment guidelines 2018 (5th edition)[J]. Gastric Cancer, 2021, 24(1): 1-21.
[6] JAPANESE GASTRIC CANCER ASSOCIATION. Japanese classification of gastric carcinoma-2nd English edition[J]. Gastric Cancer, 1998, 1(1): 10-24.
[7] EDGE S B, COMPTON C C. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471-1474.
[8] LU J, ZHENG C H, CAO L L, et al. The effectiveness of the 8th American Joint Committee on Cancer TNM classification in the prognosis evaluation of gastric cancer patients: a comparative study between the 7th and 8th editions[J]. Eur J Surg Oncol, 2017, 43(12): 2349-2356.
[9] HARTGRINK H H, VAN DE VELDE C J, PUTTER H, et al. Extended lymph node disp for gastric cancer: who may benefit? Final results of the randomized Dutch gastric cancer group trial[J]. J Clin Oncol, 2004, 22(11): 2069-2077.
[10] CUSCHIERI A, WEEDEN S, FIELDING J, et al. Patient survival after D1 and D2 reps for gastric cancer: longterm results of the MRC randomized surgical trial. Surgical Cooperative Group[J]. Br J Cancer, 1999, 79(9/10): 1522-1530.
[11] KONG S H, YOO M W, KIM J W, et al. Validation of limited lymphadenectomy for lower-third gastric cancer based on depth of tumour invasion[J]. Br J Surg, 2011, 98(1): 65-72.
[12] WEI Z W, XIA G K, WU Y, et al. Evaluation of skeletonization of the hepatoduodenal ligament for the lower third gastric cancer by propensity score analysis[J]. Hepatogastroenterology, 2013, 60(127): 1789-1796.
[13] CAI S R, CHEN J H, CHEN C Q, et al. Survival of proper hepatic artery lymph node metastasis in patients with gastric cancer: implications for D2 lymphadenectomy[J]. PLoS One, 2015, 10(3): e0118953.
[14] KUMAGAI K, HIKI N, NUNOBE S, et al. Metastasis to the lymph nodes along the proper hepatic artery from adenocarcinoma of the stomach[J]. Langenbecks Arch Surg, 2016, 401(5): 677-685.
[15] IN H, SOLSKY I, PALIS B, et al. Validation of the 8th edition of the AJCC TNM staging system for gastric cancer using the national cancer database[J]. Ann Surg Oncol, 2017, 24(12): 3683-3691.
[16] CHEN Z H, LIU Y, DOU L Z, et al. The efficacy of the application of the curative criteria of the 5th edition Japanese gastric cancer treatment guidelines for early adenocarcinoma of the esophagogastric junction treated by endoscopic submucosal disp[J]. Saudi J Gastroenterol, 2021, 27(2): 97-104.
[17] AJANI J A, D’AMICO T A, BENTREM D J, et al. Gastric cancer, version 2.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(2): 167-192.
[18] SMITH D D, SCHWARZ R R, SCHWARZ R E. Impact of total lymph node count on staging and survival after gastrectomy for gastric cancer: data from a large US-population database[J]. J Clin Oncol, 2005, 23(28): 7114-7124.
[19] S C H W A R Z R E , S M I T H D D . C l i n i c a l i m p a c t o f lymphadenectomy extent in resectable gastric cancer of advanced stage[J]. Ann Surg Oncol, 2007, 14(2): 317-328.
[20] SEEVARATNAM R, BOCICARIU A, CARDOSO R, et al. How many lymph nodes should be assessed in patients with gastric cancer? A systematic review[J]. Gastric Cancer, 2012, 15(Suppl 1): S70-S88.
[21] 张晋杰, 王 杰, 胡文庆. 进展期胃上部癌淋巴结清扫的现状与研究进展[J]. 中华胃肠外科杂志, 2018, 21(2): 236-240.
ZHANG J J, WANG J, HU W Q. Current status and research progress of lymph node disp in advanced upper gastric cancer[J]. Chin J Gastrointest Surg, 2018, 21(2): 236-240.
[22] 郑民华, 臧 潞, 马君俊, 等. SiewertⅡ型食管胃结合部腺癌腔镜手术治疗中国专家共识(2019版)[J]. 中国实用外科杂志, 2019, 39(11): 1129-1135.
ZHENG M H, ZANG L, MA J J, et al. Endoscopic surgery for SiewertⅡ esophagogastric junction adenocarcinoma in China (2019 edition)[J]. Chin J Pract Surg, 2019, 39(11): 1129-1135.
[23] SHU P, SUN X F, LIU F L, et al. Pattern of No. 12a lymph node metastasis in gastric cancer[J]. Chin J Cancer Res, 2021, 33(1): 61-68.
[24] SATO Y, KATAI H, ITO M, et al. Can proximal gastrectomy be justified for advanced adenocarcinoma of the esophagogastric junction? [J]. J Gastric Cancer, 2018, 18(4): 339-347.
[25] WU G, ZHANG D Y, DUAN Y H, et al. Correlations of hemoglobin level and perioperative blood transfusion with the prognosis of gastric cancer: a retrospective study[J]. Med Sci Monit, 2017, 23: 2470-2478.
[26] MITA K, ITO H, KATSUBE T, et al. Prognostic factors affecting survival after multivisceral rep in patients with clinical T4b gastric cancer[J]. J Gastrointest Surg, 2017, 21(12): 1993-1999.
[27] YAMASHITA H, KATAI H, MORITA S, et al. Optimal extent of lymph node disp for Siewert type Ⅱ esophagogastric junction carcinoma[J]. Ann Surg, 2011, 254(2): 274-280.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











癌症危险分析
25