Redox Biol 西北大学熊裕焱教授团队揭示内皮细胞中RNA结合蛋白GIGYF2在调控血管老化和功能中的作用及其机制
2023-08-01 论道心血管 论道心血管 发表于上海
该研究揭示了内皮细胞中GIGYF2的异常高表达调节血管老化和功能的作用及其潜在调控机制。
心血管疾病(CVDs)是全球死亡和发病的主要原因之一。随着生活方式的改变和人口老龄化,CVDs的患病率呈上升趋势,给社会带来沉重的经济负担。血管内皮细胞(ECs)是位于血管内表面的单层扁平鳞状上皮细胞,其不仅作为血液和血管壁/组织之间的保护性屏障,而且合成和释放多种血管活性物质,如血管扩张剂一氧化氮(NO)和收缩剂血管紧张素II(Ang II),以调节血管功能并维持血管稳态。衰老的ECs可引起内皮功能障碍,表现为一系列分子变化,如活性氧类(ROS)生成增加、NO产生减少、细胞间粘附分子-1(ICAM-1)和血管细胞粘附分子-1(VCAM-1)及促炎细胞因子分泌增多,这是CVDs发生和发展的常见病理触发因素。
Grb10互作GYF蛋白2(GIGYF2)最初在酵母双杂交筛选中被鉴定为一种与生长因子受体结合蛋白Grb10相互作用的蛋白。功能研究表明,GIGYF2是翻译抑制复合物的组成部分,并以4EHP依赖和独立的方式调控mRNA翻译。据报道,GIGYF2的突变与衰老相关帕金森病(PD)、神经退行性疾病和糖尿病相关认知障碍等疾病的发病机制密切相关,但其在调控血管内皮细胞衰老和功能障碍方面的作用及其调控机制仍不明确。
2023年7月24日,西北大学生命科学与医学院熊裕焱教授团队在Redox Biology上发表了题为“Aberrant hyper-expression of the RNA binding protein GIGYF2 in endothelial cells modulates vascular aging and function”的研究论文,揭示了内皮细胞中GIGYF2的异常高表达调节血管老化和功能的作用及其潜在调控机制。

首先,研究者检测了年轻和复制性衰老人脐静脉内皮细胞(HUVECs)中GIGYF2的表达,发现GIGYF2在衰老的人HUVECs中异常高表达。进一步,在衰老的HUVECs中沉默GIGYF2显著抑制了eNOS解偶联、细胞衰老和内皮功能障碍。相反,在非衰老HUVECs中,过表达GIGYF2促进了eNOS解偶联、细胞衰老、内皮功能障碍和mTORC1-S6K1信号通路的激活(图1)。以上结果提示,GIGYF2调控ECs的衰老、功能障碍和炎症,且可能通过mTORC1-S6K1信号轴调控这一过程。
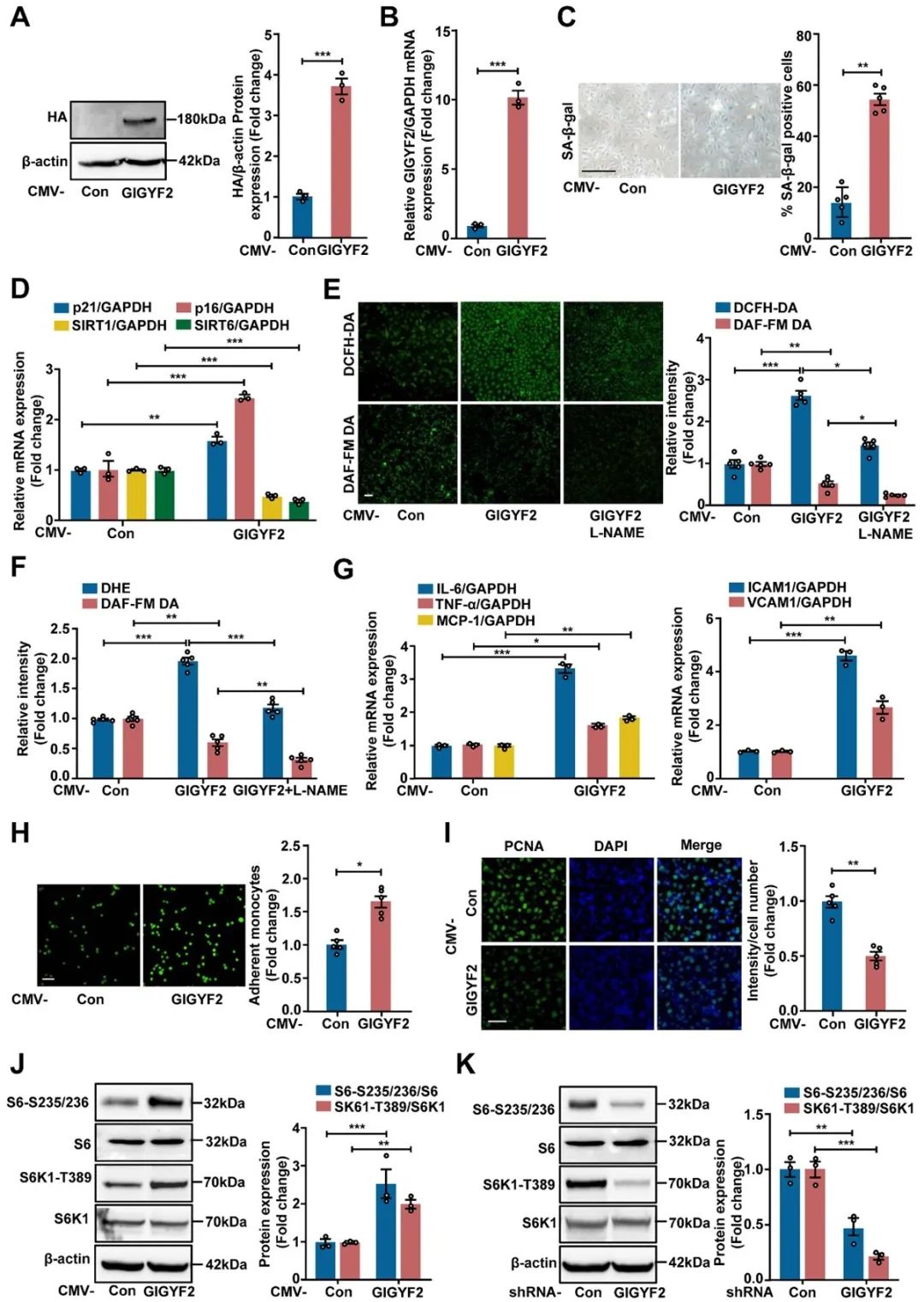
图1. 在年轻的ECs中过表达GIGYF2促进细胞衰老并激活mTORC1
随后,作者用雷帕霉素(Rapamycin, RAPA)和抗氧化剂N-乙酰-L-半胱氨酸(N-Acetyl-L-cysteine, NAC)分别处理过表达GIGYF2的年轻HUVECs细胞,发现RAPA和NAC均可抑制GIGYF2过表达诱导的内皮细胞衰老、功能障碍和炎症(图2)。以上结果提示,GIGYF2通过mTORC1-S6K1信号调控ECs衰老、功能障碍和炎症,重新偶联eNOS可抑制GIGYF2诱导的ECs衰老和内皮功能障碍。
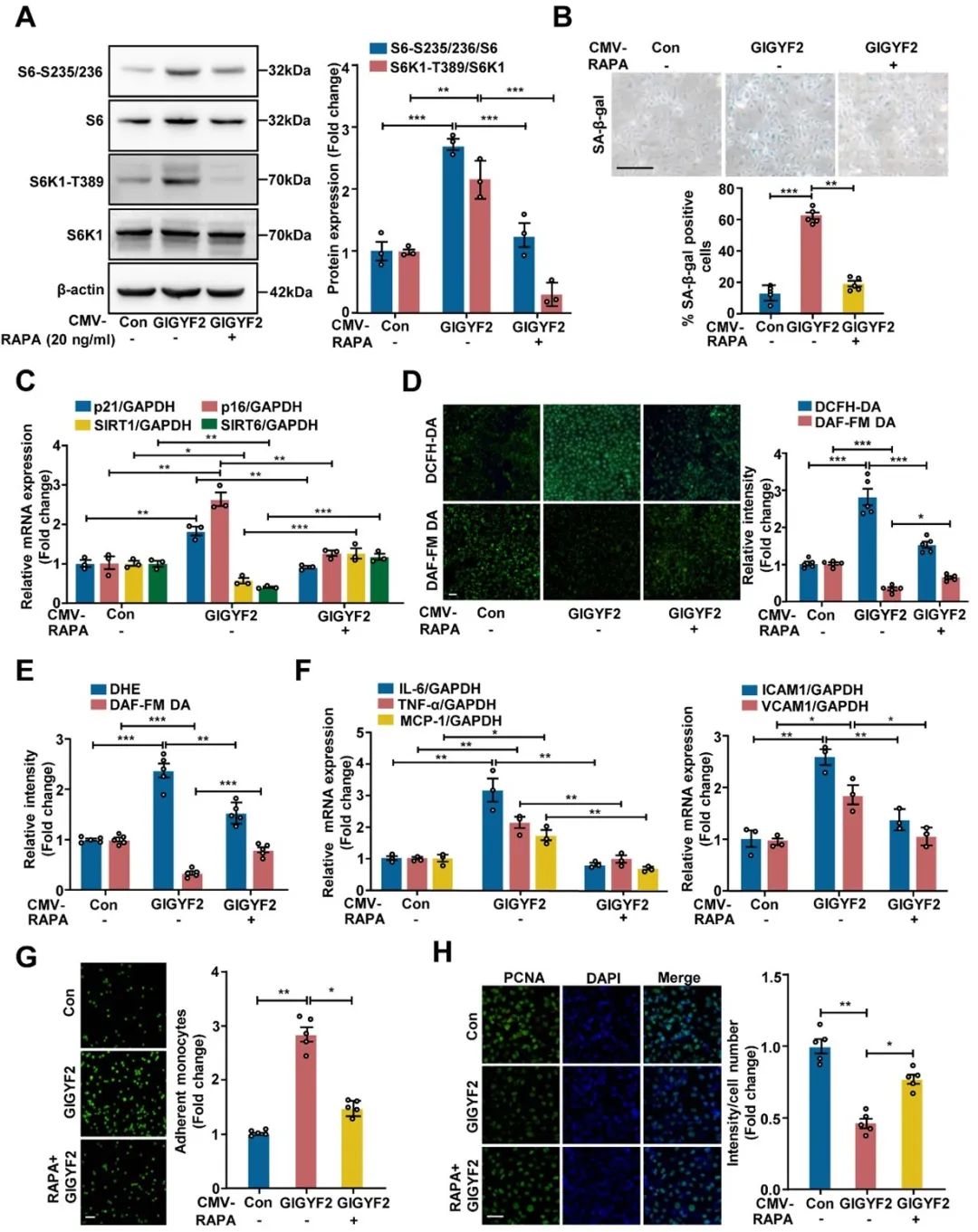
图2. 雷帕霉素处理可改善年轻ECs中GIGYF2过表达引起的细胞衰老和功能障碍
进一步,在野生型和GIGYF2-/-沉默HUVECs中进行了转录组测序,转录组分析结果表明在GIGYF2缺失的ECs中,staufen双链RNA结合蛋白1(STAU1)明显下调。而剥夺STAU1能明显缓解GIGYF2诱导的ECs衰老、功能障碍和炎症(图3)。因此,GIGYF2通过上调STAU1诱导mTORC1-S6K1信号转导,从而调节ECs衰老、功能障碍和炎症。
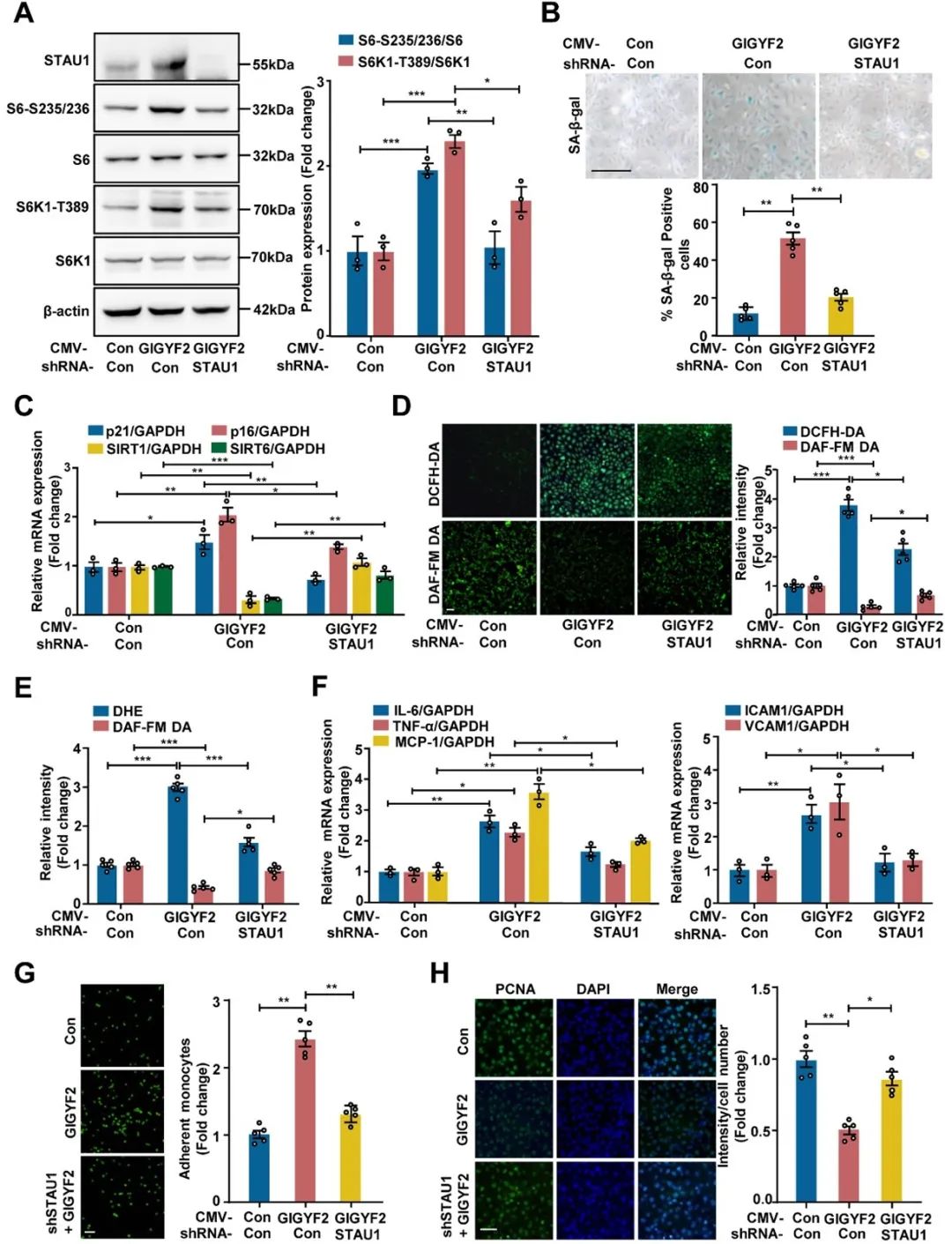
图3. 沉默STAU1抑制GIGYF2诱导的mTORC1-S6K1通路激活,同时改善细胞衰老和内皮功能障碍
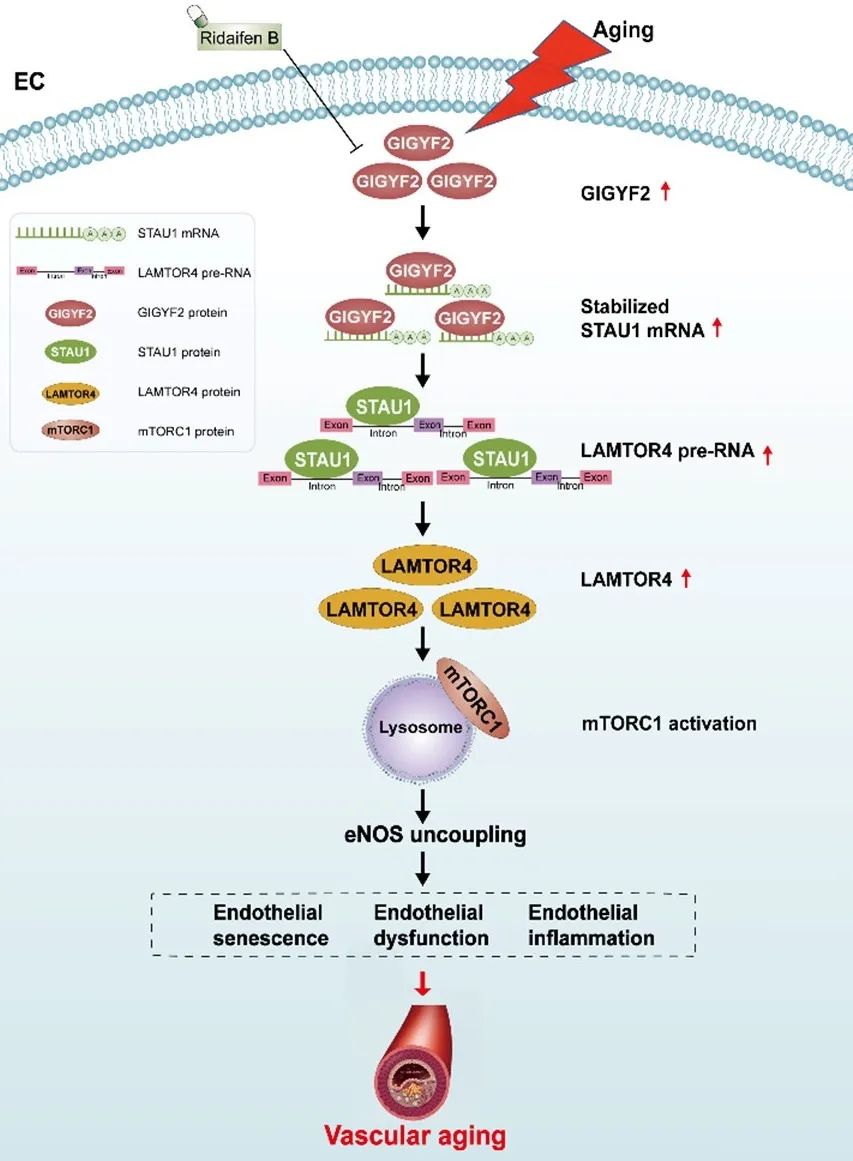
此外,研究者发现GIGYF2作为一种RNA结合蛋白(RBP)可增强STAU1 mRNA的稳定性,而且晚期内体/溶酶体适配体MAPK和mTOR激活因子4(LAMTOR4)的内含子区可与STAU1蛋白结合,从而上调LAMTOR4的表达。沉默LAMTOR4可抑制GIGYF2过表达引起的mTORC1-S6K1通路激活。与免疫荧光染色结果一致,过表达GIGYF2显著促进mTORC1转位至溶酶体(LAMP1),而沉默LAMTOR4则能阻断这种转位(图4)。以上结果提示,GIGYF2-STAU1信号轴通过上调LAMTOR4的表达促进mTORC1转位至溶酶体,从而驱动mTORC1-S6K通路的激活。
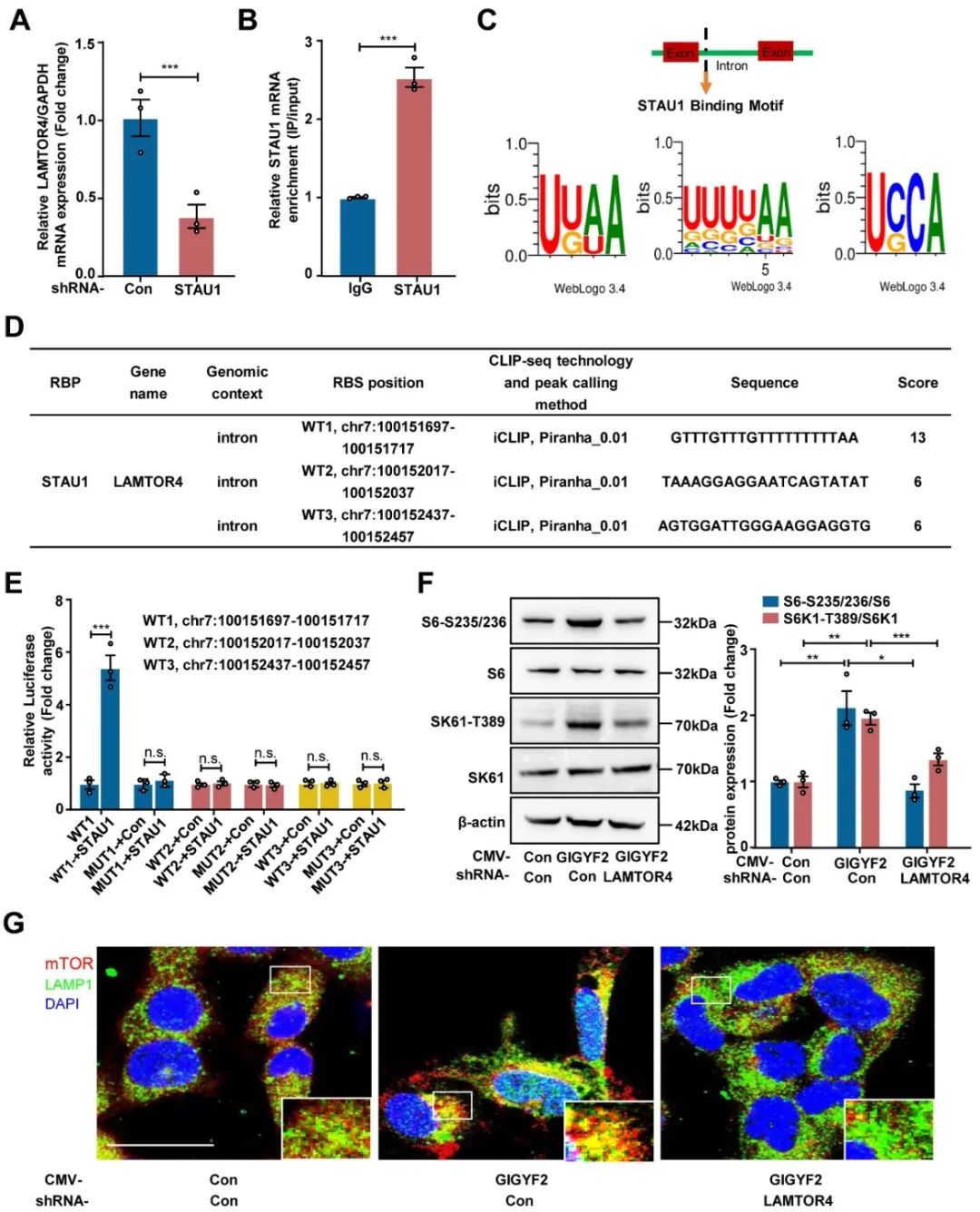
图4. LAMTOR4介导STAU1-mTORC1信号级联
最后,研究者构建了内皮特异性GIGYF2敲除小鼠(GIGYF2flox/flox Cdh-Cre+)模型,在该小鼠中,内皮特异性GIGYF2敲除可保护老年小鼠免受衰老相关的血管内皮依赖性舒张和动脉僵硬的影响(图5)。
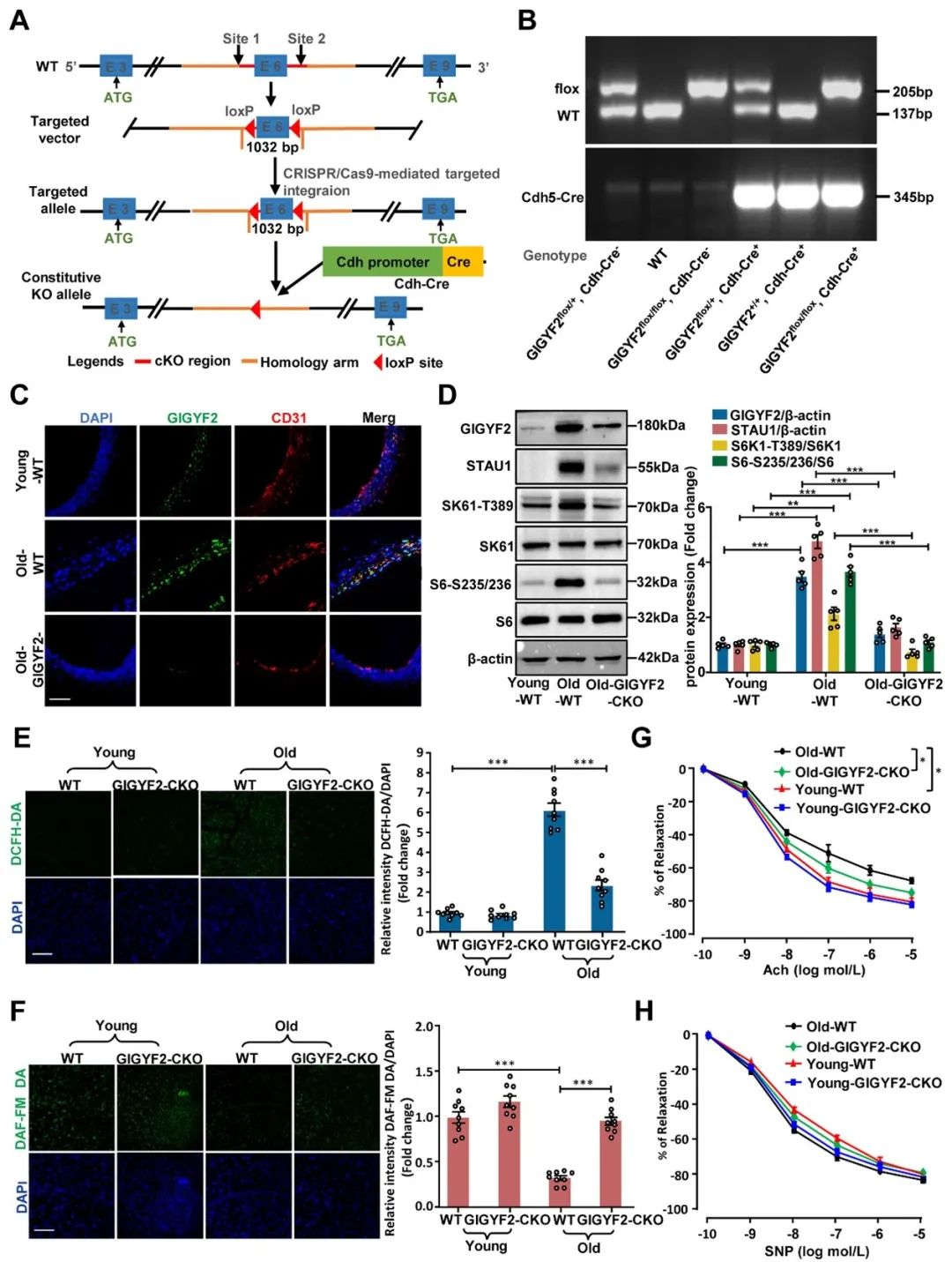
图5. 内皮特异性GIGYF2基因敲除小鼠可改善与年龄相关的血管功能障碍
综上所述,该研究揭示了作为RBP的GIGYF2可增强STAU1的mRNA稳定性,而STAU1可通过与其内含子区域结合上调LAMTOR4的表达,从而通过将mTORC1招募到溶酶体膜激活mTORC1-S6K1信号传导,最终导致ECs衰老、功能障碍和血管老化。破坏GIGYF2-STAU1-mTORC1信号级联可能是应对血管衰老和衰老相关心血管疾病的一种有前景的治疗方法。
西北大学生命科学学院博士生牛芳林和硕士生李卓卓为论文的共同第一作者,西北大学生命科学与医学院熊裕焱教授和于怡副教授为论文的共同通讯作者。本研究受到国家自然科学基金、陕西省自然科学基金,陕西省重点研究开发项目等多个项目的支持。
原文链接:
https://authors.elsevier.com/sd/article/S2213-2317(23)00225-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言