Trends in Neurosci综述:神奇的多巴胺
2023-02-11 brainnew神内神外 brainnew神内神外 发表于安徽省
DA在体内如何作用于目标神经元的经典概念也正在重新审视,因为人们越来越认识到DA在环路层面的作用是空间、时间和环境相关的,因此无法从体外单细胞研究中轻易推断。
神经调节剂多巴胺(DA)对调节学习、动机和运动至关重要。尽管它很重要,但DA对靶细胞活性的影响以及改变行为的机制仍不清楚。
近日,美国纽约大学格罗斯曼医学院神经科学研究Tanya Sippy和Nicolas X. Tritsch在Trends in Neurosciences上发表综述,介绍了最近的方法学进展,这些进展有助于克服历史上阻碍该领域的挑战。综述中讨论了这些方法的应用如何揭示了脑中细胞外DA的复杂动力学,以及DA信号如何改变体内目标神经元的放电、生化和群体活动。这些发现产生了关于DA释放改变行为的机制的新假设。 从细胞到行为的DA“桥梁”
从细胞到行为的DA“桥梁”
在过去的几十年中,人们一直致力于揭示DA是如何促进哺乳动物行为的,方法是在体内表征黑质致密部(SNc)和腹侧被盖区(VTA)中DA释放神经元的活性,并在体外解剖DA对靶细胞的影响。这些研究为建立DA功能的当前模型提供了基础。例如,DA神经元表现出多种放电模式,这些放电模式被广泛地分为两类:强直性(tonic)和阶段性(phasic)。
Tonic指的是自发的(可能是细胞固有的),每秒发射2至8个动作电位,为目标神经元提供基础水平的DA,并被认为在运动中发挥了基本作用。Phasic指的是DA神经元的短暂(持续时间为几百毫秒)放电增加或减少(即放电突发和暂停),这与奖励预测错误(RPE)的编码和促进强化学习密切相关。
DA一旦释放后,可作用于G蛋白偶联受体(GPCR)的五种亚型中的任何一种,D1至D5,其可定位于各种细胞室(例如,体细胞、树突或轴突)和靶细胞(例如,兴奋性和抑制性神经元以及胶质细胞)。在这篇综述中,作者首先讨论了研究体内DA释放动力学的新方法。然后,考虑了与研究DA信号对靶细胞的功能影响相关的一些挑战。
从DA的释放动力学认识DA
理解DA功能的一个关键要素是定义在行为期间何时何地释放DA。微透析和伏安法都提供了DA浓度的定量测量,但这些方法具有显著的局限性:微透析缺乏解析快速DA信号的能力,伏安法在行为动物中相对难以实现。
现阶段采用了两种成像技术来解决这一需求。第一种方法依赖于明亮和敏感的基因编码钙指示剂(GECI)的表达,如GCaMP6及其最近的变体,以根据DA轴突的特定群体的活性推断DA释放。第二种方法通过表达dLight和GRAB-DA家族DA的基因编码荧光生物传感器,实现对细胞外DA水平的直接监测。这两种方法都适用于行为动物的单光子或双光子显微镜。
DA释放的阶段性增加或减少可能不是DA编码奖赏信号的唯一模式。最近一项利用GCaMP6光度法的研究发现,在口渴的小鼠饮水后约10分钟,VTA轴突的活性缓慢增加,这表明DA水平的长期变化也可能有助于行为强化。总之,这些发现模糊了tonic信号和phasic信号之间的简单区分,以及它们在运动和学习中各自的作用,并表明DA信号比以前认为的要复杂得多。
解析DA对靶细胞作用的挑战
目前,DA调节目标脑区神经元活性以影响行为的具体生理机制和时间过程仍然不清楚[Fig.1A]。解析DA对下游环路影响的一个重要挑战是,DA的释放可能通过经典突触以外的机制发生:DA轴突形成的轴突曲张体(varicosity),其中许多不能通过活性依赖性囊泡胞吐释放DA,并在重复刺激下经历明显的抑制。
DA一旦被释放,就被认为通过容积传递(volume transmission)起作用,这种神经递质在大脑相对较大的区域中缓慢且非特异性地发送信号。此外,DA神经元还通过自身胞体和树突的囊泡胞吐释放DA,并作用于自身D2受体,负性调节体细胞放电。
另一个主要挑战是,与谷氨酸和GABA等作用于配体门控离子通道的神经递质不同,DA仅通过GPCR起作用。因此,DA受体不会直接激发使目标神经元去极化或超极化的膜电流。相反,DA对任何给定细胞的作用随受体、第二信使和效应蛋白的表达类型以及该细胞的电和生化状态的变化而变化,使得DA的作用显著多样化,并且高度依赖于细胞和环境。DA还通过激发钙信号和星形胶质细胞释放递质来改变突触传递,并促进或阻碍新的树突棘的形成及其结构可塑性。
最后,从技术和概念上也难以理解DA调节的时间过程;体内DA水平在短时间尺度和长时间尺度上不断波动,GPCR施加其自身的时间约束,在数百毫秒到几分钟甚至几小时的多个时间尺度上影响细胞生理学[Fig.1B]。因此,DA对目标神经元的影响是复杂和时间变化性的。
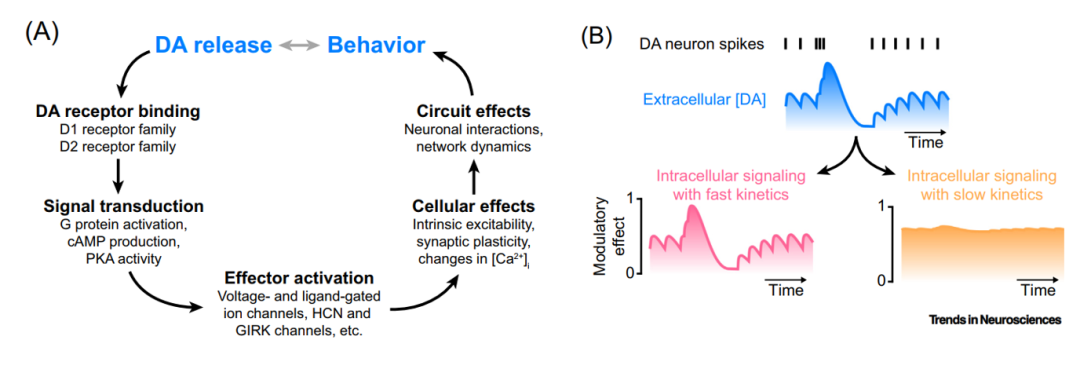 Figure 1 揭示多巴胺(DA)的分子、细胞和环路效应的动力学
Figure 1 揭示多巴胺(DA)的分子、细胞和环路效应的动力学
纹状体DA调节的经典观点
纹状体是皮层下的大脑区域,其中神经元群主要由表达D1或D2受体的GABA能棘投射神经元(SPNs)组成。特别是在背侧纹状体中,D1-SPNs和D2-SPNs的互斥表达在小鼠中得到了很好的证实。
在这个框架内,啮齿类动物背侧纹状体中DA提高了表达D1受体的纹状体-黑质SPNs的活性,并降低表达D2受体的纹状体-苍白球SPNs的活动[Fig.2]。例如,DA已被证明通过突触前和突触后机制的组合,促进了来自频繁刺激D1-SPNs的新皮质投射的谷氨酸能突触的长期增强(LTP),以及D2-SPNs兴奋性输入的长期抑制(LTD)。DA也被认为通过突触后谷氨酸受体的短期可塑性,以及通过突触前调节SPN侧支的GABA释放,使纹状体输出偏向D1-SPNs。
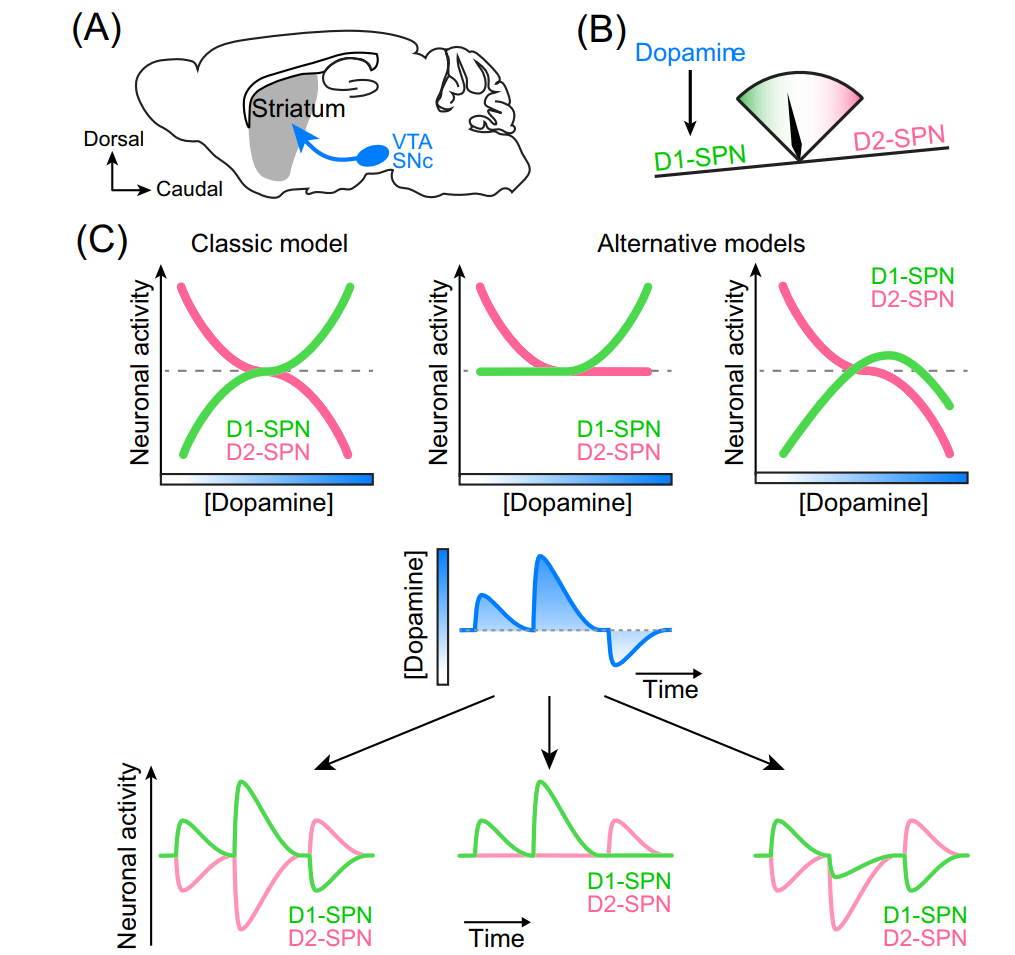
Figure 2 多巴胺(DA)调节纹状体输出
DA被认为可以改变纹状体输出的另一种重要方式是动态改变SPNs的胞体-树突兴奋性。刺激DA受体不会引起SPNs静息膜电位的任何明显变化,因为这些细胞不表达G蛋白介导的内向整流钾(GIRK)或超极化激活的环核苷酸门控(HCN)通道。然而,DA影响几个电压门控钠、钾和钙通道的门控特性和电导,这些通道控制SPN响应于恒定的兴奋性输入激发的动作电位。
尽管有这些机制上的见解,但关于DA的特定调节作用、其幅度和时间进程,特别是在体内和行为动物中,仍然存在重要问题。事实上,在体纹状体环境与离体纹状体环境明显不同。
首先,大脑切片中SPNs的静息膜电势比体内约低20 mV,部分原因是在清醒大脑中,SPNs暴露于持续不断的兴奋性突触输入。第二,当DA传入细胞被切断时,纹状体切片中的细胞外DA水平极低,这与体内情况不同,在体内情况下,SPNs持续暴露于波动的DA水平。最后,纹状体输出由许多细胞和突触元件的动态相互作用形成,包括纹状体中间神经元和传入活动模式。因此,DA轴突对纹状体输出的调节作用只能通过在行为过程中考虑神经元动态来充分评估。
DA信号对靶神经元的新见解
一个新兴且有前景的研究途径需要对特定细胞类型中DA受体的下游分子靶点进行成像。近年来,在开发用于细胞内cAMP水平和PKA活性的基因编码光学传感器方面取得了重大进展。这些传感器中的大多数由蛋白质序列组成,这些蛋白质序列在与cAMP物理结合或被PKA磷酸化时发生构象变化,并依靠Förster共振能量转移(FRET)或循环置换荧光蛋白产生光子,这些光子可以通过常规荧光或寿命显微镜和光度法成像。它们的灵敏度和动力学取决于所使用的分子传感器的特性。
通过这些方法得出的一系列观察结果,突显了体内DA信号的理解是多么不完整,以及呼吁对DA以相等但相反的方式双向控制D1和D2 SPNs放电的经典观点进行重大修改。
SPNs表达的其他GPCR汇聚在相同的细胞内信号级联上,并与DA竞争PKA激活,最著名的是D1 SPNs中的Gαi偶联的毒蕈碱M4受体和D2 SPNs中Gαs偶联的腺苷A2A受体。因此,越来越明显的是,如果不考虑Ach和腺苷等调节剂,就无法理解DA对SPNs的作用,因为它们在大脑中的水平与DA一样,会动态变化。
值得注意的是,SPNs中钙瞬变的频率明显低于SPNs的动作电位放电率,这表明钙成像可能不适合估计SPNs放电。SPNs中的细胞内钙信号反而反映了动作电位的爆发,因此可能最好地突出了促进突触可塑性的胞体-树突钙事件。
总结与展望
在这篇综述中,作者讨论了最近关于靶神经元中DA释放和DA信号的更细致和动态化的方法学进展。这些进展还模糊了阶段性(phasic)DA和强直性(tonic)DA之间的清晰区分,并表明DA对基于奖励的学习和运动的不同影响不能简单地归因于DA神经元放电或DA释放的模式。
DA在体内如何作用于目标神经元的经典概念也正在重新审视,因为人们越来越认识到DA在环路层面的作用是空间、时间和环境相关的,因此无法从体外单细胞研究中轻易推断。
总而言之,要理解DA释放的丰富模式如何改变大脑回路,从而在不同时间尺度和不同环境下影响行为,还有很多工作要做。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言