【衡道丨文献】高分化HPV非依赖性宫颈上皮内瘤变的组织学和分子谱
2024-02-03 衡道病理 衡道病理 发表于上海
近年来,世界卫生组织承认宫颈存在侵袭性非HPV依赖性鳞状细胞癌,但由于该疾病的前驱病变罕见并缺乏描述,因此第五版WHO女性生殖道肿瘤分类中并未将HPV非依赖性宫颈鳞状上皮内病变包括在内。
近期,来自奥地利格拉茨医科大学的Sigrid Regauer等人报道了3例HPV阴性、p16ink4a阴性、高分化的宫颈鳞状细胞癌前体病变的组织学谱,并发现这些病变邻近和/或先前存在侵袭性非HPV依赖性宫颈鳞状细胞癌,其组织学特征与外阴HPV阴性的SCC前驱病变相似。本文作者详细描述这组罕见的高分化HPV阴性宫颈鳞状细胞癌前病变的组织学、细胞学、免疫组织化学和分子特征。

西京医院李超老师对这篇文献要点进行了编译,供大家参考。
材料和方法
使用AmpliSeq文库试剂盒2.0 (Thermo Fisher Scientific) 从3名患者的福尔马林固定和石蜡包埋的组织中制备二代测序 (NGS) 文库。
HPV检测:
检测 32 种 HPV 亚型(包括 HPV 高危亚型 16、18、31、33、35、39、45、51、52、56、58、59;HPV低危亚型6,11;可能致癌的 HPV亚型26、53、66、 67、68 、70、73、82;未分类的亚型:42、44、54、61、62、72、81、84、90、91以及未知病原体和HPV基因组序列)。
突变分析:
记录每个样本的突变情况,NGS涵盖50个基因(ABL1、AKT1、ALK、APC、ATM、BRAF、CDH1、CDKN2A、CSF1R、CTNNB1、EGFR、ERBB2、ERBB4、 EZH2、FBXW7、FGFR1、FGFR2、FGFR3、FLT3、GNA11、GNAQ、GNAS、HNF1A、HRAS、IDH1、IDH2、JAK2、JAK3、KDR、KIT、KRAS、MET、MLH1、MPL、NOTCH1、NPM1、NRAS、PDGFRA、 PIK3CA、PTEN、PTPN11、RB1、RET、SMAD4、SMARCB1/INI、SMO、SRC、STK11、TP53 和 VHL)。
结果:
患者 1(TP53突变HPV非依赖型的d-CIN)
63岁,女性。在确诊鳞状细胞癌前约2年进行了第一次活检,HE显示:组织破碎,鳞状上皮不含糖原,基底层细胞局灶角化,上皮下半部分有轻度异型性,解释为反应性。因活检组织太小,无法进一步分析。
一年后,进行了第二次较大活检(图 1A-C),HE上,宫颈组织显示出棘皮病样形态,具有轻度但广泛拉长的上皮脚,核分裂象增加,出现类似于d-VIN病变,因此称为d-CIN。与先前的活检相比,上皮脚延长,细胞密度增加,基底细胞和基底上细胞异型性更强,核分裂象增加。对该活检的回顾性分析显示存在TP53基因突变、p53核过度表达和p16ink4a阴性(详见表1)。9个月后的第三次活检显示出类似但更明显的特征:过早鳞化出现在浸润前病变和早期浸润性SCC(pT1a)中,上皮内可见角化珠形成(图 1E、F),这与在细胞学标本中观察到的橙色鳞状细胞或角化珠一致(图 1F)。患者在65岁时被诊断为高分化角化型p16ink4a阴性和p53过度表达的SCC。子宫切除标本显示p53过表达的d-CIN 和正常非角化鳞状上皮之间的突然转化(图 1G、H)。该患者前驱病变和侵袭性鳞状细胞癌具有相同的热点突变(表1)。
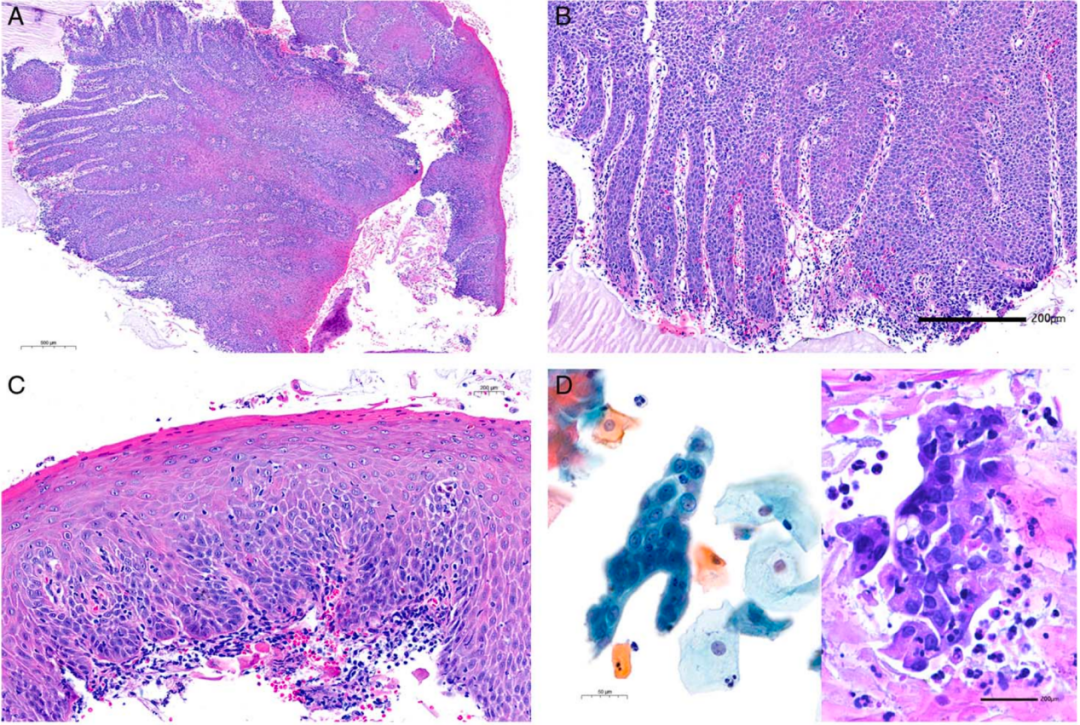
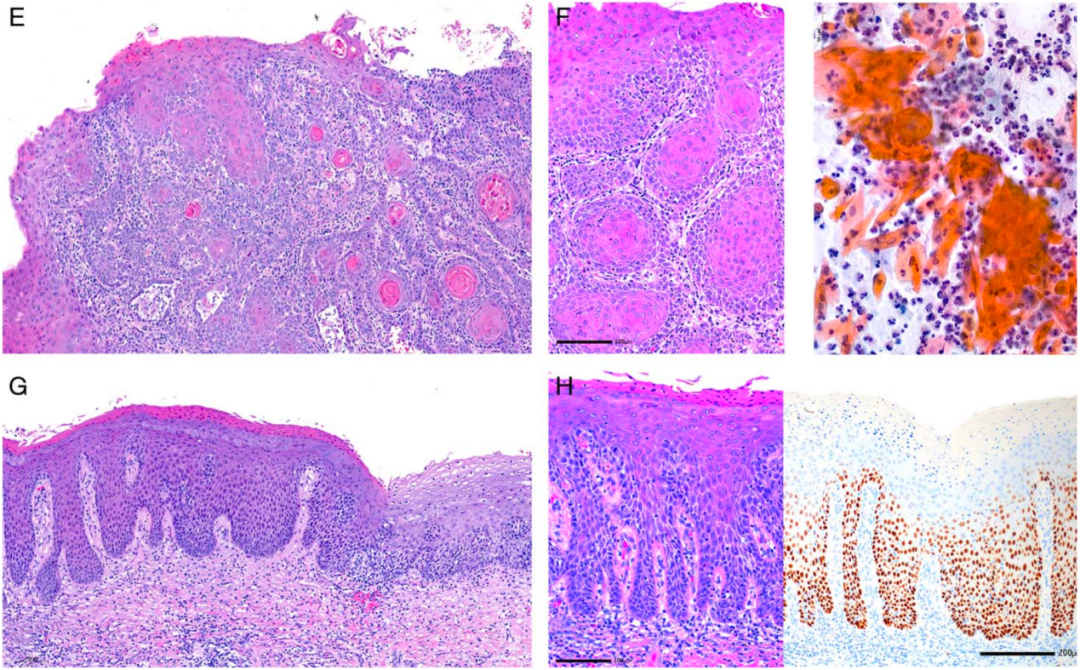
图1. 分化型TP53突变的HPV非依赖型宫颈上皮内瘤变。
A,确诊侵袭性SCC一年前的活检显示出广泛的棘皮病样非典型增生。
B,上皮脚拉长并相互吻合,可见核分裂及真皮层轻度水肿。
C,其他区域表现出不太明显的基底层细胞增生,伴有个别核分裂,表皮出现过度鳞化,以及出现轻度角化不全的异常角化。
D,相应的细胞学涂片显示三维分支管状结构和非典型基底细胞簇。
E,侵袭性鳞状细胞癌显示出明显的过早鳞化和角化珠层。
F,组织学切片中可观察到上皮内水肿和过早角化。
G,HPV非依赖型d-CIN 和非肿瘤性宫颈上皮之间界限清晰。
H,高分化的鳞状细胞增生、上皮脚延长,过早鳞状化,免疫组化显示p53核过度表达。
患者 2(p53野生型HPV非依赖型疣状增生的宫颈上皮内瘤变)
65岁患者,在诊断为伴有广泛的角化过度、疣状增生的宫颈鳞状细胞癌(图 2A、B)约2年前曾行宫颈活检。最初的细胞学涂片显示,在干净的背景中存在大量嗜酸性角化物或单个角化细胞。由于角化过度恶化和阴道狭窄,她接受了阴道扩张和宫颈锥切术,同时进行了宫颈内膜刮除术。宫颈刮除和锥切标本均显示出大量增生和角化过度的鳞状上皮,部分呈疣状增生(图2C-F)。上皮下存在致密的淋巴细胞(图2D)。鳞状上皮呈棘皮病样或外生性/疣状增生的特点:上皮广泛角化过度、角化不全、颗粒层缺失、上皮角延长、嵴增宽,基底细胞核异型性极小,被解释为反应性(图2F)。组织学让人想起一种独特的非侵袭性外阴病变,称为外阴棘皮病,具有分化改变。回顾性分析显示EGFR (G724S) 和 SMARCB1/INI (R377H) 的致病性体细胞突变以及“野生型”p53染色和INI表达(详见表 1)。由于误诊为良性,所以尽管这种分化的上皮内病变延伸至宫颈外切缘,但患者未接受进一步治疗。一年后,她因p16ink4a 阴性、HPV 阴性、高分化、疣状侵袭性鳞状细胞癌(累及子宫颈和阴道穹窿)接受了子宫切除术。SCC在PIK3CA中存在致病性体细胞突变(表 1)。前驱病变和宫颈/阴道非肿瘤性上皮之间的过渡是突然的(图2G)。在距离浸润性SCC比较远的的阴道切缘附近也发现了前体病变的小病灶(图 2H)。
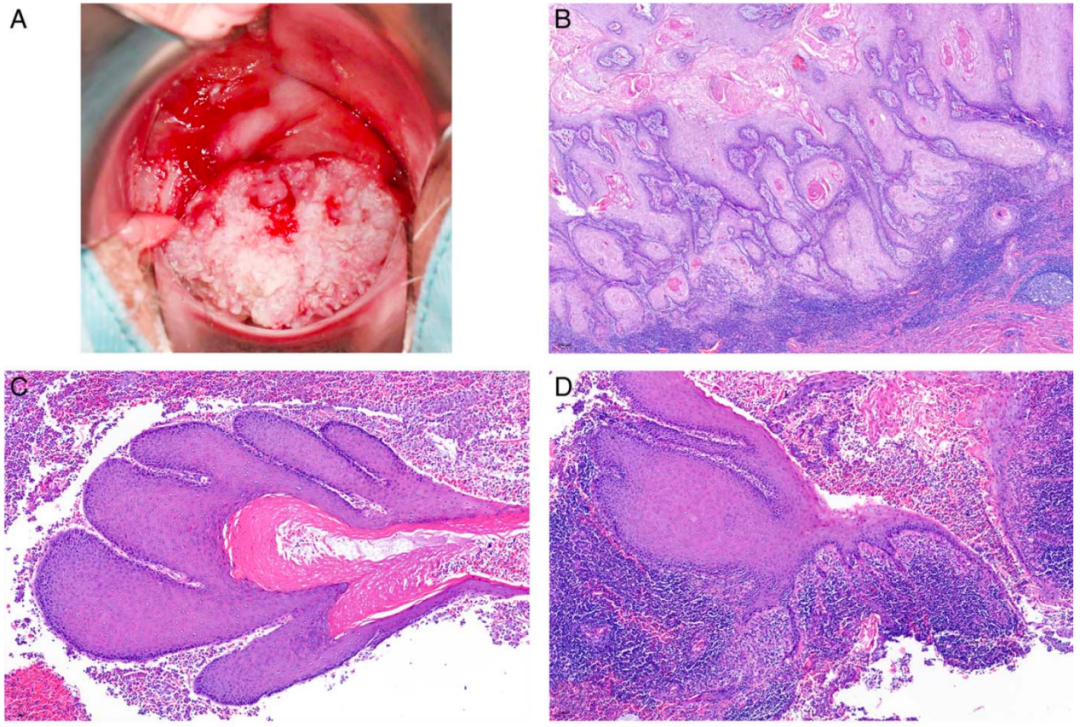
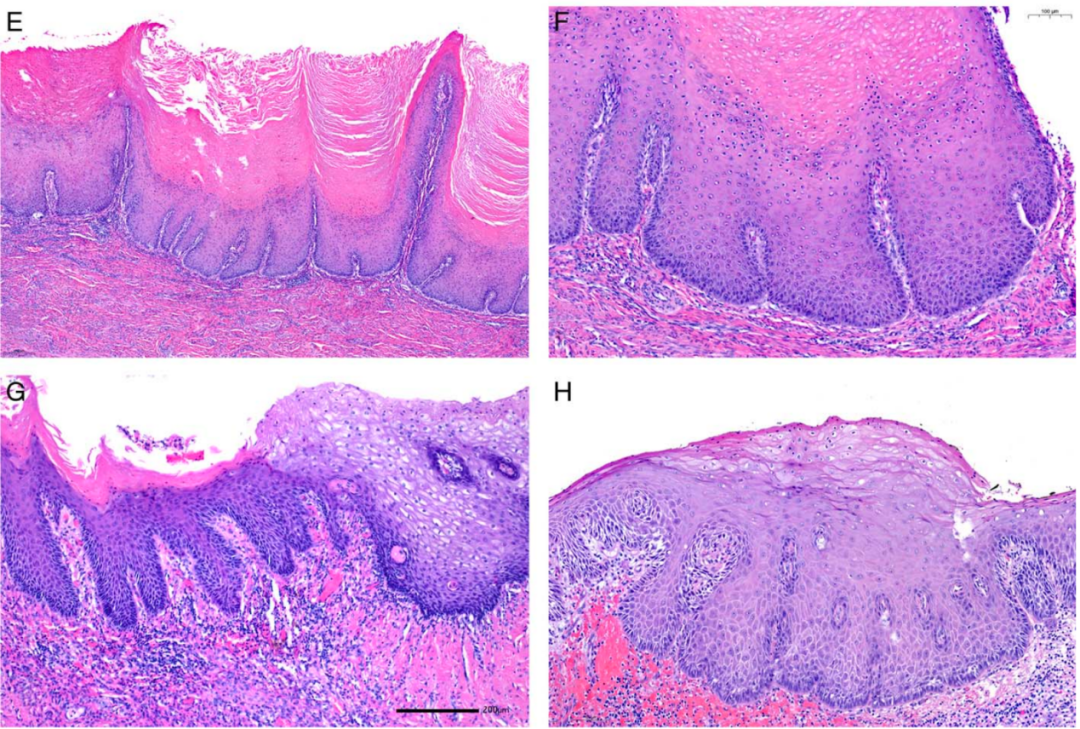
图2.HPV非依赖型p53野生型疣状增生的宫颈上皮内瘤变。
A,阴道镜下看到病变呈疣状增生,覆盖宫颈外口并延伸至阴道穹窿,后被证实为SCC。
B,侵袭性疣状增生的SCC显示出致密的炎细胞浸润并伴有淋巴滤泡形成。
C,宫颈刮除标本可见鳞状上皮棘层增厚,部分区域角化过度,上皮脚拉长、吻合,基底层细胞异型性极小;颗粒层局部缺失,但局灶性角化不全和大量角化过度占主导地位。
D,棘层细胞非典型增生,表皮下浸润的炎细胞以淋巴细胞占主导地位,遮盖基底膜。
E,在子宫切除标本中发现瘤周存在癌前病变,表现为外生性疣状角化不全和角化过度。
F,颗粒层的缺失,基底层细胞显示出轻度异型性。
G,癌前病变和具硬化和性苔藓样的非肿瘤性病变之间的过渡是突然的。
H,子宫切除标本显示部分阴道上皮的基底层细胞非典型增殖,伴有异型性,颗粒层开始出现角化不全。
患者 3(p53 野生型HPV非依赖型疣状增生的宫颈上皮内瘤变)
一名 74 岁患者,患有HPV阴性鳞状细胞癌,组织学显示无角化、局灶性乳头状生长、p16ink4a 阴性,累及子宫颈、阴道穹窿和阴道(图 3A-C)。子宫切除标本显示宫颈内膜和宫颈隐窝被SCC广泛累及,并伴有大量淋巴细胞浸润(图 3B、C)。三个月前的宫颈刮除标本(图3D)显示大量非浸润性疣状、乳头状生长的上皮碎片以及早期侵袭性鳞状细胞癌的较大组织碎片。在诊断SCC的六个月前,阴道疣状增生在临床上被解释为尖锐湿疣。阴道刮除标本(图3E、F)显示大量非角化、p16ink4a 阴性疣状增生的组织碎片,组织学诊断为尖锐湿疣(图3E、F)。然而,在回顾性分析中,它们缺乏HPV基因组序列,但存在PIK3CA和MET的致病性体细胞突变。侵袭性SCC在不仅存在FGFR3突变并发现ABL (G417A)、PTEN (H123Y) 和TP53 (Q16K) 的体细胞亚克隆突变,TP53突变频率极低,介于2%~5%之间。
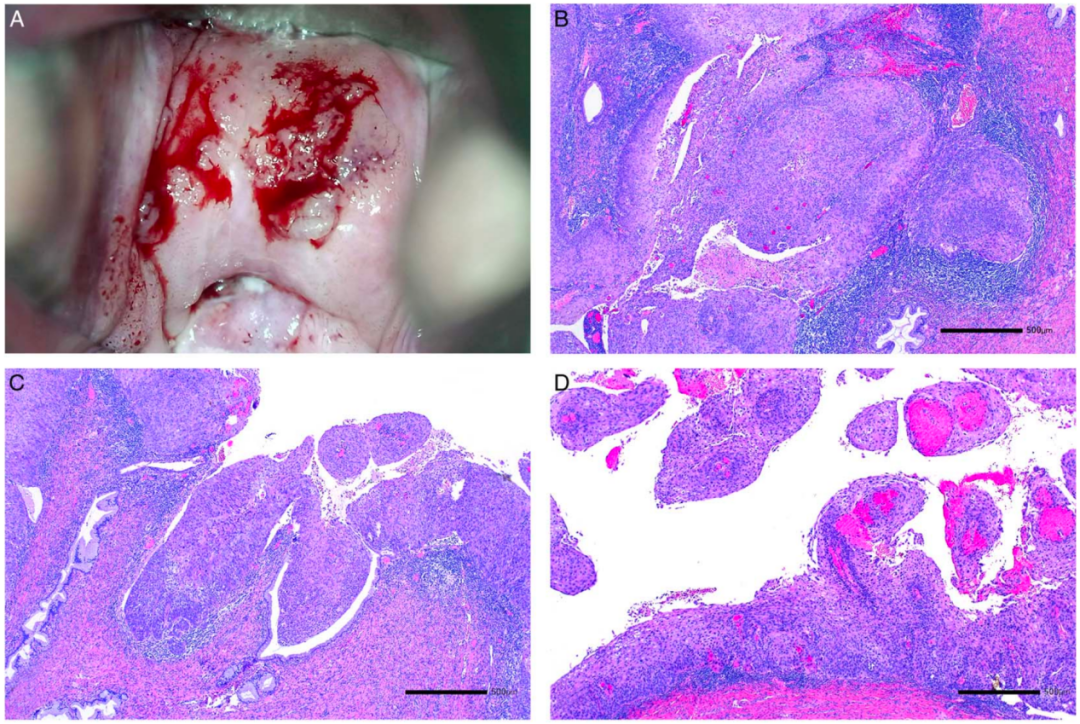
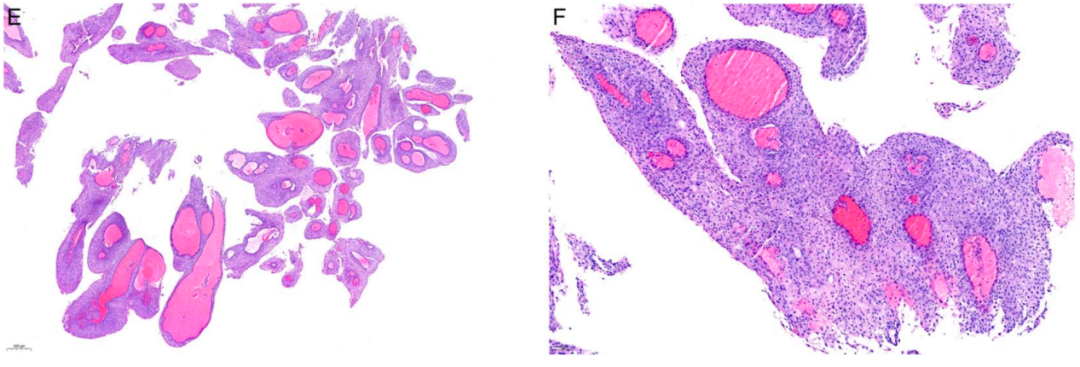
图3.HPV非依赖型p53 野生型疣状增生的宫颈上皮内瘤变。
A,SCC占据宫颈和阴道穹窿,局部出血及溃疡形成。阴道穹窿处的息肉样病变显示出规则分布的充血血管。该病变被误认为是尖锐湿疣。
B,峡部附近疣状生长的侵袭性鳞状细胞癌累及隐窝,淋巴细胞密集浸润。
C,具有疣状、乳头状结构的侵袭性鳞状细胞癌也显示出更多开始角化的实性区域。
D,阴道刮除物主要由孤立的乳头组成,但一个组织碎片显示出向侵袭性角化型SCC的转变。
E,“尖锐湿疣”病变的阴道刮除标本显示出丰富的血管呈乳头状、疣状增生,并伴有轻度异型性和一些细胞变化,提示与HPV相关的挖空细胞变化。
F,乳头状增生的上皮仅由5至10 个细胞组成,覆盖着薄薄的纤维血管轴心,血管扩张。尽管一些细胞变化表明与HPV感染相关,但测序显示缺乏HPV基因组序列。

讨论
本文是对p16ink4a 阴性及HPV阴性宫颈癌前病变的首次详细描述。所有结果均通过全基因组测序证实不存在HPV基因组序列以及缺乏32种HPV亚型的DNA和 14种HPV不同亚型的E6/E7-mRNA。本研究与早期报告中HPV检测阴性的宫颈SCC不同,以前的研究中HPV检测方法不足,或仅检测少数高危型HPV基因。
大多数研究报告了HPV非依赖型SCC的存在,但缺乏对HPV非依赖型SCC前驱病变的描述。而作者不仅鉴定出了罕见的 HPV非依赖型SCC的前驱病变,并发现大部分此类病变为基底细胞样组织学亚型。分化的角化型HPV非依赖型SCC前驱病变在组织学诊断中具有挑战性,因为它们很容易被误认为是良性鳞状细胞增生。高分化的HPV非依赖型宫颈SCC前驱病变与HPV非依赖型外阴和阴茎癌前病变具有惊人的相似性。包括具有TP53体细胞突变的d-VIN或d-PeIN、与外阴疣状癌相关的具有分化改变的外阴棘皮病、以及偶尔伴有PIK3CA突变的分化型外生性外阴上皮内病变。2例HPV非依赖型宫颈上皮内瘤变和SCC中存在SMARCB1基因的杂合致病性错义突变。而先前并未在HPV相关的SCC前驱病变、HPV相关侵袭性SCC以及HPV相关基底样SCC及HPV相关的基底样前驱病变中发现SMARCB1/NI突变。SMARCB1/INI是一种有效的抑癌基因,与肿瘤增殖相关的多种通路的关键蛋白相互作用,如p16-RB通路、WNT信号通路和sonic hedgehog信号通路。
宫颈HPV非依赖型疣状增生的上皮内瘤变进一步细分,正如发生于外阴的病变一样,对于临床和病理医生来说都是令人困惑的。因此,作者建议将分化型HPV非依赖型宫颈癌前病变仅分为2个实体,即分化型TP53突变的宫颈SCC前驱病变和p53野生型疣状增生的宫颈SCC前驱病变,但存在除TP53之外的其他体细胞突变。HPV非依赖型SCC前驱病变的第三种变体是基底细胞样亚型,这种类型在外阴相当罕见。
在上述HPV非依赖型疣状增生的宫颈上皮内瘤变患者中,尽管1名患者有阴道狭窄和一些提示扁平苔藓的组织学特征,该患者没有同时伴有肛门生殖器硬化性苔藓和扁平苔藓。HPV非依赖型SCC的发生,特别是疣状增生途径,其发生与宫颈和肛门生殖器部位的炎症性疾病无关。
总之,作者观察到2种不同的高分化、HPV阴性和p16ink4a 阴性的宫颈上皮内病变,其特征性突变谱与之前描述的外阴癌前病变一样。为了获得最佳的重复性,我们提出了基于TP53突变状态的HPV感染状态对宫颈癌前病变进行简单分类。未来对这些罕见病变的经验将告诉我们,区分TP53突变的HPV非依赖型的d-CIN和p53野生型的HPV非依赖型疣状增生的前驱病变是否有意义。
参考文献:
1.Regauer S, Reich O. The Histologic and Molecular Spectrum of Highly Differentiated HPV-independent Cervical Intraepithelial Neoplasia. Am J Surg Pathol. 2023;47(8):942-949.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#HPV# #宫颈上皮内瘤变#
27