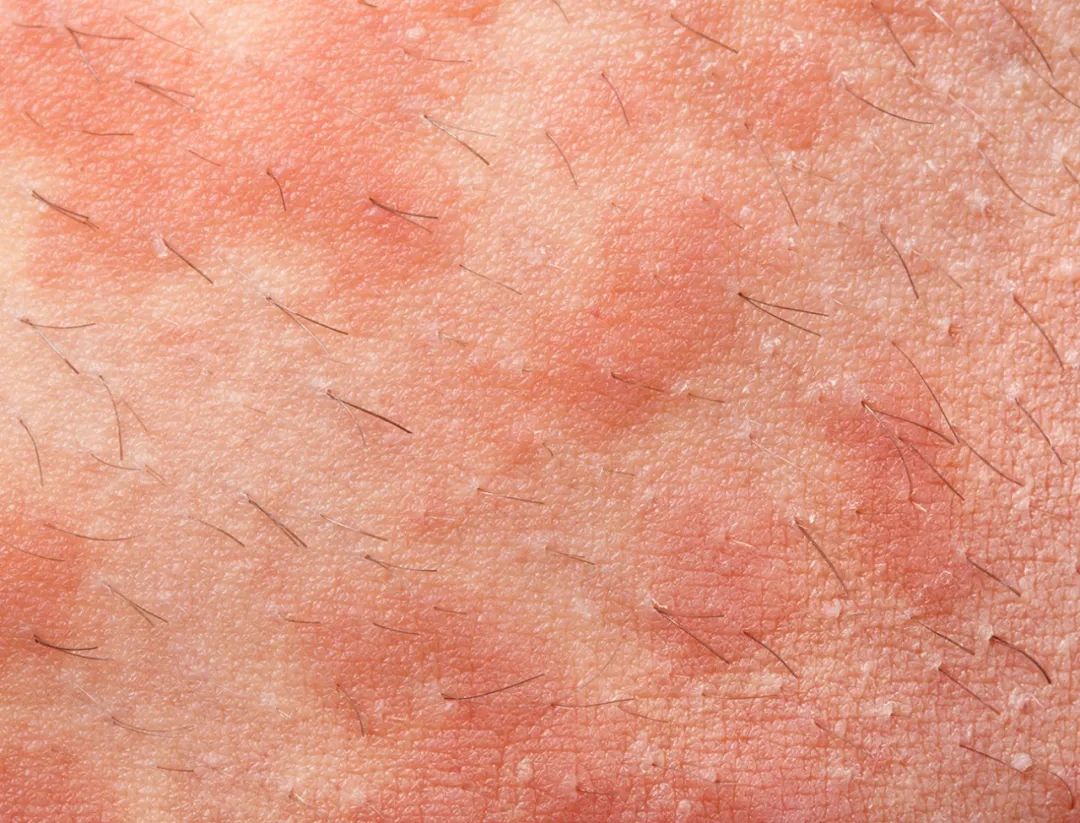
放射性皮炎又称辐射性皮炎,是由各种类型电离辐射(如α、β、γ、X射线等)照射皮肤黏膜引起的急性或慢性损伤,也是肿瘤局部放射治疗时最常见的并发症。国内对放射性皮炎的预防及诊断缺乏统一认识,现有治疗手段的合理性、有效性需更多循证医学证据来证实。

流行病学
1、放射性皮炎发病率:
据世界卫生组织统计,约50%肿瘤患者在治疗的不同阶段需要接受局部放射性治疗。在接受放疗患者中,约95%患者会发生各种不同程度的放射性皮炎,尤其在头颈部肿瘤、乳腺癌、肺癌等患者中最常见。其中,大部分患者为轻度或中度放射性皮炎;但有20%~25%患者会发生皮肤糜烂,严重者出现皮肤溃疡。据报道,约49%头颈部放疗患者,在放疗期间会出现Ⅲ级或Ⅳ级放射性皮炎。
2、放射性皮炎的危险因素:
狒放射性皮炎的严重程度通常与患者自身因素、同期使用的化学治疗药物、放疗剂量及分割方案等密切相关。
个体因素:自身不同部位的组织对放疗敏感性不相同,如颈前、四肢、前胸、腹部、面部最敏感,其次是头皮和乳房。通常,在皮肤皱褶处、皮脂分泌旺盛区域更易出现放射性损伤,如头颈部、乳房、腋窝、会阴部、腹股沟等部位。同时,还与性别、年龄、生活方式及并发症等密切相关,如女性、高龄、肥胖、营养不良、长期日晒、吸烟史等均可增加罹患放射性皮炎风险。少部分患者因其具有与DNA修复能力缺陷相关的遗传病,而具有遗传易感性,如患有共济失调-毛细血管扩张症、Bloom综合征、Fanconi贫血、Gorlin综合征、着色性干皮病等疾病,其发展为严重放射性皮炎风险大幅增加。
另外,行乳房重建术植入假体的乳腺癌患者,因假体会减少皮肤散热,也会增加罹患重度放射性皮炎风险。对于以上较高风险患者,应通过降低放疗剂量、减少照射体积和表面积,尽量避免重度放射性皮炎发生。目前,暂无证据证明,患结缔组织病会增加发生放射性皮炎的风险。
化学治疗药物:某些化学治疗药物会增加组织细胞的损伤并阻碍组织修复,因此,肿瘤患者化学治疗药物的给药时间、用药剂量很重要。放疗同时,辅以化学治疗药物会使重度放射性皮炎(Ⅲ级、Ⅳ级)发生风险增加1倍,如传统化疗药物(蒽环类或紫杉烷类等)、表皮生长因子受体抑制剂,如西妥昔单抗都会增加患重度放射性皮炎的风险。
放疗方案:放疗总剂量、分次治疗剂量、分割方案、照射体积和表面积均会影响皮肤损伤程度。接受辅助放疗早期乳腺癌患者中,与常规分割方案(50Gy/25f)相比,大分割放疗引起急性毒性反应风险较低。在一项多中心队列研究中,大分割放疗患者中,糜烂、脱屑、≥Ⅱ级放射性皮炎发生率均显著低于常规分割方案。
临床表现
1、放射性皮炎的分期:
放射性皮炎可分为急性期和慢性期,在病情严重程度、病程以及预后方面有较大差异。
急性放射性皮炎:通常在放疗或辐射暴露后90d发生,皮肤改变可在数小时内出现,并在数小时至数天内消退。皮肤表现包括红斑、水肿、脱屑、糜烂、溃疡、色素沉着、毛发脱落等,其发生过程呈剂量依赖性(表1)。

患者自觉皮肤紧绷感及皮肤敏感性增加,一般情况下,急性皮肤反应会在停止放疗后1个月内痊愈。
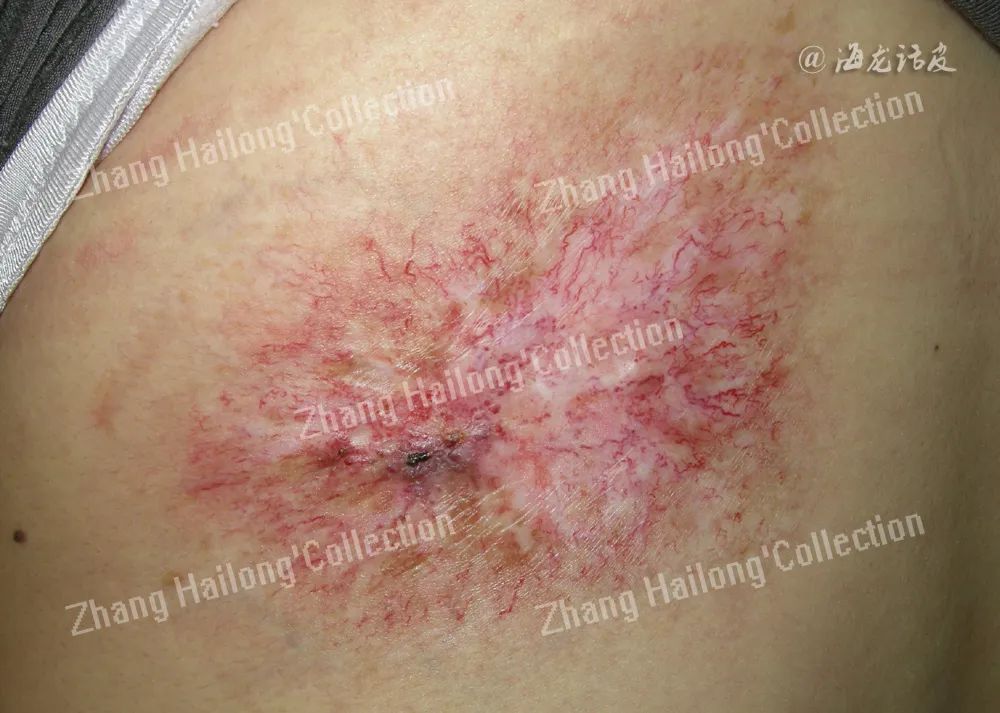
慢性放射性皮炎:通常在放射治疗完成后数月至数年出现,常见表现为色素减退或色素沉着、毛细血管扩张、 表皮萎缩、纤维化(表1)。患者皮肤纤维化还会导致组织挛缩、运动功能受限、疼痛等不适。在皮肤损伤严重区域,甲及其他皮肤附属器可永久性缺失,局部无毛囊及皮脂腺,进而出现脱发、少汗、无汗等症状。在较高辐射剂量下,小动脉和微动脉易形成血栓导致组织缺血,进而引起皮肤溃疡和坏死,增加感染风险。成纤维细胞活性异常、胶原沉积、增厚可引起辐射诱导硬皮病;由于电离辐射可引起线粒体、DNA突变以及染色体异常,少数患者还会出现癌前病变或早期肿瘤。
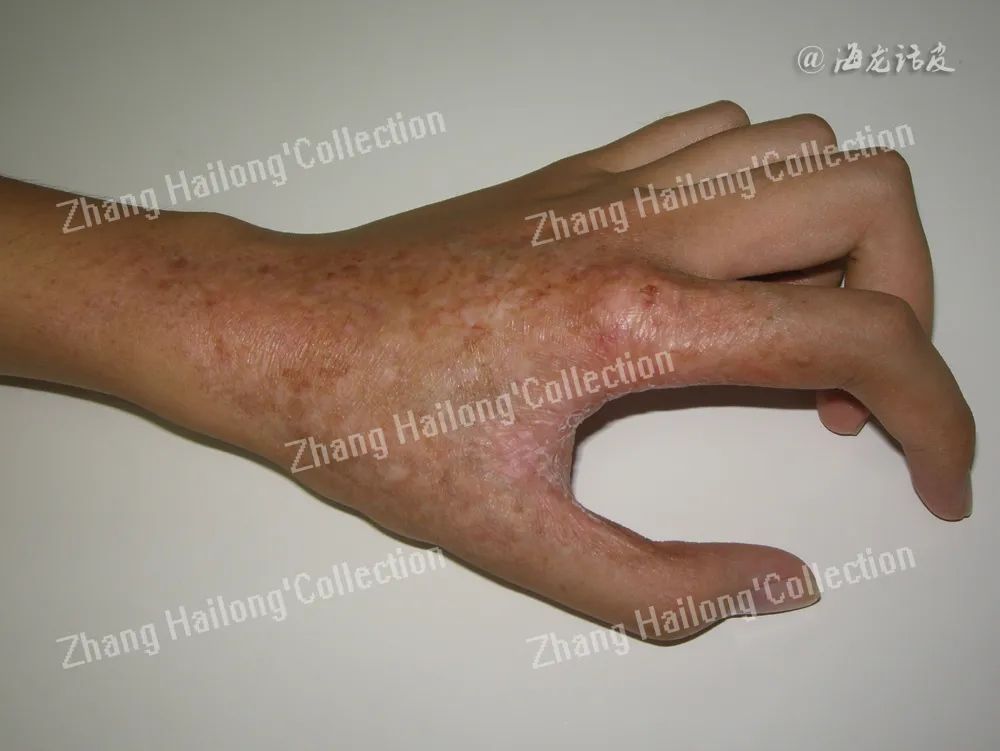
特殊表现:放疗回忆反应是用某种药物后,出现以往放疗照射区域内的皮肤炎症反应;可表现为皮肤红斑、水肿、水疱、斑丘疹、脱屑、甚至坏死,同时可伴或不伴有疼痛或瘙痒。严重者如伴有继发感染,形成瘘等,可能威胁生命。

放疗相关嗜酸性多形性瘙痒性皮疹:可在放疗期间或放疗后发生,临床上不仅局限于放疗区域,还常表现为局限性或泛发性、多形性、瘙痒性的红色丘疹、风团、表皮剥脱,偶可见水疱、大疱、脓疱、结节等非典型皮损。
放疗后硬斑病:大多在放疗后1年内发生,皮损主要局限于放疗区域,约25%患者皮损范围超出放疗区域,甚至发生泛发性硬斑病。表现为水肿性红斑、丘疹,常伴有疼痛,偶见水疱、大疱,之后可逐渐演变成紫红色硬化性斑块并伴有色素沉着。
2、放射性皮炎分级:
在放射性皮炎众多分级标准中,推荐用美国肿瘤放疗学会(radiation therapyoncology group,RTOG)和美国国立癌症研究所不良事件通用术语标准(common terminology criteriafor advers eevents,CTCAE)诊断,两者具有相似的分级标准,其优点是客观清晰、简洁明了,便于临床应用。见表2。

诊断与鉴别诊断
1、诊断:
急性放射性皮炎诊断标准:依据患者近期有放疗史、出现皮肤改变如红斑、脱屑、糜烂、坏死等,较易诊断急性放射性皮炎。皮损的界限清楚且局限于辐射区域也是重要的诊断线索。
慢性放射性皮炎诊断标准:患者有长期与辐射相关工作史,或局部皮肤受到超剂量限值的照射。亦可由急性放射性皮肤损伤迁延而来。分次照射数年后皮肤及其附属器出现慢性病变,急性放射性皮肤损伤程度较重者在受照射6个月后可迁延为慢性改变。
2、组织病理学表现:
急性放射性皮炎组织病理学:表现为角质形成细胞凋亡、细胞空泡变性及表皮水肿。随着辐射剂量增加,出现表皮坏死、水疱形成、表皮脱落;真皮内可见大量炎细胞浸润,同时伴有血管扩张、红细胞外溢和血栓形成。
慢性放射性皮炎组织病理学:表现为毛细血管扩张、纤维化、毛囊丢失、皮脂腺和汗腺萎缩;炎症后色素改变常见。此外,真皮中出现非典型成纤维细胞,伴有相关纤维化,导致脂肪组织丢失,微血管变化、正常真皮成纤维细胞和干细胞减少使患者易发生溃疡和愈合不良。
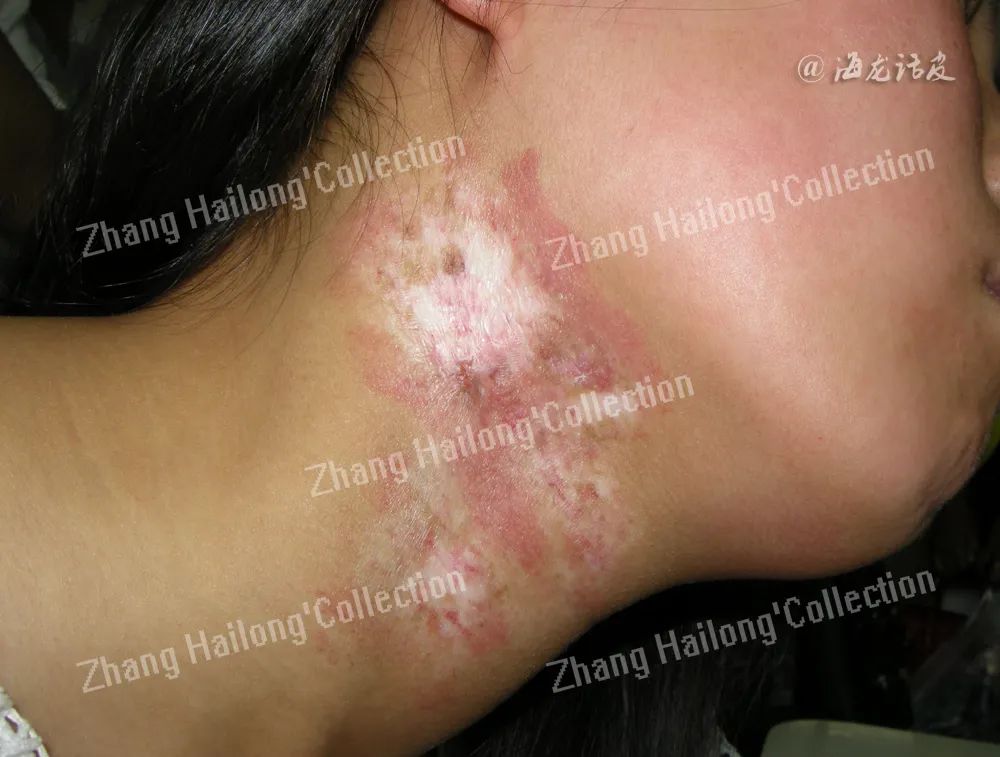
3、鉴别诊断:
症状不典型,诊断不明确时,需与接触性皮炎、间擦疹、皮肤癣菌疹、移植物抗宿主反应以及Stevens- Johnson综合征/中毒性表皮坏死松解症等鉴别。
放射性皮炎的预防与治疗
1、预防:
一般措施:(1)健康教育:加强放射线工作人员或接受放疗患者个人安全防护措施,人员应严格掌握放疗适应证及总剂量。治疗过程中,教育、指导患者及家属参与护 理活动,以缓解治疗的不适感、减少刺激并促进早期愈合 。(2)日常护理:①保持放疗区域皮肤清洁和干燥;②用温水和温和手工皂清洗局部;③每天使用无香型、不含羊毛脂的保湿剂护肤2~3次/d,但在放疗前暂停使用;④避免使用温度过高的水、碱性物质、香水、含乙醇的消毒剂等刺激皮肤;⑤避免在放疗区域用机械剃须刀,建议用电动剃须刀以防止皮肤破损,并避免用须后水及相关制剂;⑥穿宽松吸汗衣物,减少对皮肤的摩擦,皮肤清洁时,选用柔软全棉毛巾,避免用力揉搓;⑦避免在皮肤皱褶处用粉类制剂,如玉米淀粉或婴儿爽身粉;⑧避免日晒,建议穿防紫外线衣服。
外用糖皮质激素(激素):由于缺乏有效的治疗手段,除常规护理外,外用药物是防治放射性皮炎的有效措施。建议外用激素预防重度放射性皮炎及减轻不适和瘙痒,提高舒适度。每次放疗后,于照射部位涂抹0.1%糠酸莫米松或1%氢化可的松乳膏等低至中效外用激素,1~2次/d。放疗期间和放疗结束后数周内定期外用激素可降低重度皮炎(糜烂)发生率。但应警惕激素不良反应。
其他外用药物:预防放射性皮炎的细胞因子包括重组人粒细胞巨噬细胞刺激因子、表皮生长因子等。预防性用磺胺嘧啶银可降低放射性皮炎的严重程度,金盏花软膏可减少≥Ⅱ级放射性皮炎的发生。不推荐用新鲜芦荟、三乙醇胺、硫糖铝、透明质酸预防放射性皮炎。临床用的多种药物和敷料,包括凡士林软膏、抗坏血酸、尿囊素、杏仁油、橄榄油、右泛醇、屏障膜、银尼龙敷料、有机硅的成膜凝胶敷料均缺乏高等级的循证医学证据。
全身性药物:口服己酮可可碱 (每次400mg,每日3次)有利于减少放射性治疗后引起迟发性皮肤改变,如皮肤纤维化及皮肤坏死,但预防急性放射性皮炎效果与安慰剂类似。沙利度胺(每次100mg,每日1次)可显著减轻皮肤黏膜反应,提高生活质量。也有小型随机试验评估了蛋白水解酶 (木瓜蛋白酶、胰蛋白酶、糜蛋白酶混合物),抗氧化剂,锌补充剂,硫糖铝和姜黄素,但几乎无证据证明全身预防有效。
现代放疗技术:随着现代放疗技术进展,精准放疗已逐渐取代传统放疗技术。先进的调强放疗(intensitymodu-latedRT,IMRT)和容积旋转调强放疗(volumetricarcther- apy,VMAT)采用精准定位、精准计划、精准照射方式,可明显减少靶区外正常组织的辐射,并能降低皮肤反应的发生率。
2、治疗:
急性放射性皮炎:(1)Ⅰ级放射性皮炎:主要表现为轻度红斑、脱屑,大多数患者只需一般皮肤护理措施,如用亲水性润肤剂进行保湿,而不必用其他特殊治疗方法。中低效外用激素可有效控制瘙痒感,但抗组胺药一般不能减轻放射性皮炎引起的瘙痒。(2)Ⅱ~Ⅲ级放射性皮炎:治疗主要针对皮肤皱褶部位以及其他部位的糜烂,主要治疗措施包括预防皮肤继发感染以及糜烂部位护理。有研究显示,潮湿环境可加快伤口愈合速度,因此,可选择柔软、可吸收的硅胶泡沫绷带或水凝胶、水胶体敷料来治疗。这类敷料在移除时不会对创口和周围皮肤造成损伤。根据渗出的严重程度及时更换敷料,必要时联合外用药物。但迄今尚无随机对照试验对这些治疗进行比较。Ⅲ级放射性皮炎患者出现糜烂需要中断放疗,具体情况应视放疗部位及患者不适程度而定。Ⅱ~ Ⅲ级皮炎患者创口应至少每周评估1次,对可疑继发感染需及时查血常规并合理使用抗生素。LED光疗具有抗炎、促修复及再生作用,可以用于减轻放射性损伤及修复性治疗。(3)Ⅳ级放射性皮炎:可出现全层皮肤坏死和溃疡,多由放疗科、皮肤科医师、护理人员的多学科团队治疗,治疗方法主要包括外科清创、全厚皮片移植、肌皮瓣或带蒂皮瓣移植,具体处理应视个人情况而定,必要时需终止放疗。对已感染或有潜在感染风险的伤口,应积极局部或全身使用抗生素;富血小板血浆可用于创面再生和修复。
慢性放射性皮炎:最重要的预防方法是选择适当的放疗技术,避免对健康皮肤的不必要照射。研究显示,IMRT的应用可减少慢性放射性皮炎引起的皮肤萎缩、色素沉着和色素减退、皮肤硬结、皮肤溃疡、毛细血管扩张、纤维化、其他皮肤和皮下组织疾病。(1)慢性溃疡:由于电离辐射皮肤溃疡部位血运较差,保守治疗常难以治愈。部分溃疡可用特殊敷料治疗,如感染性伤口可用银离子敷料覆盖,而中等或大量渗出性伤口则需具有吸收性敷料,这种敷料不仅可避免溃疡区域受到严重感染,还可抑制分泌物大量产生。亲水性和亲脂性乳膏或软膏可单独使用或与敷料搭配以增强皮肤屏障功能。严重溃疡需要外科手术干预,包括从简单清创到对皮肤进行高级重建。此外,对于慢性难愈性皮肤溃疡以及疑似肿瘤病变可能需要进行组织病理学活检,明确诊断以排除继发皮肤肿瘤的可能。(2)皮肤纤维化:是放射性皮炎最严重、最难治皮肤并发症之一,其治疗包括创面护理、药物治疗、物理治疗、疼痛管理等多个方面。主动和被动活动(按摩)可有益于改善纤维化,有助于扩大活动范围及减少挛缩。单用己酮可可碱或与维生素E联合使用,可改善放疗诱导的皮肤纤维化,但放疗周期长短可影响治疗效果,通常需要至少2年可使皮肤纤维化得到显著改善。脉冲染料激光,点阵CO2激光和表皮移植是治疗放疗后纤维化的新方法,可阻止皮肤过度纤维化、诱导瘢痕正常重塑以及改善皮肤的柔韧性。(3)毛细血管扩张:对慢性放射性皮炎引起的毛细血管扩张治疗效果有限,脉冲染料激光证明是唯一有效的治疗方法。
小结
放射性皮炎会严重影响患者生活质量,需要多学科配合;在判断患者风险等级、皮肤的防护措施、患者长期治疗中需要给予规范、科学指导。
参考文献:
[1]中华医学会医学美容与美学分会皮肤美容学组.放射性皮炎诊疗专家共识[J].中华医学美学美容杂志,2021,10(27):353-357.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言