Mol Cancer:毛捷/吴丁兰/张隆基合作发现治疗胶质母细胞瘤的潜在新方法
2023-01-12 iNature iNature 发表于上海
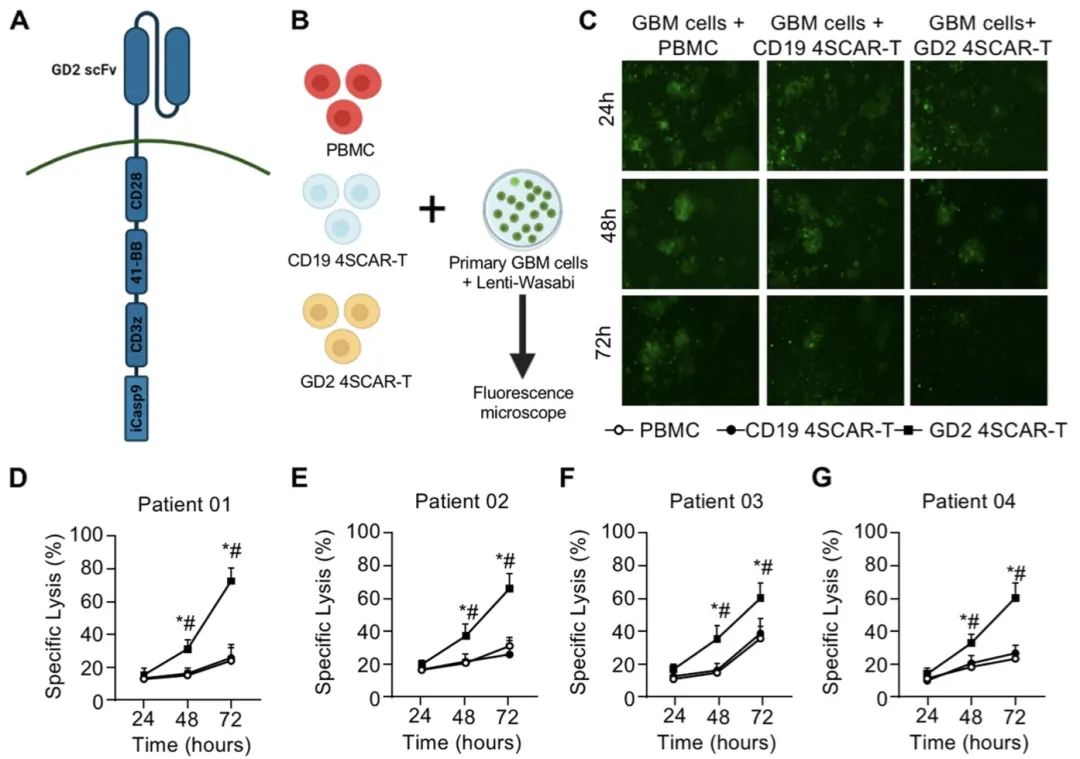
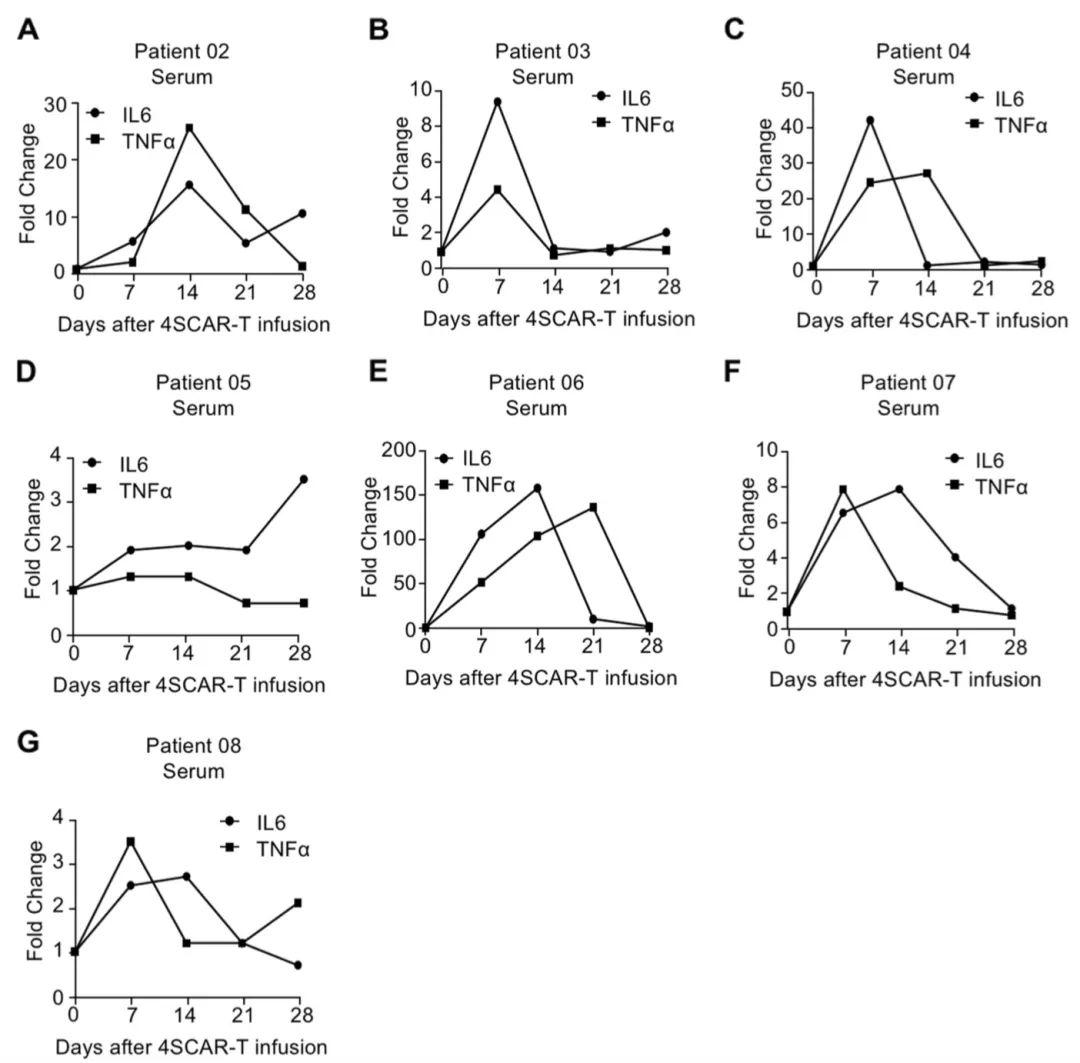
这项研究表明通过两种不同的途径向GBM患者输注自体GD2特异性4SCAR-T细胞是安全且耐受性良好的。此外,GD2特异性4SCAR-T细胞在肿瘤微环境中部分介导抗原丢失并激活免疫反应。
胶质母细胞瘤(glioblastoma,GBM)是最具侵袭性和致死性的人类脑肿瘤,尽管包括手术切除、放疗和化疗在内的联合治疗,但患者的预后仍然很差。嵌合抗原受体(CAR)-T疗法结合了单克隆抗体对肿瘤抗原的特异性识别和T细胞的肿瘤杀伤功能,为癌症治疗提供了一种新的策略。
双唾液酸神经节苷脂GD2在正常组织中主要表达于神经元细胞膜上,在许多恶性肿瘤中也有高表达。在脑肿瘤中,GD2在80%弥漫性固有桥脑胶质瘤(diffuse intrinsic pontine glioma,DIPG)的肿瘤表面富集。在动物研究表明,CAR-T细胞抗GD2可有效消除原位植入小鼠的GD2阳性人GBM和DIPG肿瘤,且无明显的神经毒性或脱靶效应。最近,报道了4例编码组蛋白H3 (H3K27M)突变的DIPG基因或脊髓弥漫性中线胶质瘤(diffuse midline glioma,DMG)患者使用GD2特异性CAR-T细胞治疗的临床经验。这些早期结果强调,GD2特异性CAR-T治疗H3K27M突变的DIPG和脊髓DMG是安全的,具有临床益处。考虑到GD2在正常的神经组织中表达,而抗GD2抗体治疗成神经细胞瘤与神经性疼痛相关,进一步临床探索GD2特异性CAR-T细胞治疗GBM是有必要的。
2023年1月9日,深圳市人民医院毛捷团队、南方医科大学深圳医院吴丁兰团队与深圳市免疫基因治疗研究院张隆基团队合作在Molecular Cancer 杂志在线发表题为“Safety and antitumor activity of GD2-Specific 4SCAR-T cells in patients with glioblastoma”的研究论文,该研究旨在验证输注GD2特异性第四代安全设计嵌合抗原受体(fourth-generation safety-designed CAR,4SCAR)-T细胞是否安全,以及CAR-T细胞是否具有抗胶质母细胞瘤活性。
研究表明单独和联合输注GD2特异性4SCAR-T细胞靶向GBM是安全的,耐受性良好,无严重不良事件。此外,GD2特异性4SCAR-T细胞在肿瘤微环境中部分介导抗原丢失并激活免疫反应。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言