Nature子刊:南方医科大学刘克玄团队揭示小肠类器官治疗缺血性肠损伤的作用及机制
2023-10-29 iNature iNature 发表于威斯康星
该研究揭示了血浆外泌体circEZH2_005有望作为肠I/R肠损伤敏感及特异的诊断生物标志物。
肠道类器官移植是一种很有前途的治疗粘膜损伤的方法。然而,移植类器官如何调节受体小鼠的免疫微环境及其在治疗肠缺血再灌注(I/R)损伤中的作用尚不清楚。
2023年10月25日,南方医科大学南方医院麻醉科刘克玄教授团队在Nature Communications在线发表了题为 “Organoids transplantation attenuates intestinal ischemia/reperfusion injury in mice through L-Malic acid-mediated M2 macrophage polarization” 的研究论文,该研究建立了一种将肠道类器官移植到肠道I/R小鼠体内的方法。该研究发现,移植可以提高小鼠的存活率,促进肠道干细胞的自我更新,并调节肠道I/R后的免疫微环境,这取决于巨噬细胞极化到抗炎M2表型的能力增强。
具体来说,该研究报道了l -苹果酸(MA)在类器官衍生的条件培养基和移植小鼠的盲肠内容物中高度表达和富集,表明类器官在移植过程中分泌MA。体内和体外实验均表明,MA诱导M2巨噬细胞极化,并以 SOCS2依赖的方式恢复白细胞介素-10水平。本研究为肠I/R损伤提供了一种治疗策略。
另外,2023年9月6日,南方医科大学南方医院麻醉科刘克玄教授团队在Nature Communications 杂志在线发表了题为“Exosomal circEZH2_005, an intestinal injury biomarker, alleviates intestinal ischemia/reperfusion injury by mediating Gprc5a signaling”的工作。该研究揭示了血浆外泌体circEZH2_005有望作为肠I/R肠损伤敏感及特异的诊断生物标志物,而且提出靶向circEZH2_005/hnRNPA 1/Gprc5a信号轴可能是肠I/R损伤的潜在治疗策略。

肠缺血再灌注损伤 (Ischemia/Reperfusion, I/R)常见于创伤、休克、感染、急性肠系膜缺血、肠梗阻、小肠移植及体外循环手术等临床情况,常因肠屏障的损伤导致肠外多器官功能不全或衰竭,死亡率极高。课题组探讨了小肠类器官对肠I/R肠损伤的保护作用及机制。
该团队培养小肠类器官并将其成功植入小鼠肠I/R后的受损肠粘膜组织,发现小肠类器官移植可显著提高肠I/R生存率(图1A-C),接着通过对造模后不同时间点受体小鼠肠组织学病理损伤和血清炎症因子水平进行分析,发现造模后36小时,类器官移植可明显加速修复和重建损伤的肠粘膜上皮,减轻炎症因子表达而促进IL-10抗炎因子分泌(图1D-H)。进一步对小鼠肠组织切片进行免疫荧光检测发现造模后36小时,类器官移植组受体小鼠肠组织细胞增殖标志物Ki67和潘氏细胞标志物Lysozyme表达较对照组相比明显增加(图1I-M)。这些结果表明肠 I/R 后小肠类器官移植模型的成功建立可以有效减轻小鼠肠 I/R 损伤,并促进损伤肠粘膜组织的再生修复。
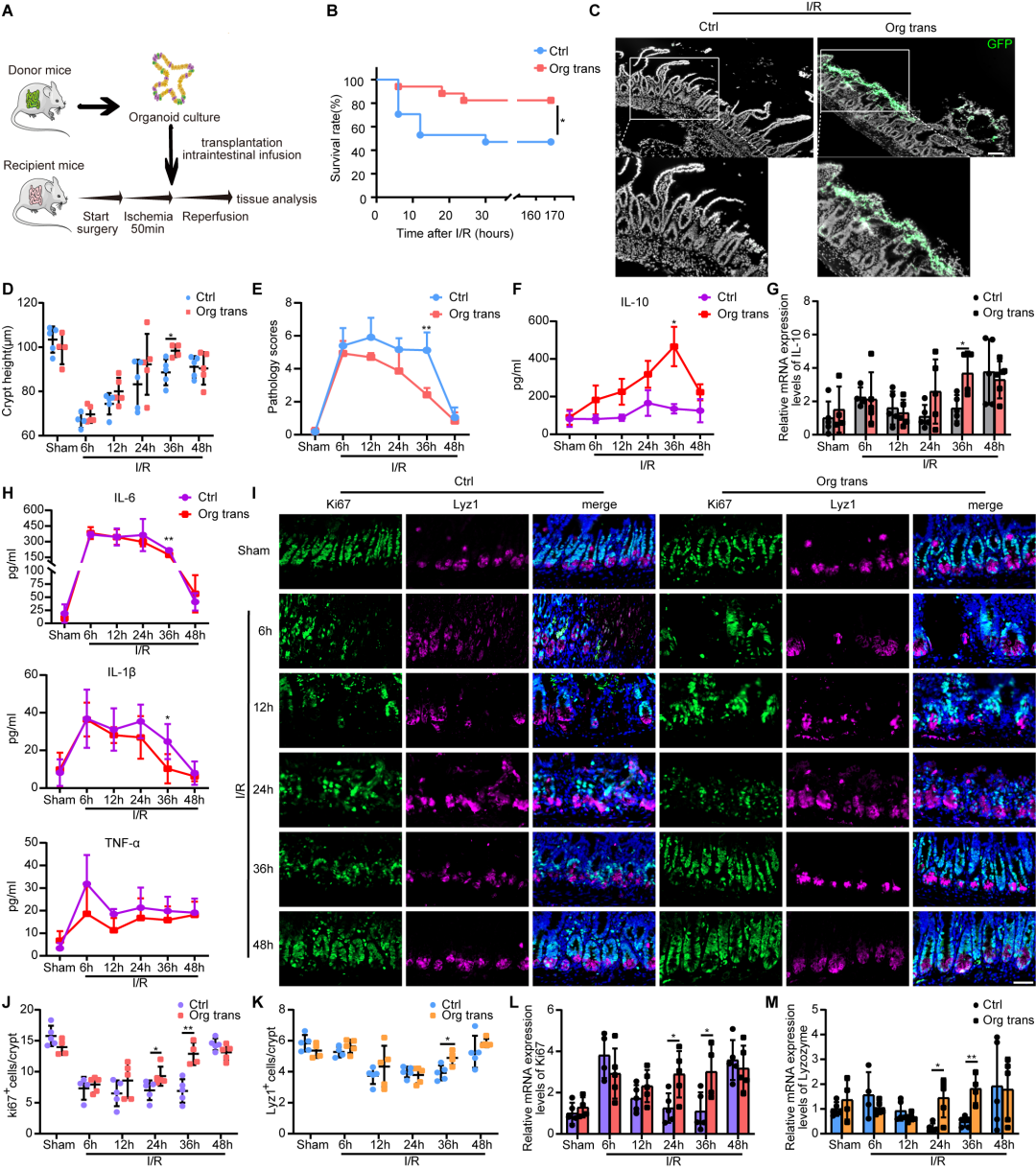
图1 小肠类器官移植改善肠缺血再灌注小鼠的损伤
然后,该团队通过条件培养基实验、非靶向和靶向代谢组学发现类器官通过分泌L-苹果酸调控巨噬细胞M2极化并分泌IL-10。结果如图2所示:小肠类器官条件培养基与原代骨髓巨噬细胞共培养可促进巨噬细胞 M2 极化并分泌IL-10(图2A-E)。进一步通过代谢组学检测发现,L-苹果酸在小肠类器官条件培养基中富集的代谢产物和小肠类器官移植组盲肠内容物中明显上调的代谢产物共同表达(图2F-K)。这些数据均提示L-苹果酸可能是调控巨噬细胞M2极化的小肠类器官代谢产物。

图2 类器官分泌的L-苹果酸调控巨噬细胞极化
该团队进一步通过基因敲除小鼠和过继回输实验确定了L-苹果酸的作用机制。对SOCS2基因敲除小鼠造模后发现L-苹果酸失去了对肠I/R损伤的保护作用,对单核细胞向巨噬细胞分化和极化调控作用被逆转。表明L-苹果酸以SOCS2依赖的方式诱导巨噬细胞M2极化及保护肠I/R损伤(图3A-G)。此外,通过对巨噬细胞过继回输,发现回输野生型小鼠而非SOCS2基因敲除小鼠L-苹果酸预处理后造模36小时的巨噬细胞能有效保护肠I/R损伤,降低炎症因子表达(图3H-K),此结果提示L-苹果酸依赖于SOCS2促进巨噬细胞M2极化从而保护肠I/R损伤。
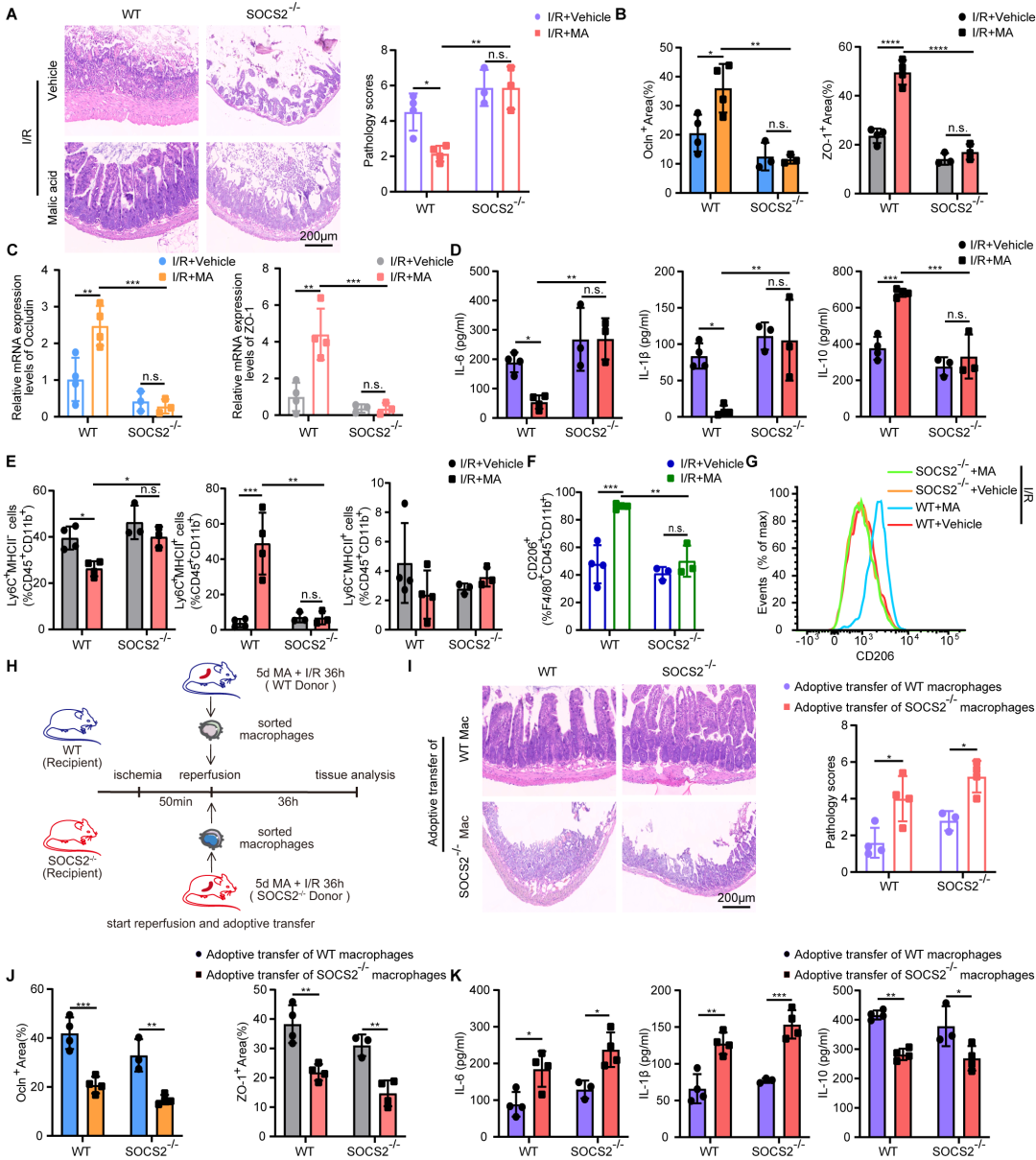
图3 MA依赖于SOCS2调节巨噬细胞极化减轻肠 I/R 损伤
该团队报道了小肠类器官在肠 I/R 损伤过程中利用其独特的定植特性影响局部免疫微环境,促进肠干细胞的自我更新。进一步研究发现,类器官通过分泌L-苹果酸作为代谢底物,在肠 I/R 损伤中以SOCS2依赖的方式促进巨噬细胞M2极化(图4)。

图4 肠类器官移植对肠I/R肠损伤的治疗作用
该研究揭示了小肠类器官通过分泌L-苹果酸调节免疫微环境改善肠I/R损伤,为临床治疗缺血性肠损伤提供了新策略。
南方医科大学南方医院麻醉科张芳玲博士,胡珍博士,王一帆博士为论文共同第一作者,刘克玄教授为论文通讯作者。这是刘克玄教授近3年在Eur Respir J 2022(IF:24.3), Nature Communications 2023(IF:16.6), Cell Reports Medicine 2023(IF:14.3), Microbiome 2022(IF:15.5), Gut Microbes 2021(IF:12.4),Br J Anaesth 2022 (IF:9.8)等期刊发表肠缺血再灌注损伤研究领域相关高水平论著后的另一重要突破。
原文链接:
https://www.nature.com/articles/s41467-023-42502-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言