Nat Mater:劫持肿瘤的迁移机制
2014-02-19 佚名 生物通
恶性细胞会沿着神经纤维和血管侵入到新的位点由此扩散至大脑,是胶质母细胞瘤极其难以治疗的因素之一。现在,研究人员学会了劫持这一迁移机制,利用比人类头发还要细的纳米纤维膜来引诱肿瘤细胞离开可转而对抗这种癌症。相关技术细节报道在2月16日的Nature Materials杂志上。【原文下载】 不再侵入到新的区域,迁移细胞结合到专门设计的纳米纤维上,跟随它们到达某一位点——有可能是在脑外——在那里迁移细
恶性细胞会沿着神经纤维和血管侵入到新的位点由此扩散至大脑,是胶质母细胞瘤极其难以治疗的因素之一。现在,研究人员学会了劫持这一迁移机制,利用比人类头发还要细的纳米纤维膜来引诱肿瘤细胞离开可转而对抗这种癌症。相关技术细节报道在2月16日的Nature Materials杂志上。【原文下载】
不再侵入到新的区域,迁移细胞结合到专门设计的纳米纤维上,跟随它们到达某一位点——有可能是在脑外——在那里迁移细胞遭到捕获并被杀死。利用这一技术,研究人员可以将无法施行手术部位上的肿瘤部分移动到更加可及的位点。尽管不能够消除癌症,新技术减小了动物模型中的脑肿瘤大小,表明这种形式的脑癌或许某一天能够更像是一种慢性病一样得到治疗。
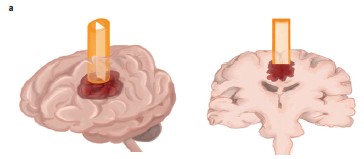
首席研究员、埃默里大学和乔治亚理工学院生物医学工程学系教授Ravi Bellamkonda说:“我们设计了一种聚合体薄膜纳米纤维,其模拟了脑肿瘤细胞通常利用来侵入大脑其他部位的神经及血管的结构。癌细胞通常结合到这些天然结构上,像乘坐单轨铁路一样搭乘它们到达大脑的其他部位。通过提供一种有吸引力的替代纤维,我们可以有效地将肿瘤沿着一条不同的路径移动到我们选择的目的地。”
由于这种浸润性、侵袭性的癌症往往形成于难以施行手术的某些大脑部位,治疗多形性胶质母细胞瘤(GBM)相当地困难。即便是可以除去原发性肿瘤,在确诊之前它们往往扩散到了其他的部位。
尽管一些攻击GBM的新药正在开发中,研究人员仍决定采用一种更加可操控的方法。论文的首作者Anjana Jain现在是Worcester理工学院生物医学工程学系的助理教授。当其还是乔治亚理工学院的研究生时,Jain从事的是脊髓再生的生物材料研究。随后在Bellamkonda实验室担当博士后研究人员期间,她看到了机会将她的研究生工作应用于开发针对GBM的潜在新治疗方法。
Jain说:“我们试图激活来修复脊髓的信号通路,就是研究人员想要在胶质母细胞瘤中失活的信号通路。”
肿瘤细胞通常通过分泌一些酶来侵入到健康组织。这种活动需要来自癌细胞的大量能量。
“我们的想法是给予肿瘤细胞一条阻力最小的途经,其与大脑中的天然结构相似,且它不需要癌细胞耗费更多的能量。”
采用实验方法,研究人员构建出了这种纳米纤维,其表面模拟了癌细胞通常沿着迁移的神经和血管的外形。将这些纤维植入到人类GBM肿瘤生长的大鼠大脑中。这一仅达到人类头发一半直径的纳米纤维,发挥肿瘤向导作用,引导这些迁移细胞到达了包含药物环靶明(cyclopamine)的“肿瘤捕获”凝胶中。这些肿瘤捕获凝胶位于大脑外的身体部位。
18天后,研究人员发现相比于对照大鼠,在肿瘤附近抑制PCL纳米纤维的动物体内肿瘤显著缩小。肿瘤细胞移动到了脑外的捕获凝胶中。
Bellamkonda说,尽管是理想的治疗方法通常是消除癌症,但这种新技术或许能够控制不宜动手术的癌症的生长,使得患者能够过上正常的生活。
在将这一技术应用于人类之前,还需要开展广泛的测试并获得FDA的批准,这一过程需要差不多10年的时间。下一步研究人员打算在其他形式的脑癌和难以移除的其他癌症类型中评估这一技术。
原始出处:
Jain A1, Betancur M2, Patel GD2, Valmikinathan CM2, Mukhatyar VJ2, Vakharia A2, Pai SB2, Brahma B3, Macdonald TJ4, Bellamkonda RV2.Guiding intracortical brain tumour cells to an extracortical cytotoxic hydrogel using aligned polymeric nanofibres.Nat Mater. 2014 Feb 16. doi: 10.1038/nmat3878. 【原文下载】
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#迁移机制#
32
#Nat#
34
#迁移#
33