学术前沿|Lancet:晚期胆道恶性肿瘤治疗——帕博利珠单抗联合吉西他滨+顺铂vs单用吉西他滨+顺铂
2023-12-29 临床肝胆病杂志 临床肝胆病杂志 发表于上海
本研究旨在评估在吉西他滨和顺铂的基础上联用抗PD-1单克隆抗体帕博利珠单抗能否提高晚期BTC患者一线治疗疗效。

据目前报道,KEYNOTE-966是首个程序性死亡受体1抑制剂的安慰剂对照研究,也是有关程序性死亡受体1或其配体检查点抑制剂显著改善晚期胆道恶性肿瘤患者总生存期且安全性可控的第2个研究。KEYNOTE-966研究提供了TOPAZ-1研究之外的重要发现,得益于更大的样本量、更高非亚裔患者的比例、持续使用吉西他滨直至疾病进展、更全面地评估重要的临床生物标志物(如乙型肝炎和丙型肝炎病毒状态),上述因素均可能影响研究结果对于全球患者的普适性。
1背景
胆道恶性肿瘤(BTC)是一组起源于肝内外胆管和胆囊的复杂上皮恶性肿瘤,预后较差。虽然BTC占全球总新发肿瘤患者数低于1%,但发病率在持续攀升。研究发现,BTC肿瘤微环境广泛呈现免疫抑制或免疫豁免特征,因此对程序性死亡受体1及其配体(PD-1/PD-L1)抑制剂单药治疗的反应性较低。已知包括吉西他滨和顺铂在内的几种化疗药物可以通过直接免疫刺激机制、下调免疫抑制微环境和增强免疫原性来调节免疫系统,上述免疫调节机制为免疫联合化疗治疗肿瘤特别是呈现免疫抑制微环境特征肿瘤提供了强有力的理论依据。针对晚期BTC患者的随机双盲Ⅲ期TOPAZ-1研究表明,与单用吉西他滨和顺铂相比,联用PD-L1抑制剂度伐利尤单抗显著提高了患者的总生存期(OS)。本研究旨在评估在吉西他滨和顺铂的基础上联用抗PD-1单克隆抗体帕博利珠单抗能否提高晚期BTC患者一线治疗疗效。
2方法
2.1. 研究设计及患者
KEYNOTE-966研究是在亚太、欧洲、北美和南美的175个研究中心开展的一项随机、双盲、安慰剂对照的Ⅲ期研究。纳入标准:年龄≥18岁;经组织学证实不可切除的局部晚期或转移性肝外胆管癌、胆囊癌或肝内胆管癌(包括混合型肝细胞癌-胆管癌);由研究者根据实体肿瘤疗效评价标准(RECIST)1.1版确定为可测量病灶;ECOG体能状态评分0或1;可提供肿瘤组织用于生物标志物检测;脏器功能良好;患者预期寿命超过3个月。在诊断为不可切除或转移性肿瘤前≥6个月完成新辅助或辅助治疗的患者也可纳入研究。既往或目前存在HCV感染的患者符合纳入标准。乙型肝炎活动期但可控的患者可纳入研究,包括HBsAg阳性或可检测到HBV DNA,在治疗开始前至少4周接受抗病毒治疗且病毒载量<100 IU/mL。排除壶腹癌或在既往2年内合并有需要系统治疗的活动性自身免疫疾病者。
2.2. 随机化与盲法
研究人员使用中央交互式语音应答系统(美国Almac Clinical Technologies公司)和研究资助者生成的随机列表,将患者按1∶1随机分配至帕博利珠单抗联合化疗组或安慰剂(生理盐水)联合化疗组。按地理区域(亚洲 vs 非亚洲)、疾病分期(局部晚期 vs 转移性)和肿瘤原发部位(肝外胆管 vs 胆囊 vs 肝内胆管)进行分层随机化。
2.3. 研究流程
每3周静脉注射1次帕博利珠单抗200 mg或安慰剂(生理盐水)。每3周的第1天和第8天静脉注射吉西他滨1 000 mg/m2和顺铂25 mg/m2。持续上述所有治疗,直至出现疾病进展、不可耐受的毒性反应、研究者决定停止治疗、患者撤回同意或其他原因(以先发生者为准)。帕博利珠单抗和安慰剂至多应用35个周期,顺铂至多应用8个周期,吉西他滨无周期限制。因不可耐受的毒性反应而停用吉西他滨和/或顺铂的患者可以继续使用帕博利珠单抗或安慰剂,反之亦然。不允许接受交叉治疗。
2.4. 研究结局
主要终点OS定义为从随机分组至全因死亡的时间,次要终点包括无进展生存期(PFS)、客观缓解率(ORR)、缓解持续时间(DoR)以及安全性,其中PFS、ORR和DoR由盲态独立中心评审根据RECIST 1.1版评估。PFS定义为从随机分组至首次记录出现疾病进展或全因死亡的时间,以先发生者为截点。ORR定义为最佳总体反应为完全或部分缓解的患者比例。DoR定义为从首次出现完全或部分缓解到出现疾病进展或全因死亡的时间,以先发生者为截点。
2.5. 统计学处理
使用Maurer & Bretz图解法,将所有OS、PFS和ORR假设的第一类总错误率严格控制在单侧α=0.025。判断帕博利珠单抗联合化疗较安慰剂联合化疗疗效更优的单侧P值边界,对于OS为0.020 0,PFS为0.012 5,ORR为0.012 5。使用R 3.6.1软件计算样本量和统计效力。使用SAS 9.4软件进行统计学分析。
3结果
2019年10月4日—2021年6月8日对1 564例BTC患者进行筛选,其中1 069例被随机分配至帕博利珠单抗联合化疗组(n=533)或安慰剂联合化疗组(n=536),并纳入意向性治疗人群(图1)。基线时,治疗组间的人口统计学数据和患者特征基本平衡(表1)。
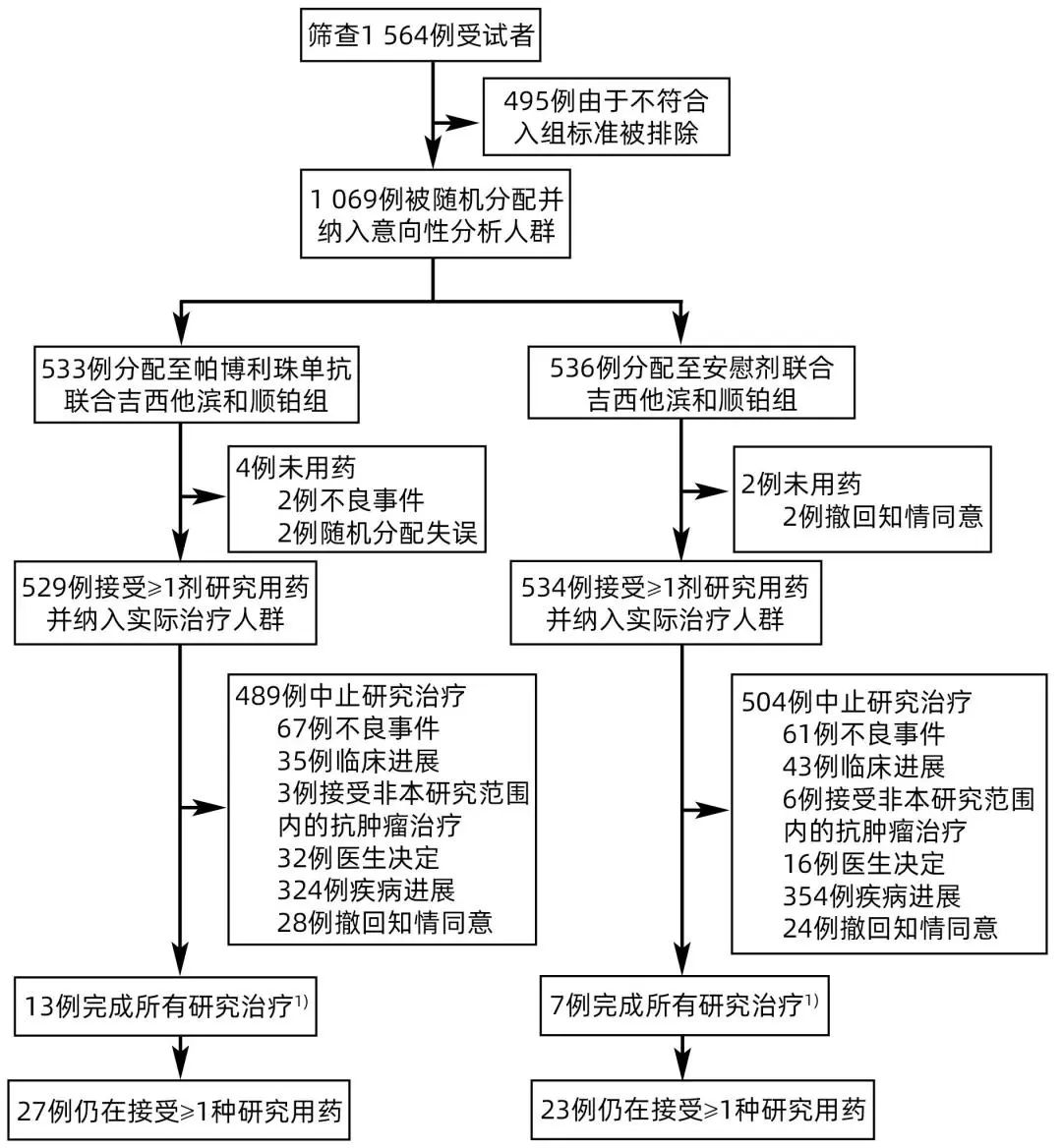
注:1)完成研究的患者包括接受35个周期的帕博利珠单抗或安慰剂且无其他理由停药的患者,若有必要可给予超过35个周期的帕博利珠单抗或安慰剂治疗。
图1 研究流程图
最终分析时中位随访时间(定义为从随机分配到2022年12月15日数据截止)为25.6(21.7~30.4)个月。帕博利珠单抗联合化疗组中位治疗持续时间为6.37(2.79~10.84)个月,安慰剂联合化疗组为5.54(2.53~9.69)个月。帕博利珠单抗联合化疗组中位治疗周期为9(4~16)周期,安慰剂联合化疗组为8(4~14)周期。在意向性治疗人群中,帕博利珠单抗联合化疗组533例患者中有253例(47%)和安慰剂联合化疗组536例患者中有261例(49%)接受1种或多种后续抗肿瘤治疗。
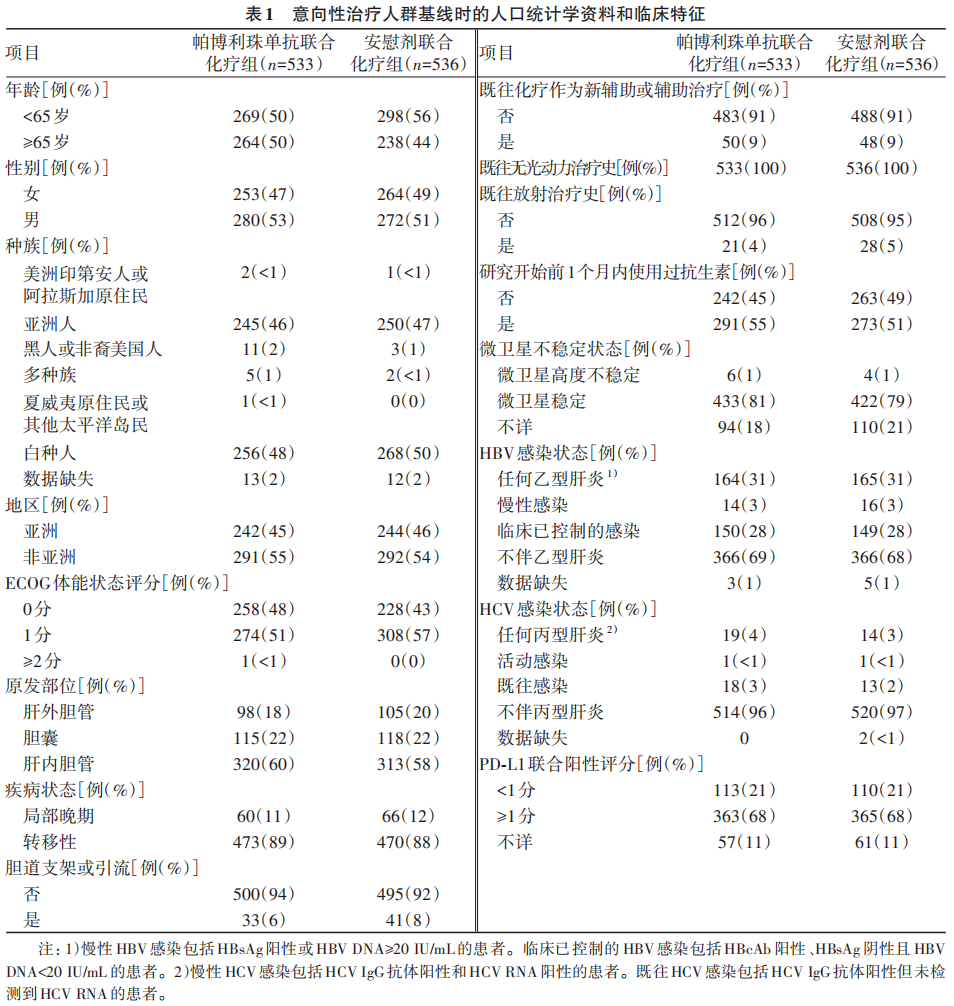
最终分析显示,帕博利珠单抗联合化疗组中位OS为12.7个月(95%CI:11.5~13.6),安慰剂联合化疗组10.9个月(95%CI:9.9~11.6)。帕博利珠单抗联合化疗组估算12个月OS率为52%(95%CI:47~56),安慰剂联合化疗组为44%(95%CI:40~48);帕博利珠单抗联合化疗组估算24个月OS率为25%(95%CI:21~29),安慰剂联合化疗组为18%(95%CI:15~22)(图2a)。帕博利珠单抗联合化疗组达到具有统计学意义的OS获益疗效边界(HR=0.83,95%CI:0.72~0.95,P=0.003 4)。描述性亚组分析显示,在大多数预设的亚组中,帕博利珠单抗联合化疗组均有获益,包括PD-L1联合阳性评分<1分和≥1分亚组(图2b)。

注:a,使用Kaplan-Meier法估算OS;小栅栏表示删失数据。b,包括所有≥5%意向性治疗人群亚组的OS,垂直灰色阴影带表示总人群的95%CI。总人群的分析基于与主要分析相同的分层Cox回归模型。使用未分层Cox模型进行亚组分析,并将治疗作为协变量。亚组的置信区间处于名义95%CI,且未对多重性进行调整。
图2 最终分析中意向性治疗人群的OS
首次中期分析[截至2021年12月15日、中位随访时间为13.6(9.7~18.4)个月]时,帕博利珠单抗联合化疗组中位PFS为6.5个月(95%CI:5.7~6.9),安慰剂联合化疗组为5.6个月(95%CI:5.1~6.6)(图3)。帕博利珠单抗联合化疗组未达到具有统计学意义的PFS获益的疗效边界(HR=0.86,95%CI:0.75~1.00,P=0.023)。
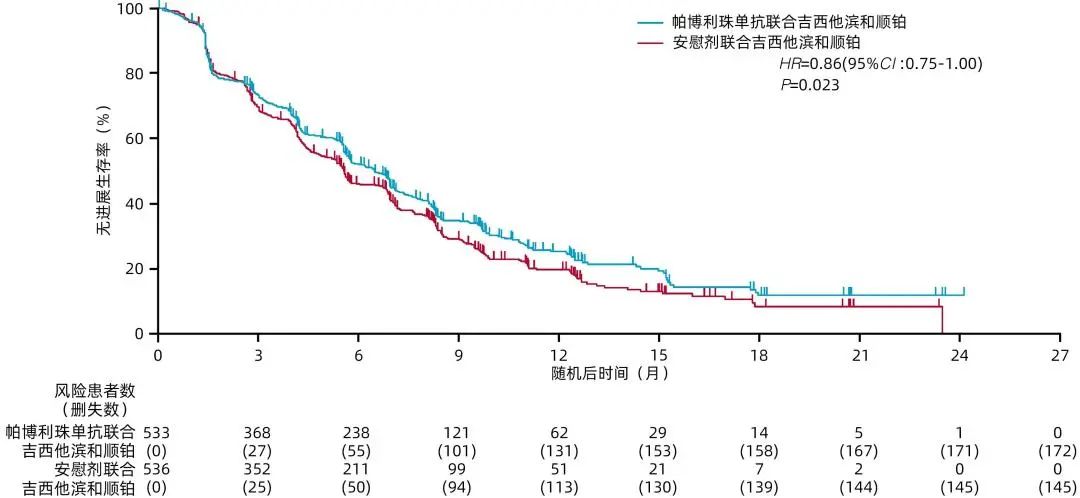
注:小栅栏表示删失数据。
图3 首次中期分析时,根据盲态独立中央评审评估使用Kaplan-Meier法估算意向性治疗人群的PFS
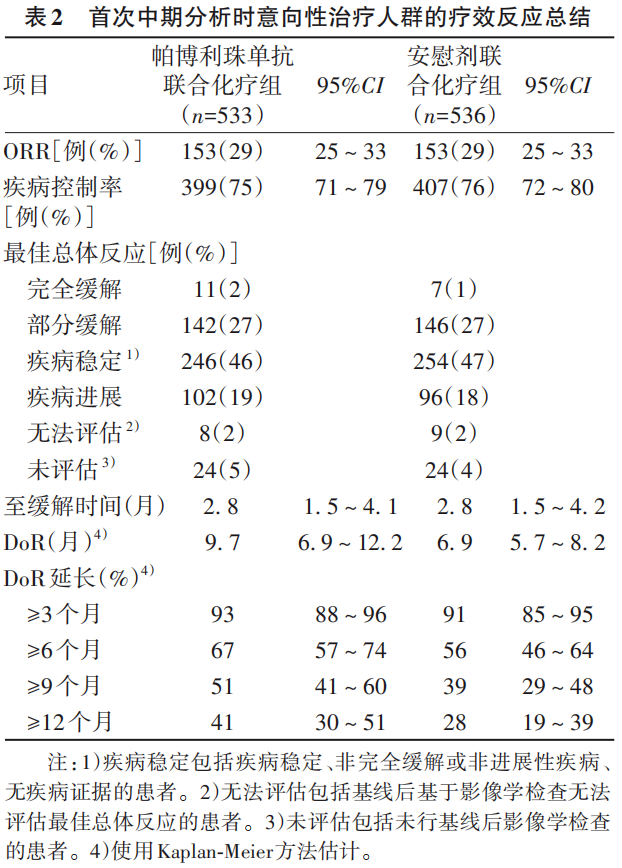
在首次中期分析时,帕博利珠单抗联合化疗组533例患者中153例(29%,95%CI:25~33)和安慰剂联合化疗组536例患者中153例(29%,95%CI:25~33)出现完全或部分缓解(表2)。帕博利珠单抗联合化疗组未达到具有统计学意义的ORR获益的疗效边界(治疗差异0.2%,95%CI:-5.2~5.6,P=0.47)。帕博利珠单抗联合化疗组的中位DoR为9.7个月(95%CI:6.9~12.2),安慰剂联合化疗组为6.9个月(95%CI:5.7~8.2)。帕博利珠单抗联合化疗组估算的24个月的持续缓解率为18%(95%CI:11~26),安慰剂联合化疗组为6%(2~13)。
最终分析显示,在实际治疗人群中,帕博利珠单抗联合化疗组529例患者中524例(99%)和安慰剂联合化疗组534例患者中532例(<100%)患者发生全因不良事件(AE)。帕博利珠单抗联合化疗组420例(79%)患者和安慰剂联合化疗组400例(75%)患者发生3~4级AE。表3中总结2组超过15%患者发生的AE。未观察到美国肝病学会定义的HBV再激活伴肝炎爆发病例。
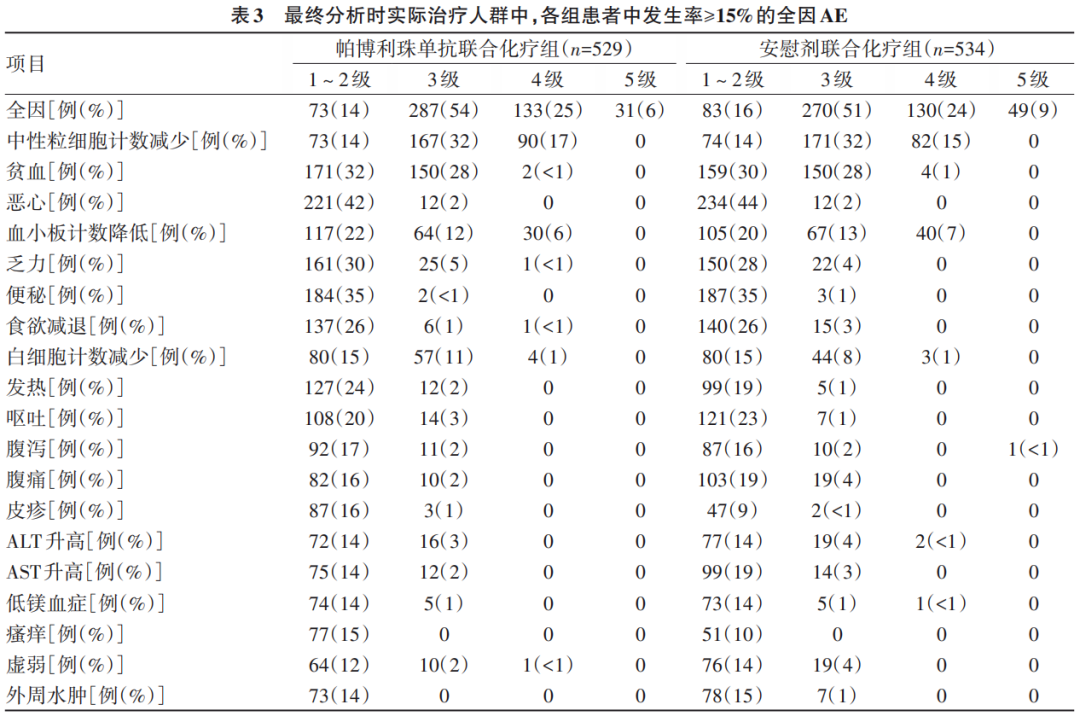
最终分析显示,帕博利珠单抗联合化疗组529例患者中493例(93%)发生治疗相关AE,其中369例(70%)患者为3~4级AE,102例(19%)停用≥1种研究药物,18例(3%)停用所有研究药物。安慰剂联合化疗组534例患者中500例(94%)发生治疗相关AE,其中367例(69%)为3~4级AE。81例(15%)停用≥1种研究药物,14例(3%)停用所有研究药物。帕博利珠单抗联合化疗组8例(2%)和安慰剂联合化疗组3例(1%)患者因治疗相关AE死亡。帕博利珠单抗联合化疗组529例患者中117例(22%)和安慰剂联合化疗组534例患者中69例(13%)发生潜在免疫介导相关AE和输液反应,其中帕博利珠单抗联合化疗组有7%(37例)和安慰剂联合化疗组有4%(21例)发生3~4级AE。肺炎是唯一导致死亡的免疫介导相关AE,发生于帕博利珠单抗联合化疗组1例(<1%)。帕博利珠单抗联合化疗组和安慰剂联合化疗组中分别有48例(9%)和26例(5%)因免疫介导相关AE和输液反应接受皮质类固醇治疗。
4讨论
在随机、安慰剂对照的Ⅲ期KEYNOTE-966临床研究中,对比单用吉西他滨和顺铂化疗方案,帕博利珠单抗联合吉西他滨和顺铂作为不可切除的局部晚期或转移性BTC患者一线治疗方案显著提高了患者的OS。总体生存曲线未交叉、早期即分离,并在整个随访过程中呈持续分离状态,帕博利珠单抗组估算24个月OS率为25%,安慰剂组仅为18%。帕博利珠单抗组的中位DoR也较安慰剂组更长(首次中期分析,9.7个月 vs 6.9个月)。吉西他滨和顺铂联用帕博利珠单抗的OS获益在大多数预设的亚组(包括基于地区和病因分层的亚组)中基本一致。
虽然KEYNOTE-966和TOPAZ-1研究设计相似,但仍有不同之处。首先,吉西他滨治疗持续时间不同。在TOPAZ-1研究中,吉西他滨至多维持8个治疗周期,而在KEYNOTE-966研究中吉西他滨无用药最大周期限制,可以持续给药直至出现疾病进展或无法耐受的毒性反应。总体而言,帕博利珠单抗联合化疗组43%和安慰剂联合化疗组39%的患者接受≥9个周期的吉西他滨治疗,其中帕博利珠单抗联合化疗组32%和安慰剂联合化疗组27%的患者接受≥12个周期的吉西他滨治疗。KEYNOTE-966和TOPAZ-1研究中吉西他滨治疗持续时间的不同反映了临床实践的异质性,为全球不同的标准治疗方案补充了理论依据。其次,KEYNOTE-966研究按地理区域进行分层随机化,而TOPAZ-1研究没有这一设计。此外,KEYNOTE-966研究较TOPAZ-1研究招募更多患者(1 069例 vs 685例),且非亚洲地区患者的比例更高(583例 vs 311例,55% vs 45%)。在KEYNOTE-966研究中,帕博利珠单抗联合吉西他滨和顺铂在大量非亚洲人群中的相对获益与在意向性治疗人群中观察到的相似。再者,KEYNOTE-966研究对生物标志物的评估较TOPAZ-1研究更全面,包括PD-L1表达和病毒性肝炎状态,为在不同患者亚组中联合帕博利珠单抗治疗提供了更多依据。最后,两项研究的总体生存曲线的形状和分离时间不同。在KEYNOTE-966研究中,随机分组后约第2个月,曲线分离且有利于帕博利珠单抗联合化疗组,并随着治疗时间推移保持相对一致的分离状态。KEYNOTE-966和TOPAZ-1研究之间的一个显著相似之处是,较高的PD-L1表达水平与免疫联合化疗使患者获益之间无显著相关性,尽管在这两项研究中使用不同的PD-L1测定方法和评分方法,但研究结果相一致。
在KEYNOTE-966研究的首次中期分析中,对PFS预设的最终分析,尽管帕博利珠单抗联合化疗组较安慰剂联合化疗组的PFS有差异,但未达统计学差异。评估BTC患者的PFS比较复杂,通常借助于胆道梗阻情况、肝功能和血清CA19-9表达水平等非肿瘤直接评估方法。因此,根据RECIST 1.1版评估的PFS可能并非衡量BTC症患者无进展生存的最佳指标。本研究两组间ORR也无显著差异,安慰剂联合化疗组ORR高于TOPAZ-1研究中的ORR,但与近期其他研究中的吉西他滨和顺铂组ORR相似。帕博利珠单抗联合化疗组的疗效比安慰剂组更持久,最终分析显示,估算帕博利珠单抗联合化疗组和安慰剂联合化疗组分别有18%和6%的响应者,在24个月时存活且无疾病进展。
帕博利珠单抗联合化疗(吉西他滨+顺铂)的AE谱与研究预期一致,符合每种研究药物已知的AE谱,并且各组间AE发生率相似。最常见的AE是血细胞计数异常、恶心和乏力,这些AE已知与化疗有关。与预期相符,帕博利珠单抗组潜在的免疫介导相关AE更多见,但通过适当的支持性治疗后症状可控。用于治疗免疫介导相关AE的全身皮质类固醇使用率较低(实际治疗人群中使用率<10%)。此外,接受帕博利珠单抗联合化疗的患者能够维持可接受的健康相关生活质量。
本研究的局限性包括:首先,招募的肝内胆管癌比例过高,导致肝外胆管癌和胆囊癌样本量相对较小,可能会影响亚组分析的结果。在包括TOPAZ-1研究在内的其他研究中也观察到对肝内胆管癌的偏向性,可能也从侧面反映了全球肝内胆管癌发病率的上升趋势。由于肝内胆管癌更易取样,入组时对肿瘤组织取样要求也可能导致了受试者选择性偏倚。其次,由于伴有高度微卫星不稳定性(MSI-H)的BTC发生率较低,在本研究中也仅有10例MSI-H病例,因此无法通过微卫星不稳定状态来评估治疗结局。
综上所述,KEYNOTE-966研究达到了研究设计的主要终点,即帕博利珠单抗联合化疗(吉西他滨和顺铂)较单用化疗(吉西他滨和顺铂)可使初治转移性或无法切除的BTC患者OS获得统计学及临床显著意义的改善,同时未增加新的安全风险,帕博利珠单抗联合吉西他滨和顺铂有望成为该人群新的治疗策略。
版权声明:本文原文“Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966):a randomised, double-blind, placebo-controlled, phase 3 trial”,首次发表在Lancet,2023, 401(10391):1853-1865。本次二次发表已取得版权所有者©2023 Elsevier出版社的同意,对原文进行翻译,不涉及一稿多投及侵犯版权等问题。
专家点评:BTC涵盖胆囊癌(GBC)及肝内、外胆管癌(ICC/ECC),具有侵袭性强、死亡率高、预后差的特点。BTC在全球范围内的发病率呈现上升趋势,在亚洲国家最为常见,我国BTC的疾病负担相较欧美更为严重。我国是乙型肝炎和原发性肝癌发病率高发国家,而ICC约占原发性肝癌的10%~15%。国家癌症中心发布的2016年数据预计我国每年BTC新发人数约11万。由于早期BTC患者无明显临床症状,70%以上的患者在确诊时已处于进展期或晚期。
近年来,免疫检查点抑制剂相关研究相继在包括BTC在内的各个瘤种中取得阳性结果,显示以免疫检查点抑制剂为核心的治疗方案能够显著延长患者的生存时间。而TOPAZ-1研究和KEYNOTE-966研究的成功,进一步证实了免疫治疗晚期BTC的有性效和安全性,标志着BTC治疗已进入了免疫治疗时代。相较于TOPAZ-1研究,KEYNOTE-966研究具有入组样本量更大、患者基线特征更为均衡(如入组更高比例的非亚裔患者)以及临床生物标志物(如乙型肝炎和丙型肝炎病毒状态)的检测更为全面等特点。
在KEYNOTE-966研究中,帕博利珠单抗联合化疗组和安慰剂联合化疗组的OS为12.7个月和10.9个月,死亡风险降低17%(HR=0.83,95%CI:0.72~0.95,P=0.003 4),帕博利珠单抗联合化疗组2年生存率达25%,且具有可控的安全性。此外,值得注意的是,KEYNOTE-966研究中两组的OS曲线在2个月时即呈分离状态,并且随着随访时间仍维持分离,提示多数BTC患者都可从帕博利珠单抗联合吉西他滨+顺铂化疗方案中生存获益。药物疗效以及较大的样本量,可能也是研究早期OS曲线即发生分离的原因。KEYNOTE-966研究中帕博利珠单抗联合化疗组较安慰剂联合化疗组的DoR也有明显延长(9.7个月 vs 6.9个月),24个月持续缓解的患者比例为18%和6%,表明患者如果治疗获益即可获得较长的获益时间,这与既往免疫治疗研究的认知一致。
2023年美国临床肿瘤学会年会报道了KEYNOTE-966研究健康相关生活质量(HRQoL)数据,结果显示,在吉西他滨+顺铂化疗基础上联用帕博利珠单抗一线治疗晚期BTC患者,HRQoL可维持较好水平;两组间疾病进展至恶化时间相似。连同之前报告的KEYNOTE-966研究的疗效和安全性数据,进一步支持帕博利珠单抗联合吉西他滨+顺铂化疗可作为晚期BTC患者新一线治疗方案的选择。
虽然晚期BTC治疗正式迈入了免疫治疗时代,但依然存在着许多尚未解决的问题,例如不同亚型对免疫治疗的获益差异、疗效标志物的探索以及如何进一步提高患者疗效等亟待明确。
在TOPAZ-1和KEYNOTE-966研究的OS亚组分析中,均观察到不同疾病亚型对免疫治疗获益具有差异性。在KEYNOTE-966研究中,相较于GBC和ECC人群,ICC人群治疗获益更大(HR=0.76),这体现出BTC生物学行为的强异质性,可能与不同BTC亚型间病因和免疫微环境的差异有关,对化疗和免疫治疗的应答也不尽相同。ICC患者对于吉西他滨+顺铂化疗的敏感性较差,可能因此凸显了联合免疫治疗对提升此类患者OS具有潜在优势。而对于GBC和ECC患者的免疫治疗获益问题需要更多讨论,在临床实践中不乏患者从免疫治疗获益的案例。未来需要进一步探寻有效的生物标志物,以确定BTC免疫治疗优势获益人群。
目前,关于晚期BTC中预测免疫治疗应答的生物标志物主要包括PD-L1表达、肿瘤突变负荷、MSI-H、错配修复缺陷(dMMR),DNA损伤修复基因突变和肿瘤浸润淋巴细胞等。但除MSI-H/dMMR外,其余生物标志物的证据等级较低,临床应用尚未达成共识。KEYNOTE-158研究队列K纳入了不限肿瘤来源的晚期MSI-H/dMMR实体瘤(除外结直肠癌),其中含BTC患者22例,经帕博利珠单抗治疗中位OS达到19.4个月,3年及以上OS率达30.3%,表明帕博利珠单抗可使1/3的BTC患者生存期突破3年。因此,《中国抗癌协会胆道恶性肿瘤靶向及免疫治疗指南(2022)》中指出,对于不可切除和转移性患者推荐增加分子检测,包括MMR检测,并推荐帕博利珠单抗单药可用于MSI-H/dMMR的胆道恶性肿瘤一线治疗(1A类推荐)。
“三联四药”方案治疗晚期BTC,即PD-1单抗联合贝伐珠单抗、仑伐替尼等抗血管生成药物以及GEMOX(吉西他滨和奥沙利铂)或吉西他滨+顺铂化疗方案,已陆续开展多项相关研究,阶段性报道ORR达到37.5%~80%,但研究结果均基于较小的样本量,治疗有效性和安全性尚待大样本量研究结果综合评估。目前对“三联四药”方案疑虑的焦点,即在于肝胆肿瘤病患治疗前往往存在肝功能异常的基线状态,强大的给药方案病患是否能够耐受,以及是否会加剧患者的治疗风险。此外,随着BTC分子诊断研究的进展,未来或许还可根据患者分子特征探索免疫联合明确靶点药物治疗方案的可行性,以期为患者带来更优的疗效。
点评专家:姜小清(海军军医大学第三附属医院胆道一科),赵海涛(北京协和医院肝脏外科)
全文下载 PDF & HTML
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.11.033
引证本文 Citation
李斌, 姜小清, 赵海涛 . Lancet|KEYNOTE-966Ⅲ期临床研究:晚期胆道恶性肿瘤治疗——帕博利珠单抗联合吉西他滨+顺铂 vs 单用吉西他滨+顺铂[J]. 临床肝胆病杂志, 2023, 39(11): 2745-2752

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#吉西他滨# #帕博利珠单抗# #胆道恶性肿瘤#
34