【论著】| EGFR T790M突变非小细胞肺癌患者的临床病理学、免疫微环境特征及对预后预测的意义
2024-05-25 中国癌症杂志 中国癌症杂志 发表于上海
本研究探讨了获得性T790M的免疫微环境特征。特别是携带TSG改变时的免疫微环境变化,以期为实现NSCLC个性化精准治疗提供有力依据。
[摘要] 背景与目的:表皮生长因子受体20号外显子T790M突变(epidermal growth factor receptor exon 20 threonine-to-methionine substitution mutation at position 790,EGFR T790M)是非小细胞肺癌(non-small cell lung cancer,NSCLC)对第一/二代EGFR酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitor,EGFR TKI)的获得性耐药机制之一,EGFR T790M突变也可见于未经EGFR TKI治疗的NSCLC,本研究旨在比较原发性和获得性EGFR T790M突变NSCLC中的临床病理学特征和预后差异,进一步探讨NSCLC中获得性T790M突变的免疫微环境特征。方法:本研究回顾性分析复旦大学附属肿瘤医院从2020年4月—2022年9月诊断的3762例NSCLC,其中2070例(55.02%)存在EGFR突变,556例(14.77%)接受EGFR TKI治疗。其中EGFR T790M突变的NSCLC 119例(3.16%),51例(1.35%)为原发性EGFR T790M突变,68例(1.81%)为获得性EGFR T790M突变。收集患者的临床资料,对原发性和获得性T790M突变NSCLC进行比较,采用多重免疫荧光组织化学(multiple immunofluorescence histochemistry,mIHC)探讨获得性T790M突变NSCLC免疫微环境特征。结果:原发性和获得性T790M突变在女性患者中的比例均高于男性;原发性T790M突变患者更为年轻;原发性和获得性T790M突变均更容易出现在差分化癌中;原发性T790M突变NSCLC患者中,程序性死亡受体配体1(programmed death-ligand 1,PD-L1)表达阳性率较高(60.00%);获得性T790M突变NSCLC患者中,PD-L1表达阳性率较低(22.39%)。获得性T790M突变NSCLC往往伴随着TP53改变(39.7%)。单因素Cox回归分析结果显示,间质表皮转化因子(mesenchymal to epithelial transition factor,MET)改变是出现获得性T790M突变的危险因素(P=0.000 5)。原发性和获得性T790M突变的平均总生存期(overall survival,OS)差异无统计学意义(分别为35.4和37.3个月)。然而,获得性T790M突变患者复发和转移的比例较高。获得性T790M突变中,间质区域存在更多的免疫细胞浸润,如CD20+B淋巴细胞、CD23+B淋巴细胞、CD8+T淋巴细胞、CD8+程序性死亡受体1(programmed death 1,PD-1)-/+细胞、CD20+PD-1-/+细胞及CD23+PD-1-/+细胞等。此外,研究发现EGFR伴有抑癌基因(tumor suppressor gene,TSG)改变时,肿瘤细胞与CD8+T淋巴细胞、CD20+B淋巴细胞、CD8+PD-1+ 细胞、CD20+PD-1+细胞和 CD23+PD-1+细胞的平均距离较仅有EGFR突变更近。结论:相较于原发性T790M突变,获得性T790M突变的病例中,PD-L1阳性率较低。获得性T790M突变常伴有TP53改变,而MET改变则是引发获得性T790M突变的一个危险因素。虽然获得性T790M突变患者的复发和转移风险较高,但其平均OS与原发性T790M突变患者并无显著差异。获得性T790M突变患者中,伴有TSG突变时可改变免疫细胞的空间分布,有望从免疫治疗中获益。
[关键词] 非小细胞肺癌;EGFR T790M突变;EGFR TKI;免疫微环境
[Abstract]Background and purpose: Epidermal growth factor receptor exon 20 T790M (EGFR T790M) mutation is one of the acquired resistance mechanisms in non-small cell lung cancer (NSCLC) against first-/second-generation EGFR tyrosine kinase inhibitors (EGFR TKIs). Additionally, EGFR T790M mutation can also be observed in NSCLC patients who have not undergone EGFR TKIs treatment. This study aimed to compare the clinical pathological characteristics and prognostic differences between NSCLC patients with de novo and acquired EGFR T790M mutation, and further explore the immune microenvironment features of acquired T790M mutation in NSCLC. Methods: This study retrospectively included 3 762 cases of NSCLC diagnosed at Fudan University Shanghai Cancer Center from April 2020 to September 2022. Among them, 2 070 cases (55.02%) exhibited EGFR mutations, and 556 cases (14.77%) received EGFR TKIs treatment. Specifically, there were 119 cases (3.16%) of NSCLC with EGFR T790M mutation, including 51 cases (1.35%) of de novo T790M mutation and 68 cases (1.81%) of acquired EGFR T790M mutation. Clinical data of the patients were collected for comparative analysis between NSCLC patients with de novo and acquired T790M mutation. Multiple immunofluorescence histochemistry (mIHC) was employed to explore the immune microenvironment characteristics of NSCLC patients with acquired T790M mutation. Results: The proportion of de novo and acquired T790M mutations was higher in female patients compared to males. Patients with de novo T790M mutation tended to be younger. Both de novo and acquired T790M mutations were more commonly found in poorly differentiated carcinomas. Among NSCLC patients with de novo T790M mutation, there was a higher rate of programmed death ligand-1 (PD-L1) expression (60.00%). In contrast, among NSCLC patients with acquired T790M mutation, the rate of PD-L1 expression was lower (22.39%). Acquired T790M mutation in NSCLC was often accompanied by TP53 alterations (39.7%). Cox regression analysis results indicated that mesenchymal to epithelial transition (MET) factor alteration was a risk factor for the occurrence of acquired T790M mutation (P=0.000 5). The average overall survival (OS) showed no significant difference between de novo and acquired T790M mutations (35.4 and 37.3 months respectively). However, patients with acquired T790M mutation exhibited a higher proportion of recurrence and metastasis. In acquired T790M mutation, there was a higher presence of immune cell infiltration within the stromal compartment, such as CD20+B cells, CD23+ B cells, CD8+ T cells, CD8+PD-1-/+ cells, CD20+PD-1-/+ cells and CD23+PD-1-/+ cells. Additionally, the study found that when EGFR was accompanied by tumor suppressor gene (TSG) alterations, the average distance between tumor cells and CD8+ T cells, CD20+ B cells, CD8+PD-1+ cells, CD20+PD-1+ cells and CD23+PD-1+ cells was closer compared to cases with only EGFR mutations. Conclusion: In comparison to patients with de novo T790M mutation, patients with acquired T790M mutation exhibit a lower rate of PD-L1 positivity. Acquired T790M mutation often accompanies TP53 alterations, and MET alteration is identified as a risk factor triggering acquired T790M mutation. Although patients with acquired T790M mutation face higher risk of recurrence and metastasis, their average OS does not significantly differ from those with de novo T790M mutation. In cases of acquired T790M mutation, the presence of TSG mutations can alter the spatial distribution of immune cells, potentially leading to benefits from immunotherapy.
[Key words] Non-small cell lung cancer; EGFR T790M mutation; EGFR TKI; Immune microenvironment
肺癌是全球发病率及死亡率较高的恶性肿瘤之一[1],包括非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),其中85%为NSCLC,组织学类型包括腺癌、鳞状细胞癌和大细胞癌[2-3]。NSCLC中约60%的病例表达表皮生长因子受体(epidermal growth factor receptor,EGFR),这对肿瘤细胞的增殖、迁移和分化等过程产生影响[4]。
EGFR是一种编码调控细胞生长与分裂蛋白质的基因,是NSCLC治疗的重要靶点[4],EGFR突变可分为经典 [如EGFR 19号外显子缺失突变(EGFR exon 19 deletion,EGFR 19Del)和21号外显子L858R点突变(EGFR exon 21 point mutation,EGFR L858R)]和罕见突变两大类,携带经典EGFR突变的NSCLC患者对EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗具有敏感性[5]。然而,随着治疗时间的推移,NSCLC对第一/二代EGFR TKI产生获得性耐药,EGFR T790M(threonine-to-methionine substitution mutation at position 790,T790M)是其中一种耐药机制,发生在EGFR基因的ATP结合位点,第790位的苏氨酸被蛋氨酸取代[6]。因此,检测T790M突变对于第一/二代EGFR TKI产生耐药性的NSCLC患者至关重要。部分EGFR TKI初治NSCLC患者也可检测到原发性T790M突变,采用奥希替尼治疗也具有疗效[7]。NSCLC中肿瘤细胞程序性死亡受体配体1(programmed death-ligand 1,PD-L1)的表达水平可作为免疫检查点抑制剂(immune-checkpoint inhibitor, ICI)疗效的预测因子[8],但对于携带EGFR突变的患者疗效有限。现有研究表明EGFR TKI可改变肿瘤的免疫微环境[9]影响ICI治疗效果,但具体变化机制尚不明确,因此探讨获得性T790M患者免疫微环境的变化尤为重要。Gueguen等[10]的研究结果显示,CD8+T淋巴细胞是NSCLC良好的预后因素,在肿瘤排斥反应中至关重要,与免疫检查点阻断(immune checkpoint blockade,ICB)的应答相关。Patil等[11]的研究结果表明,B淋巴细胞与PD-L1抑制剂的疗效具有相关。因此我们对获得性T790M突变患者免疫微环境中B淋巴细胞和T淋巴细胞的丰度及携带抑癌基因(tumor suppressor gene,TSG)改变时免疫细胞亚群的空间位置进行分析,探讨这部分患者是否有望从免疫治疗中获益。
本研究重点关注NSCLC中不同T790M突变的临床病理学特征、分子改变、EGFR TKI疗效差异及预后情况。另外,本研究探讨了获得性T790M的免疫微环境特征。特别是携带TSG改变时的免疫微环境变化,以期为实现NSCLC个性化精准治疗提供有力依据。
1 资料和方法
1.1 临床病理学资料
本研究纳入2020年4月—2022年9月于复旦大学附属肿瘤医院就诊的EGFR T790M突变的NSCLC患者119例,其中原发性T790M突变51例,获得性T790M突变68例。119例EGFR T790M突变NSCLC是在3 762例NSCLC中采用QIAamp DNA Mini Kit进行二代基因测序(next generation sequencing, NGS)检出,NGS检测包括68个基因的所有外显子,方法同前所述[12],3 762例NSCLC患者中,有2 070例存在EGFR突变,其中有556例接受EGFR TKI治疗。经统计,119例EGFR T790M突变NSCLC中有56例手术标本,45例组织活检标本及18例液体活检(外周血)标本。采用PD-L1 IHC 22C3 pharmDx检测EGFR T790M突变NSCLC中PD-L1表达水平,方法及评分原则同前所述[12-13]。PD-L1<1%为阴性,PD-L1≥1%为阳性。收集患者的临床病理学资料和生存资料,如性别、年龄、组织学分化、TNM分期及临床分期、PD-L1表达水平及其分子特征等。
1.2 治疗方法及疗效评价
本研究中,68例获得性T790M突变的NSCLC患者曾接受过第一/二代EGFR TKI治疗,其中61例因疾病进展或耐药而换用第三代EGFR TKI。51例原发性T790M患者在未使用EGFR TKI时,分子检测已发现T790M突变。根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1对NSCLC采用EGFR TKI治疗的效果进行评价。
1.3 多重免疫荧光组织化学
本研究采用Opal Multiplex IHC试剂盒对7例获得性T790M样本进行染色,染色方法如前所述[14]。实验中使用了以下抗体:CD8(ab101500)、CD23(ab16702)、程序性死亡受体1(programmed death 1,PD-1)(ab237728)和 pan-CK(ab7753)抗体购自英国Abcam公司,PD-L1(13684S)抗体购自美国Cell Signaling Technology公司,CD20(ZM-0039)抗体购自北京中杉金桥生物技术有限公司。染色后的数字切片通过扫描仪(Vectra Polaris)进行存储,随后采用HALO软件进行免疫细胞亚群比例及空间距离分析。
1.4 随访
无进展生存期(progression-free survival,PFS)定义为首次TKI治疗或后期第三代EGFR TKI治疗开始,直至疾病进展或死亡的时间。总生存期(overall survival,OS)定义为从第三代EGFR TKI治疗开始,到因任何原因导致的死亡时间。随访截止时,对于未进展或死亡的患者,以末次随访日期作为计算依据,单位为月,末次随访日期为2023年10月18日。中位持续缓解时间(median duration of response,MDOR)定义为从开始用EGFR TKI至首次分子检测到EGFR T790M突变的时间差。治疗持续时间(treatment duration,TD)定义为从使用第三代EGFR TKI治疗开始,直至停止用药的这段时间。
1.5 统计学处理
临床病理学特征差异分析采用Pearson卡方检验或Fisher精确检验。采用t检验或Mann-Whitney U检验评估肿瘤和间质中免疫细胞浸润有无差异,并进一步比较EGFR突变和EGFR突变伴随TSG改变对免疫细胞的密度及空间关系有无差异,并采用Benjamini-Hochberg法进行多重比较P值矫正。生存分析采用Kaplan-Meier法,并通过log-rank检验评估各组间生存曲线的差异。为进一步探讨不同特征对获得性EGFR T790M结局事件的影响,本研究采用了单因素Cox回归进行临床病理学基线信息及伴随分子改变对获得性T790M结局事件的影响的逐个分析,筛选与获得性耐药的相关因素。P<0.05为差异有统计学意义。统计学分析使用GraphPad Prism 8.0和R软件进行。
2 结 果
2.1 晚期NSCLC中原发性和获得性T790M突变的临床病理学特征分析
119例T790M突变NSCLC患者,其中晚期患者82例,原发性T790M突变的患者15例(18.29%),获得性T790M突变的患者67例(81.70%)。原发性和获得性T790M突变在女性患者中的比例均高于男性(分别为73.33%>26.67%和58.21%>41.79%)。在晚期T790M突变患者中,中位年龄为63岁(范围39~82岁),原发性T790M突变患者更为年轻(66.67%>33.33%)。获得性T790M突变患者的年龄分布基本一致(47.76%<52.24%)。组织学评估结果显示原发性和获得性T790M突变均更容易出现在组织学分化程度较低的病例中(P=0.026 4),其中原发性T790M突变在手术标本中的占比为40%,获得性T790M突变的手术检出率为19.40%,余下病例则为组织活检或液体活检(P=0.036 5)。在原发性 T790M 突变患者中,PD-L1阳性比例高于阴性比例(60.00%>33.33%);而在获得性T790M突变患者中,大部分病例不表达PD-L1(41.79%>22.39%),差异有统计学意义(P=0.011 0,表1)。
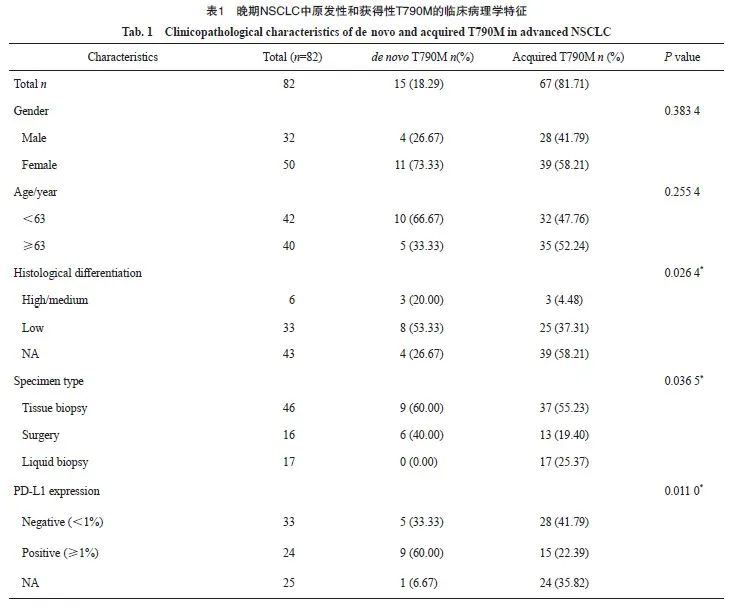
2.2 NSCLC中原发性和获得性T790M突变的伴随分子改变特征
119例T790M突变NSCLC患者中,原发性T790M突变与更多的EGFR L858R突变相关(58.8%>41%,P=0.085 3),而获得性T790M突变与更多的EGFR 19Del突变相关(52.9%>14%,P<0.000 1)。获得性T790M突变伴随TP53改变(39.7%>17.6%)概率大,而原发性T790M突变则伴间质表皮转化因子(mesenchymal to epithelial transition factor,MET)改变的可能性较大(33.3%>13.2%)。原发性和获得性T790M中,常见驱动突变如鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、c-ros肉瘤致癌因子-受体酪氨酸激酶(ROS proto-oncogene 1,receptor tyrosine kinase,ROS1)等差异无统计学意义(图1A)。82例晚期NSCLC中获得性T790M携带EGFR 19Del的比例为52.2%,而原发性T790M中仅为13.3%(P=0.008 6);原发性T790M中携带EGFR L858R的比例略高于获得性T790M(60.0%>41.8%);晚期NSCLC中原发性和获得性T790M突变中TP53改变的比例基本一致(40.0%>38.8%,图1B)。我们对临床病理学基线信息及伴随分子改变进行单因素Cox回归分析,结果表明,伴有MET改变是出现获得性T90M的危险因素(P=0.000 5),而性别、年龄、组织学分化、EGFR 19Del、EGFR L858R、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)、PD-L1、视网膜母细胞瘤蛋白(retinoblastoma protein,RB1)、TP53、MYC转录因子(myelocytomatosis,MYC)和Smad蛋白4(drosophila mothers against decapentaplegic protein 4,SMAD4)等并无影响(图1C)。晚期NSCLC中获得性T790M患者使用EGFR TKI的中位持续缓解时间为21.5个月,其95% CI为17.4~26.4个月(图1D)。
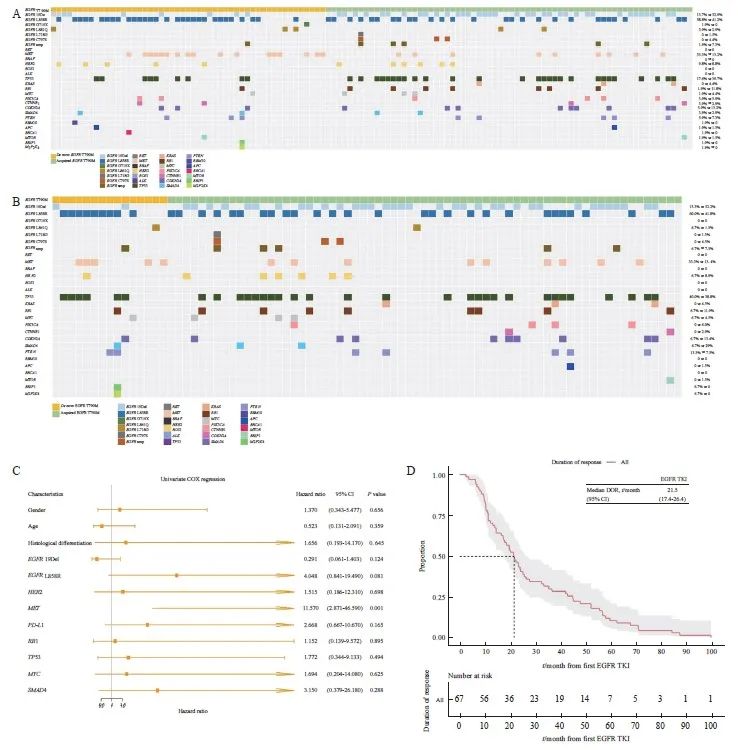
图1 NSCLC中原发性和获得性T790M的伴随分子改变特征
Fig. 1 Characterization of concurrent molecular alterations of de novo and acquired T790M in NSCLC
A: Characterization of concurrent molecular alterations of de novo and acquired T790M in NSCLC; B: Characterization of concurrent molecular alterations of de novo and acquired T790M in advanced NSCLC; C: Forest plot of univarite Cox regression analysis in advanced NSCLC-acquired T790M; D: Median duration of remission of EGFR-TKI for acquired T790M mutation in advanced NSCLC.
2.3 晚期NSCLC原发性和获得性T790M使用第三代EGFR TKI及预后分析
本研究对70例晚期T790M突变NSCLC进行疗效评估,其中包括9例原发性T790M突变,61例为获得性T790M突变。原发性T790M疾病进展(progressive disease,PD)比例为55.56%,获得性T790M中PD为63.93%,两者在使用第三代EGFR TKI的疗效差异无统计学意义(图2A、B)。为进一步分析EGFR 19Del、EGFR L858R和TP53改变在原发性和获得性T790M突变中的差异,我们将获得性T790M突变的患者根据疗效分为PD组(n=43)和非PD(non-PD)组(n=23)。结果显示,获得性T790M突变患者使用第三代EGFR TKI的疗效并未受到伴随分子改变的影响(P=1.000 0、P=0.682 4和P=0.528 2,表2)。对晚期NSCLC中原发性和获得性T790M突变患者的TD、PFS和OS进行了统计学分析,结果显示原发性T790M突变患者的中位TD为14.2个月,中位PFS为12.3个月;获得性T790M突变患者的中位TD为13.8个月,中位PFS为12个月,原发性和获得性T790M突变的PFS中位值均短于TD(图2C~F)。在晚期 NSCLC 患者中,原发性T790M的OS略优于获得性T790M(P=0.53,图2G)。进一步比较原发性和获得性T790M突变的平均OS,原发性T790M患者的平均OS为21.5个月,获得性T790M患者的平均OS为23.6个月,两者之间差异无统计学意义。同时,我们发现获得性T790M较原发性T790M更容易出现复发和转移(34.33%>20%;97.01%>86.67%,图2H~K)。
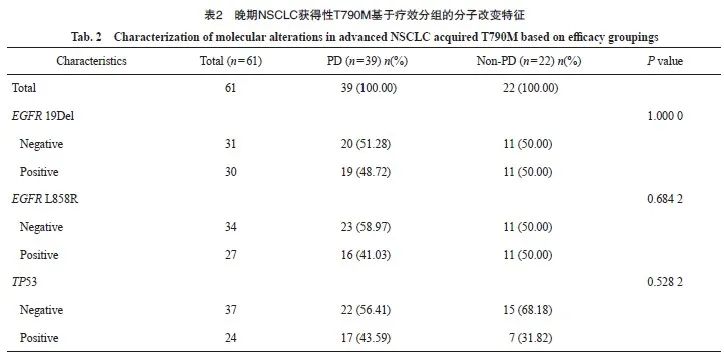
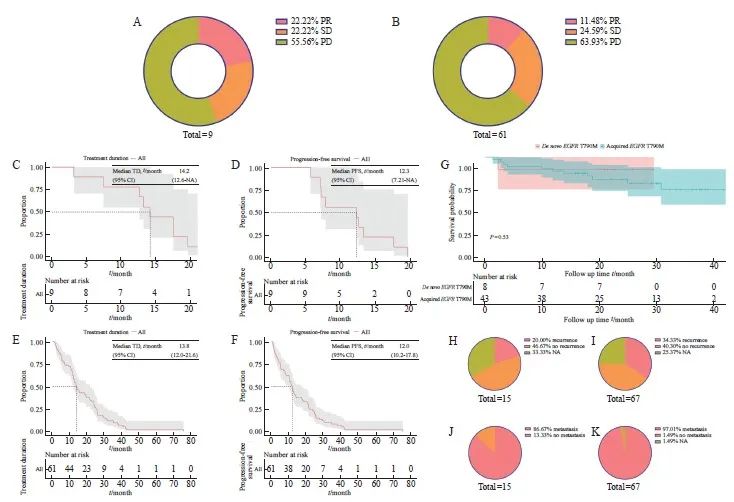
图2 NSCLC原发性和获得性T790M使用第三代EGFR TKI及预后分析
Fig. 2 The comparison between de novo and acquired T790M mutations in NSCLC concerning the utilization of third-generation EGFR TKI and subsequent prognostic analysis
A: Efficacy of de novo T790M mutations in advanced NSCLC using third-generation EGFR TKI; B: Efficacy of acquired T790M mutations in advanced NSCLC using third-generation EGFR TKI; C-D: Median TD and median PFS of de novo T790M in advanced NSCLC; E-F: Median TD and median PFS of acquired T790M in advanced NSCLC; G: Survival curves for de novo and acquired T790M in advanced NSCLC; H-I: Proportion of de novo and acquired T790M recurrences; J-K: Proportion of de novo and acquired T790M metastases.
2.4 EGFR TKI治疗后获得性T790M的免疫细胞亚群特征
为探讨获得性T790M的免疫微环境特征,进一步揭示TKI治疗后的患者是否能从免疫治疗中获益做出初步探索,基于已有文献报道,我们选取了CD8、CD20、CD23、PD-1、PD-L1的免疫相关指标进行评估,对肿瘤和间质区域的免疫细胞密度进行统计分析。研究结果显示肿瘤组织中的PD-1+细胞及PD-L1+细胞数量较间质区域更为丰富。相反,间质中CD20+B淋巴细胞、CD23+B淋巴细胞、CD8+T淋巴细胞、CD8+PD-1-/+细胞、CD20+PD-1-/+细胞及CD23+PD-1-/+细胞群体更为密集(图3A)。我们进一步将获得性T790M分为两组:携带EGFR致敏突变(EGFR 19Del和EGFR L858R)组和伴有TSG共突变组,比较这两组患者免疫微环境的差异。计算整个癌巢中各类免疫细胞亚群的细胞密度(阳性细胞个数 /总面积)。结果表明,携带TSG突变时CD8+T淋巴细胞的密度较少(P<0.05),CD8+PD-1-/+细胞密度同样较少。CD20+B淋巴细胞、CD23+B淋巴细胞和PD-1+免疫细胞在携带TSG突变组中密度较高,但差异不显著;进一步比较二者CD20+PD-1-/+和CD23+PD-1-/+4种免疫细胞亚群的差异,未发现明显区别(图3H~Q)。
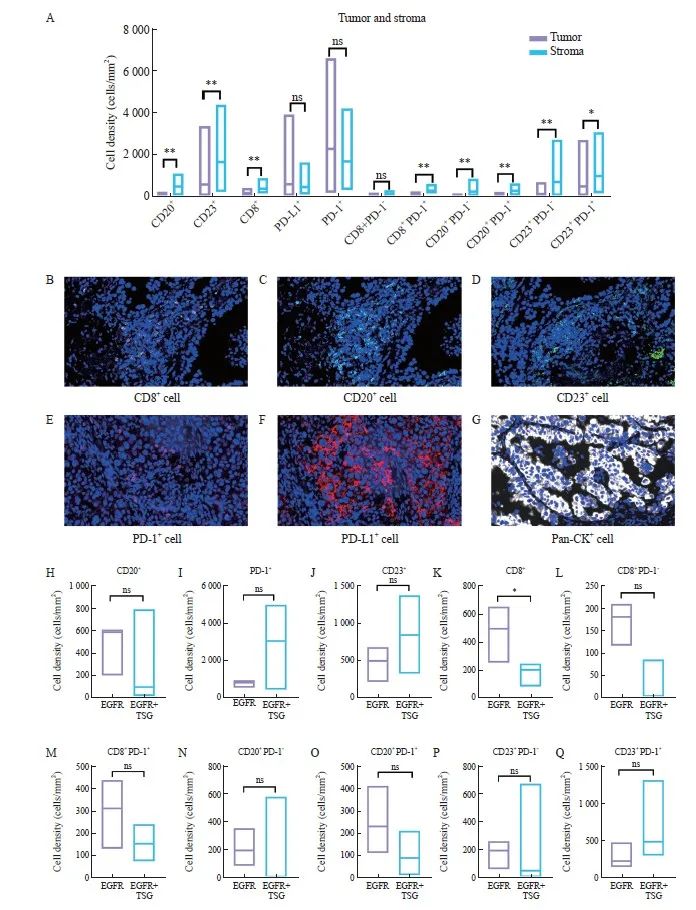
图3 获得性T790M中免疫细胞亚群特征
Fig. 3 Characterization of immune cell subpopulations in acquired T790M
A: Comparison of immune cell density in tumor and stromal regions in acquired T790M; B-G: Schematic representation of multiple immunofluorescence histochemical expression; H-Q: Comparison of immune cell density between EGFR with tumor suppressor mutations and EGFR mutations alone.
2.5 EGFR TKI治疗后获得性T790M的免疫细胞空间分布特征
为进一步探究获得性T790M突变患者中携带TSG突变时免疫细胞亚群在肿瘤微环境中的空间分布特征,我们比较了肿瘤细胞与各类免疫细胞的平均距离(average distance)和癌巢边缘200 μm范围内的各个免疫细胞浸润密度(average density)。结果表明携带TSG突变时(EGFR+TSG),CD8+T淋巴细胞(P<0.001)与肿瘤细胞更加接近,而CD20+B淋巴细胞、CD23+B淋巴细胞和PD-1+细胞群与肿瘤细胞也相对较近,尽管差异不显著。我们进一步比较CD8+PD-1-/+、CD20+PD-1-/+和CD23+PD-1-/+免疫细胞亚群和肿瘤细胞的平均距离,结果表明携带TSG突变的获得性T790M病例与这些免疫细胞亚群的距离均较单纯EGFR突变病例更近。在癌巢边缘200 μm范围内免疫细胞浸润密度方面,携带TSG突变时CD20+B淋巴细胞、CD8+T淋巴细胞、CD8+PD-1-/+细胞和CD20+PD-1+细胞的免疫浸润水平较低,而PD-1+细胞、CD23+B淋巴细胞和CD23+PD-1+细胞免疫浸润水平较高,差异均无统计学意义(图4)。
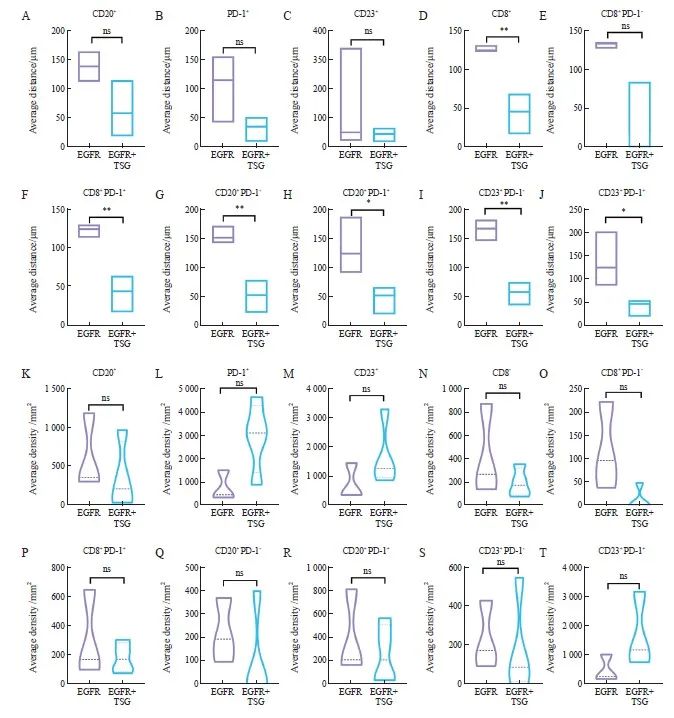
图4 EGFR TKI治疗后获得性T790M的免疫细胞空间分布特征
Fig. 4 Characterization of spatial distribution of immune cells in acquired T790M after treatment with EGFR TKI
A-J: Comparison of the average distance between tumor cells and immune cells in 2 groups, EGFR with tumor suppressor gene mutations and EGFR mutations alone; K-T: Comparative assessment of immune cell infiltration density within a 200 μm radius at the peripheries of cancer nests between the EGFR with tumor suppressor gene mutation and EGFR mutation alone cohorts.
3 讨 论
EGFR突变是NSCLC中关键的分子改变之一,这部分患者可能对EGFR TKI产生良好反应[15]。EGFR TKI在携带EGFR敏感突变的晚期NSCLC患者中表现出较好的治疗应答率,相较于传统化疗方法,EGFR TKI可显著提升患者的PFS和总体缓解率(objective response rate,ORR),从而带来显著的疗效优势[16]。然而,绝大多数患者在EGFR TKI治疗过程中会出现继发性耐药。其中,约50%的EGFR突变患者会出现获得性T790M突变[17],部分患者在初始治疗阶段即存在原发性T790M突变[18]。本研究采用回顾性方法,对比分析原发性和获得性T790M突变的临床病理学特征及相应的分子特征,揭示获得性T790M突变在EGFR TKI治疗后的免疫微环境特点,同时探讨了伴随TSG突变时免疫微环境的特 征。
现有研究表明,原发性和获得性T790M突变与性别、年龄无显著关联[19]。然而,本研究观察到T790M突变在女性患者中更为常见,且原发性突变相较获得性突变更为年轻化。本研究发现T790M突变NSCLC的组织学常分化差。此外,研究表明PD-L1的表达水平是动态变化的,并受EGFR TKI的影响[19]。本研究显示原发性T790M突变有很大比例的患者存在PD-L1表达(60.00%>33.33%);免疫微环境分析表明,获得性T790M中PD-L1+细胞密度较高,提示免疫治疗可能对T790M突变的治疗具有积极作用。已有研究指出,EGFR信号转导通路激活有助于诱导PD-L1表达,而在体外使用EGFR TKI后会导致PD-L1表达降低。这为确定免疫疗法与EGFR TKI联合应用的适宜人群提供了依据[20]。T790M常与EGFR致敏突变共存,我们的结果显示,原发性T790M突变常伴随EGFR L858R改变,获得性T790M突变则常与EGFR 19Del改变相伴,这一发现与先前的研究[19]一致。获得性T790M突变携带TP53改变的可能性较高(39.7% >17.6%),已有研究证实,TP53改变会加速EGFR突变的耐药发展[21]。单因素Cox回归分析显示,MET改变是晚期NSCLC中获得性T790M突变的一个危险因素。先前研究指出,T790M突变与MET改变的共存可能导致 NSCLC患者更容易产生获得性耐药,因而预后更差[22],这为NSCLC的靶向治疗方案调整提供了有益的参考。疗效分析表明,晚期NSCLC中原发性和获得性T790M突变的患者对第三代EGFR TKI治疗均有响应[7]。
我们对使用第三代EGFR TKI的原发性和获得性T790M突变的晚期NSCLC患者进行预后分析,结果显示,T790M的PFS往往短于TD,部分患者在出现再次耐药时未能及时发现。因此,精确识别这一时间节点对于确定获得性T790M的发生至关重要。NGS能够揭示获得性T790M对第三代EGFR TKI耐药的分子机制,如C797S突变、T790M丢失及 MET改变等[23],这将有助于改善晚期NSCLC患者的预后。值得注意的是,我们的研究发现原发性和获得性T790M突变患者的OS差异无统计学意义,这与先前的研究[19]结果有所不同,这一差异可能归因于部分病例的随访时间较短,从而未能更真实地反映OS的差别。此外,本研究发现获得性T790M复发转移的情况较原发性更为常见。因此,识别获得性T790M的免疫微环境特征尤为重要。
获得性T790M突变的免疫微环境中,CD20+B淋巴细胞、CD23+B淋巴细胞、CD8+T淋巴细胞密度较高,这表明他们可能从免疫治疗中受益[24]。我们进一步对比伴有TSG改变和单纯EGFR突变的获得性T790M的免疫微环境特征,结果表明与单纯EGFR突变相比,EGFR伴有TSG改变时,肿瘤细胞与CD8+T淋巴细胞、CD20+B淋巴细胞等免疫细胞亚群的平均距离更近。然而,免疫细胞亚群密度及瘤床周边 200 μm范围内免疫细胞浸润密度在这两组中无明显区别。研究表明,伴有TSG改变的EGFR突变NSCLC患者总生存期较短,且对EGFR TKI治疗的反应较差[21, 25- 26];TP53突变可增加肿瘤间质的 CD8+T淋巴细胞密度,而EGFR突变时肿瘤实质中CD8+T淋巴细胞密度较低。然而,EGFR和TP53共突变对CD8+T淋巴细胞总密度的影响不大[27]。目前,关于EGFR与TSG共突变对NSCLC免疫治疗影响的研究不多。本研究揭示了获得性T790M患者免疫微环境的部分特征,肿瘤组织与间质区域在免疫细胞分布上存在差异,且EGFR突变与TSG共突变和单纯EGFR突变的免疫微环境具有一定的差异性。EGFR与TSG共突变可能通过减小肿瘤细胞与免疫细胞的平均距离来提高免疫治疗的效果,然而,这一发现仍需进一步研究验证。总之,本研究为NSCLC患者的免疫治疗策略提供了有益的启示,有助于优化治疗方案并改善患者预后。
本研究虽取得一定成果,但仍存在一些不足之处。首先,在回顾性研究中,T790M的检测方法存在差异,部分患者伴随的分子改变也许未能精确识别。其次,本研究纳入的样本量相对较小,导致在分析晚期NSCLC患者时,原发性T790M病例较少,可能产生选择偏倚。未来研究可进一步扩大病例数以减少潜在偏差。此外,本研究中观察到T790M突变患者接受第三代EGFR TKI治疗后PR患者比例较以往研究偏低,可能是由于经济条件等其他因素,并非所有患者严格遵守奥希替尼治疗疗程,及纳入的病例较以往研究少,可能存在一定的样本偏倚,因此对第三代EGFR TKI疗效比较产生影响。最后,本研究初步描绘了获得性T790M中的免疫微环境特征,并分析了伴有TSG改变的EGFR突变与单纯EGFR突变的免疫微环境差异。然而,由于病例数有限,可能存在一定偏差。今后研究需进一步探讨潜在机制,以期为NSCLC治疗提供更有力的依据。
总之,我们的研究表明,T790M突变更倾向出现在差分化NSCLC中。原发性T790M突变常伴随EGFR L858R,而获得性T790M常与EGFR 19Del共存。此外,我们发现获得性T790M突变可能更容易伴随TP53改变,MET改变是获得性T790M出现的危险因素。动态监测EGFR分子改变的最佳时间点对调整晚期NSCLC的治疗策略具有重要作用。携带TSG改变的获得性T790M中可以改变免疫细胞的空间分布进而从免疫治疗中获益。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
林艺聪:收集和分析数据及撰写论文;王悦和薛倩倩:文献调研与整理;郑强:分析数据;金燕和黄子凌:实验数据校对;李媛:修订、审核论文及资金支持。
[参考文献]
[1]SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA A Cancer J Clin, 2021, 71(1): 7-33.
[2]DUMA N, SANTANA-DAVILA R, MOLINA J R. Non-small cell lung cancer: epidemiology, screening, diagnosis, and treatment[J]. Mayo Clin Proc, 2019, 94(8): 1623-1640.
[3]MILLER M, HANNA N. Advances in systemic therapy for non-small cell lung cancer[J]. BMJ, 2021, 375: n2363.
[4]DA CUNHA SANTOS G, SHEPHERD F A, TSAO M S. EGFR mutations and lung cancer[J]. Annu Rev Pathol, 2011, 6: 49-69.
[5]HARRISON P T, VYSE S, HUANG P H. Rare epidermal growth factor receptor (EGFR) mutations in non-small cell lung cancer[J]. Semin Cancer Biol, 2020, 61: 167-179.
[6] LIM S M, SYN N L, CHO B C, et al. Acquired resistance to EGFR targeted therapy in non-small cell lung cancer: mechanisms and therapeutic strategies[J]. Cancer Treat Rev, 2018, 65: 1-10.
[7] LI W H, QIU T, GUO L, et al. Primary and acquired EGFRT790M-mutant NSCLC patients identified by routine mutation testing show different characteristics but may both respond to osimertinib treatment[J]. Cancer Lett, 2018, 423: 9-15.
[8] RIZVI N A, HELLMANN M D, SNYDER A, et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348(6230): 124-128.
[9] ISOMOTO K, HARATANI K, HAYASHI H, et al. Impact of EGFR-TKI treatment on the tumor immune microenvironment in EGFR mutation-positive non-small cell lung cancer[J]. Clin Cancer Res, 2020, 26(8): 2037-2046.
[10] GUEGUEN P, METOIKIDOU C, DUPIC T, et al. Contribution of resident and circulating precursors to tumor-infiltrating CD8+ T cell populations in lung cancer[J]. Sci Immunol, 2021, 6(55): eabd5778.
[11] PATIL N S, NABET B Y, MÜLLER S, et al. Intratumoral plasma cells predict outcomes to PD-L1 blockade in non-small cell lung cancer[J]. Cancer Cell, 2022, 40(3): 289-300.e4.
[12] JIN Y, XUE Q Q, SHEN X X, et al. PD-L1 expression and comprehensive molecular profiling predict survival in non-small cell lung cancer: a real-world study of a large Chinese cohort[J]. Clin Lung Cancer, 2022, 23(1): 43-51.
[13] ZHENG Q, HUANG Y, ZENG X, et al. Clinicopathological and molecular characteristics associated with PD-L1 expression in non-small cell lung cancer: a large-scale, multi-center, realworldstudy in China[J]. J Cancer Res Clin Oncol, 2021, 147(5): 1547-1556.
[14] WANG X, HUI S, TAN C, et al. Comprehensive analysis of immune subtypes reveals the prognostic value of cytotoxicity and FAP+ fibroblasts in stomach adenocarcinoma[J]. Cancer Immunol Immunother, 2023, 72(6): 1763-1778.
[15] CHEN Z, FILLMORE C M, HAMMERMAN P S, et al. Nonsmall cell lung cancers: a heterogeneous set of diseases[J]. Nat Rev Cancer, 2014, 14(8): 535-546.
[16] GELATTI A C Z, DRILON A, SANTINI F C. Optimizing the sequencing of tyrosine kinase inhibitors (TKIs) in epidermal growth factor receptor (EGFR) mutation-positive non-small cell lung cancer (NSCLC)[J]. Lung Cancer, 2019, 137: 113-122.
[17] NEEL D S, BIVONA T G. Resistance is futile: overcoming resistance to targeted therapies in lung adenocarcinoma[J]. NPJ Precis Oncol, 2017, 1: 3.
[18] DENIS M G, VALLÉE A, THÉOLEYRE S. EGFR T790M resistance mutation in non small-cell lung carcinoma[J]. Clin Chim Acta, 2015, 444: 81-85.
[19] WANG S Y , YAN B, ZHANG Y W, et al. Different characteristics and survival in non-small cell lung cancer patients with primary and acquired EGFR T790M mutation[J]. Int J Cancer, 2019, 144(11): 2880-2886.
[20] AKBAY E A, KOYAMA S, CARRETERO J, et al. Activation of the PD-1 pathway contributes to immune escape in EGFRdriven lung tumors[J]. Cancer Discov, 2013, 3(12): 1355-1363.
[21] VOKES N I, CHAMBERS E, NGUYEN T, et al. Concurrent TP53 mutations facilitate resistance evolution in EGFR-mutant lung adenocarcinoma[J]. J Thorac Oncol, 2022, 17(6): 779-792.
[22] GOU L Y, LI A N, YANG J J, et al. The coexistence of MET over-expression and an EGFR T790M mutation is related to acquired resistance to EGFR tyrosine kinase inhibitors in advanced non-small cell lung cancer[J]. Oncotarget, 2016, 7(32): 51311-51319.
[23] ZALAQUETT Z, CATHERINE RITA HACHEM M, KASSIS Y, et al. Acquired resistance mechanisms to osimertinib: the constant battle[J]. Cancer Treat Rev, 2023, 116: 102557.
[24] BRUNO T C. New predictors for immunotherapy responses sharpen our view of the tumor microenvironment[J]. Nature, 2020, 577(7791): 474-476.
[25] HOU H L, QIN K, LIANG Y, et al. Concurrent TP53 mutations predict poor outcomes of EGFR-TKI treatments in Chinese patients with advanced NSCLC[J]. Cancer Manag Res, 2019, 11: 5665-5675.
[26] OFFIN M, CHAN J M, TENET M, et al. Concurrent RB1 and TP53 alterations define a subset of EGFR-mutant lung cancers at risk for histologic transformation and inferior clinical outcomes[J]. J Thorac Oncol, 2019, 14(10): 1784-1793.
[27] BITON J, MANSUET-LUPO A, PÉCUCHET N, et al. TP53, STK11, and EGFR mutations predict tumor immune profile and the response to anti-PD-1 in lung adenocarcinoma[J]. Clin Cancer Res, 2018, 24(22): 5710-5723.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#非小细胞肺癌# #免疫微环境# #EGFR TKI# #EGFR T790M突变#
12