切断能量、切断氧气、切断营养“饿死癌细胞”的正确打开方式
2019-09-03 佚名 美中嘉和
早在公元前5000年,人类就发现了最古老的癌症病例。此后的时间内,人类一直在与癌症漫长的争斗。目前,针对癌症的治疗已经不仅仅局限于常规的手术、化疗、放疗,越来越多的研究涉及到激素、微生物、昼夜节奏以及肿瘤微环境等诸多领域,致力于方方面面瓦解肿瘤;而在这其中,“饿死癌细胞”最引人关注。
“饿死癌细胞”并不是指通过减少食物摄入的方式来阻断癌细胞的生存基础。虽然减少食物摄入的本身可以饿死癌细胞,但与此同时,正常的健康细胞也会被饿死。这是一个得不偿失的行为,只能更多地造成患者自身的营养不良,以致在后续的治疗中无法耐受副作用,甚至放弃治疗。
那么,什么才是真正的“饿死癌细胞”,“饿死癌细胞”的正确打开方式又是什么?
想要真正实现“饿死癌细胞”,人们需要正确认识到肿瘤细胞与健康细胞之间存在的差异。
不同于健康细胞的能量产生来源、氧气和营养通道以及代谢形式,是“饿死癌细胞”的正确打开方式。
核仁增大是癌症的一个特殊标志,它的大小一直以来都被用于衡量癌症的进展情况。
临床试验显示,与卡铂+紫杉醇相比,贝伐珠单抗的加入可以将患者的总生存期提高至2年以上。
肿瘤细胞的代谢可能依赖于某些特定的营养物质,例如甘露糖和蛋氨酸等氨基酸。
切断能量
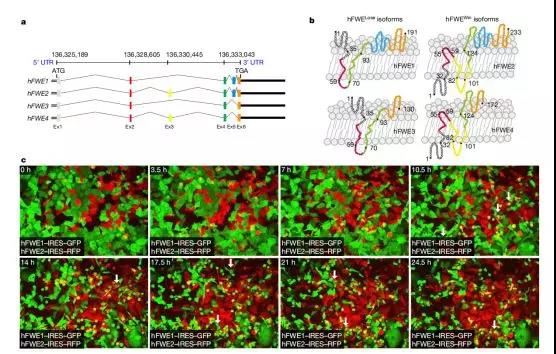
肿瘤细胞具有独特的细胞核。
透过显微镜可以看到,肿瘤细胞和健康细胞的形态完全不同,尤其是细胞核。与健康细胞相比,肿瘤细胞的细胞核通常更大,核仁增大明显,并且呈现出了不规则的形状。
核仁增大是癌症的一个特殊标志,它的大小一直以来都被用于衡量癌症的进展情况。增大的核仁可以导致核糖体的显着增加,推动蛋白质的合成,以及肿瘤细胞的大规模产生。
也就是说,这种不同于健康细胞的独特细胞核,是肿瘤细胞的能量产生来源,也是肿瘤细胞迅速生长增殖的重要原因之一。如果可以阻断肿瘤细胞的能量产生来源,就可以实现“饿死癌细胞”的目的。
一项研究发现,在可用于细胞生长的所有类型的能量中,GTP在核糖体增加中起着最重要的作用,与肿瘤细胞的核仁增大有关。而肿瘤细胞中次黄嘌呤核苷酸脱氢酶(IMPDH)水平的升高,加速了GTP的产生,从而促进了核仁的生长。
通过药理学的手段抑制IMPDH的活性,可以明显减少胶质母细胞瘤小鼠模型的肿瘤形成以及进展。
切断氧气
肿瘤细胞具有独特的血管供给形式。
与健康细胞一样的是,肿瘤细胞也需要营养和氧气来维持生命,并排出代谢废物和二氧化碳。在这一过程中,就需要生成血管来满足这些基本的“生存需求”。
在肿瘤进展期间,“血管生成开关”一直处于激活状态并保持开启,源源不断地萌芽新的血管,维持肿瘤细胞的生长。
也就是说,这种不同于健康细胞的独特血管供给形式,是肿瘤细胞保持基本生存需求的前提。如果可以阻断肿瘤细胞的营养和氧气通道,就可以实现“饿死癌细胞”的目的。
目前,针对肿瘤细胞血管生成的特征,已经开发出以贝伐珠单抗为代表的广泛使用的VEGF靶向药物。
一项纳入276例中国晚期或复发的非鳞状非小细胞肺癌患者的随机、双盲、多中心、安慰剂对照的III期临床试验,旨在探索贝伐珠单抗的效果。结果显示,与卡铂+紫杉醇相比,贝伐珠单抗的加入可以将患者的总生存期提高至2年以上。
可以说,贝伐珠单抗是“饿死癌细胞”的第一个成功应用。
切断某种特定的营养物质
肿瘤细胞具有独特的代谢形式。
与健康细胞不同的是,肿瘤细胞的代谢可能依赖于某些特定的营养物质,例如糖类以及氨基酸。
糖类
对于“饿死癌细胞“,葡萄糖并不能胜任。虽然,肿瘤细胞善于利用葡萄糖作为生命活动的燃料,但是,人体内所有的正常健康细胞也需要葡萄糖。
也就是说,从饮食中去除葡萄糖的摄入,来帮助阻止癌症的生长或是发展,并不是明智的选择。
一项发表在《Nature》上的最新研究发现,在不影响正常组织的前提下,甘露糖能够干扰肿瘤细胞的能量供给,减缓小鼠肿瘤的生长。
甘露糖的加入,可以明显抑制肿瘤细胞的生长。
氨基酸
广泛存在于红肉中的独特氨基酸——蛋氨酸,也可以减缓小鼠肿瘤的生长。
无论试验的目的是治疗还是预防,限制蛋氨酸的摄入都可以抑制结直肠肿瘤的生长。
写在最后
关于“饿死癌细胞“,研究一直在继续。
人们战胜癌症的基础,一定是基于这个疾病的全面认识。知己知彼,才能百战不殆。
需要再次提醒的是,无论是治疗方案的选择,还是摄入营养物质的类型,都一定要与主治医生进行详细的沟通,并获得主治医生的同意。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#饿死癌细胞#
29
#癌细胞#
20