EMBO Mol Med:靶向LRP8诱导肿瘤细胞铁死亡提供神经母细胞瘤新思路
2023-08-08 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
研究发现高危MYCN扩增的神经母细胞瘤对低密度脂蛋白受体相关蛋白8(LRP8)高度依赖,确定LRP8是硒/硒半胱氨酸代谢的关键因子。
铁死亡是一种独特的细胞死亡形式,目前已是科学家们寻找治疗难治性实体瘤的潜在新药的方向之一,例如硒蛋白谷胱甘肽过氧化物酶4 (GPX4)就是潜在靶点。然而,由于缺乏合适的抑制剂和潜在的全身毒性,抑制硒蛋白谷胱甘肽过氧化物酶4 (GPX4)仍然具有挑战性。之前的研究结果表明,高危MYCN扩增的神经母细胞瘤具有显著的GPX4依赖性,但导致这种现象的确切因素仍不完全清楚。
近日,由 Hamed Alborzinia、Andreas Trumpp 和 José Pedro Friedmann Angeli 团队发表于 EMBO Molecular Medicine 的题为 LRP8-mediated selenocysteine uptake is a targetable vulnerability in MYCN-amplified neuroblastoma 的文章, 发现高危MYCN扩增的神经母细胞瘤对低密度脂蛋白受体相关蛋白8(LRP8)高度依赖,确定LRP8是硒/硒半胱氨酸代谢的关键因子。可通过抑制LRP8,诱导癌细胞铁死亡的发生,为神经母细胞瘤及一系列儿科恶性肿瘤和MYCN驱动的癌症提供了新的治疗靶点。

首先,研究人员使用CRISPR筛选新的铁死亡负调控因子。在转录组学结果中,过表达LRP8得分最高;而在scCRISPRa筛选中,GPX4过表达表型得分最高,两者结果得到了相互印证。

图1 全基因组CRISPR激活筛选鉴定铁死亡的负调控因子
其次,研究团队通过实验观察到了LRP8过表达对细胞铁死亡的保护作用。LRP8过表达导致GPX4蛋白水平上调。在GPX4抑制剂处理的细胞中,LRP8过表达抑制了脂质过氧化。此外,LRP8的过表达能够在更大的细胞系面板中增加细胞铁死亡抗性。
接着,研究人员探索了LRP8保护细胞免于铁死亡的机制。实验为LRP8、硒代半胱氨酸、GPX4和细胞存活之间的直接联系提供了强有力的证据。另外,只有野生型(WT)和内源性GPX4的水平因LRP8缺乏而降低,而绕过了硒代半胱氨酸负载tRNA进行高效翻译的异位野生型GPX4 (U46C)保持不变。这一现象与LRP8过表达导致GPX4在蛋白水平上调而不影响RNA水平的发现一致,指向潜在的转录后调控。因此,通过LRP8靶向调控SELENOP的摄取是一种破坏GPX4并触发铁死亡的有效策略。
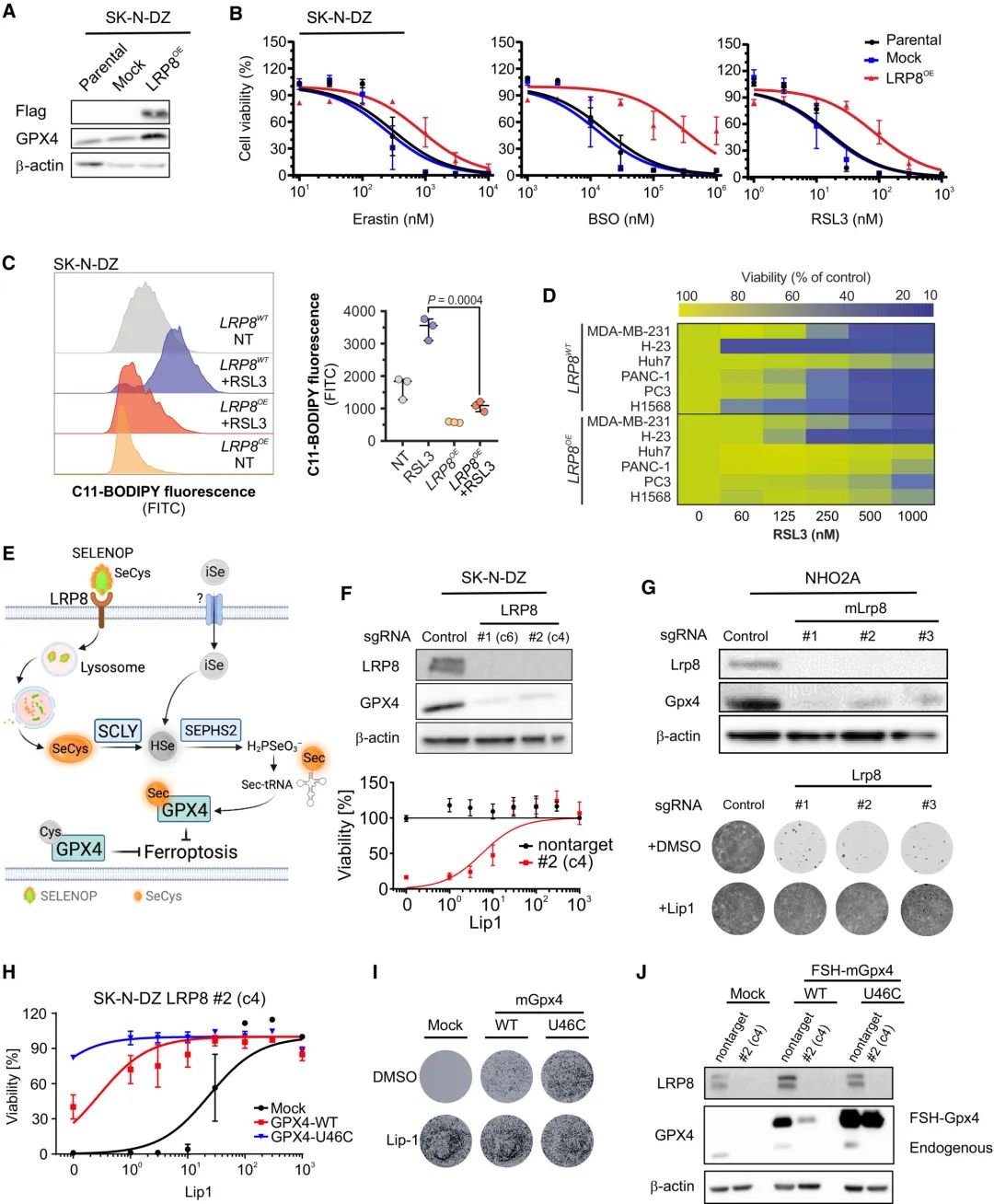
图2 LRP8过表达导致GPX4蛋白水平上调,硒代半胱氨酸代谢的调节可能是LRP8保护细胞免于铁凋亡的机制
此外,与其他实体的癌组织和细胞系相比,神经母细胞瘤的System Xcˉ亚单位(SLC7A11和SLC3A2)表达降低,这表明神经母细胞瘤对LRP8缺失的强敏感性和依赖性很可能是替代硒转运体活性降低,System Xcˉ限制细胞内无机硒摄取导致的。公开数据表明,在神经母细胞瘤中,LRP8依赖性与SLC7A11表达呈负相关,LRP8敲除敏感细胞系表现出较低的SLC7A11表达水平,而GPX4没有观察到这一点。实验数据表明,SLC7A11过表达能够恢复GPX4水平,并部分恢复LRP8缺陷细胞的生存能力,为SLC7A11低表达有助于LRP8依赖性增加的假设提供了支持。然而,仍可发现SLC7A11过表达导致神经母细胞瘤细胞的深度生长缺陷。
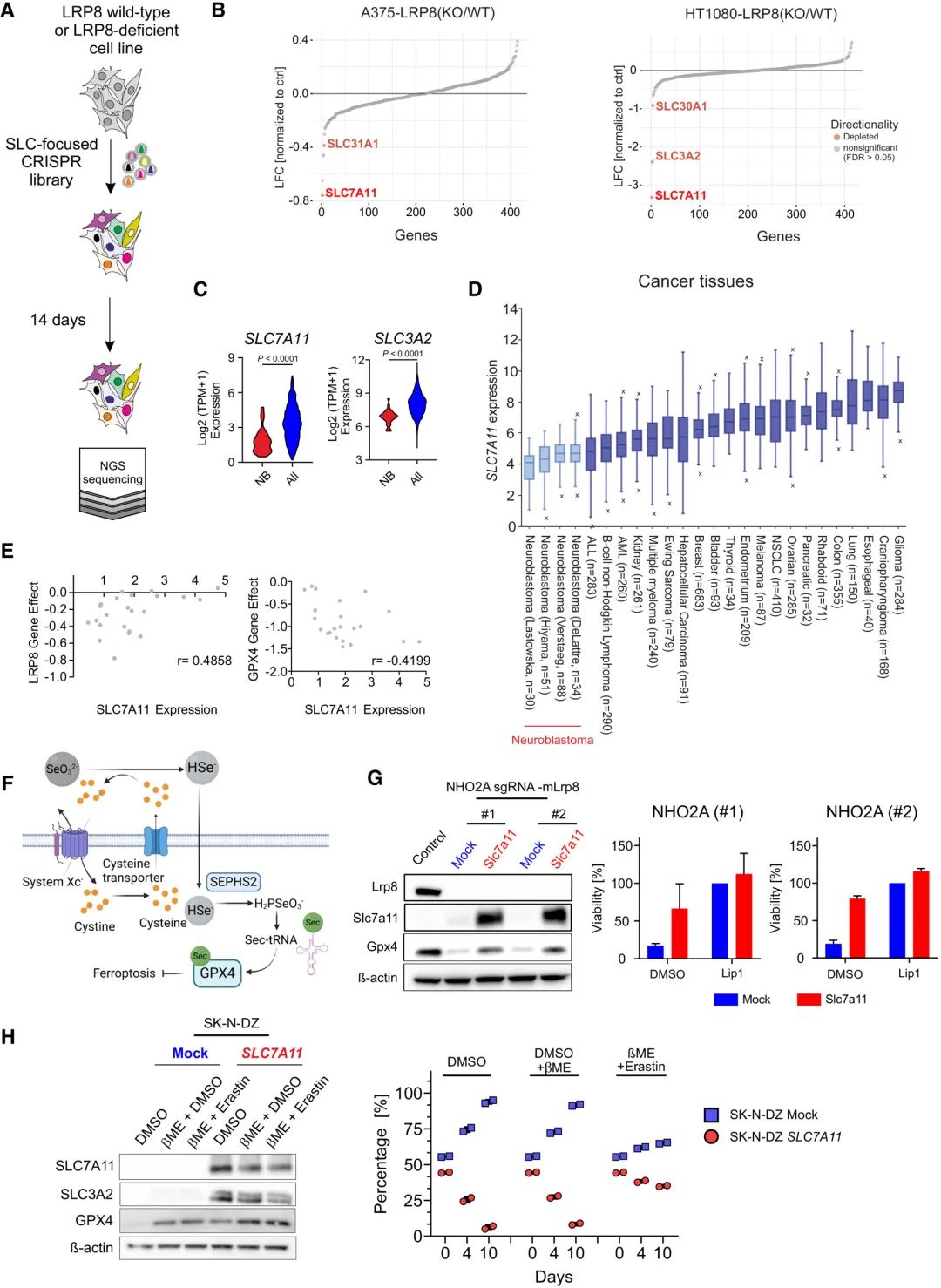
图3 LRP8敲除敏感细胞系表现出较低的SLC7A11表达水平;SLC7A11过表达能够恢复GPX4水平,并部分恢复LRP8缺陷细胞的生存能力
最后,团队研究了LRP8的缺失是否可以通过体内诱导铁死亡,靶向抑制神经母细胞瘤的生长。实验发现,与LRP8 proficient组相比,LRP8缺失组肿瘤生长显著减缓,小鼠的总生存期显著增加。
更有临床意义的是,研究团队探索了靶向LRP8在已建立的SK-N-DZ神经母细胞瘤中的治疗潜力。三组对比分析显示,尽管Lip-1对铁死亡具有抑制作用,但两个LRP8缺陷的异种移植组(蓝色、黄色)与WT对照组(红色)相比,肿瘤生长均受到抑制。重要的是,在随机LRP8KO组中,仅停用Lip-1 9天就已经显著减少了神经母细胞瘤的生长,这与临床情况相似。上述结果支持了LRP8对MYCN扩增的SK-N-DZ神经母细胞瘤可以预防铁死亡的观点。LRP8KO肿瘤中GPX4蛋白的强烈缺失进一步印证了这一点。
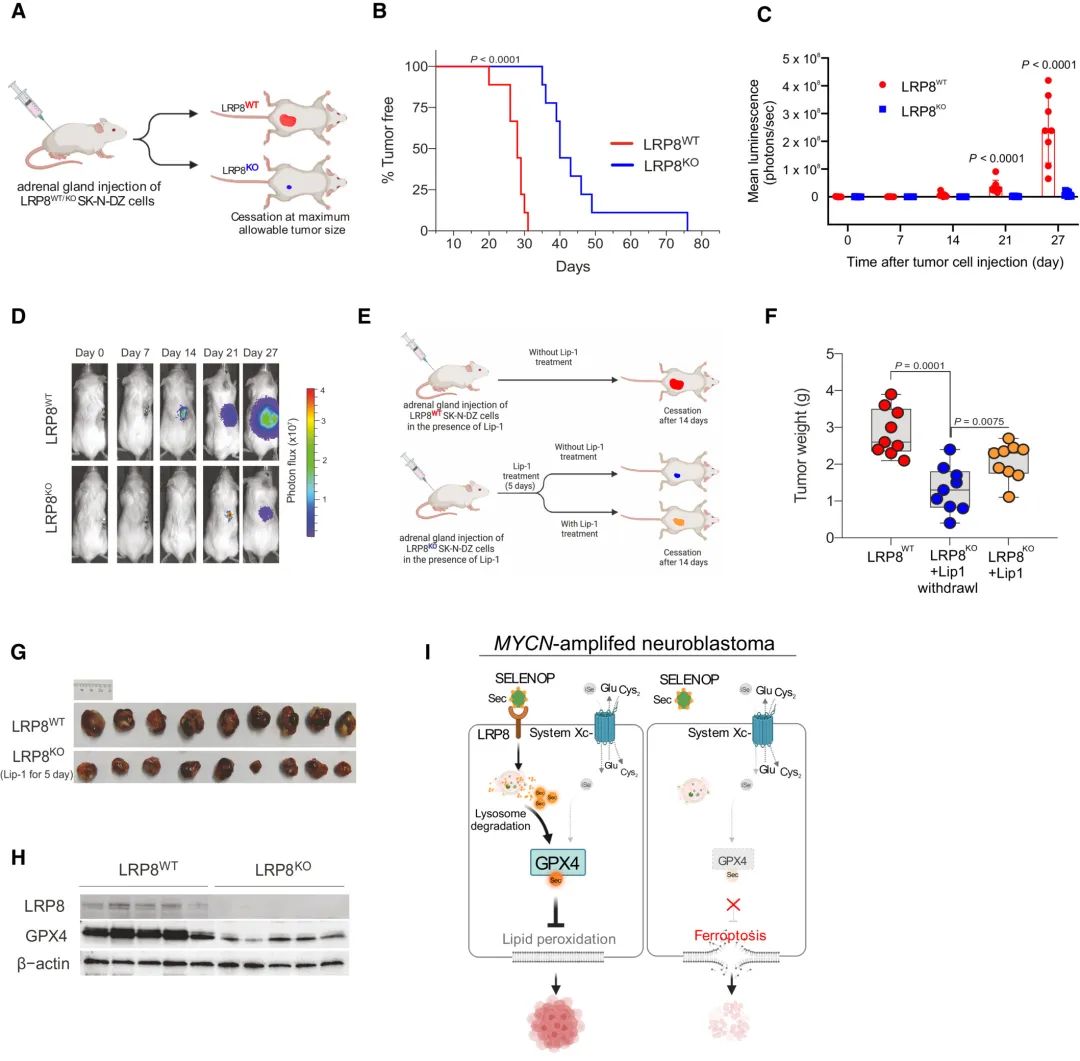
图4 两个LRP8缺陷的异种移植组(蓝色、黄色)与WT对照组(红色)相比,肿瘤生长均受到抑制,且LRP8KO肿瘤中GPX4蛋白表达强烈缺失
总之,数据表明,在MYCN扩增的原位神经母细胞瘤模型中,需要LRP8通过维持高水平的GPX4来预防铁死亡,并提示抑制 SELENOP/LRP8 轴可作为一种新型策略来触发铁死亡,从而限制高度侵袭性和难治性 MYCN 扩增的神经母细胞瘤细胞中的肿瘤生长。
鉴于成人肿瘤药物用于神经母细胞瘤治疗的成功有限,该研究引入了基于铁死亡的创新策略:通过靶向LRP8诱导肿瘤细胞铁死亡,这不仅为神经母细胞瘤提供了新的治疗方法,也给一系列儿科恶性肿瘤和MYCN驱动的癌症的治疗带来了希望。
参考文献:
DOI: 10.15252/emmm.202318014
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言