浙江大学平渊教授《自然·通讯》: 可热诱导工程化巨噬细胞的促炎极化可在免疫疗法期间重塑肿瘤免疫微环境
2024-04-01 BioMed科技 BioMed科技 发表于陕西省
在本研究中,浙江大学平渊教授等人发现,具有热诱导型遗传开关的工程化巨噬细胞(eMac)可响应温和的升温以诱导过继转移的eMac的自极化和肿瘤相关巨噬细胞(TAM)的再极化。
基于巨噬细胞的过继细胞疗法发展迅速。然而,在免疫抑制性肿瘤微环境(TME)中,将抑炎(M2样)巨噬细胞极化为促炎(M1样)表型困难重重,这大大限制了巨噬细胞过继疗法的进一步临床转化。
在本研究中,浙江大学平渊教授等人发现,具有热诱导型遗传开关的工程化巨噬细胞(eMac)可响应温和的升温以诱导过继转移的eMac的自极化和肿瘤相关巨噬细胞(TAM)的再极化。eMac在TME剂量下所局部产生的促炎细胞因子不仅诱导巨噬细胞强烈极化为M1表型,而且还确保避免了全身施用促炎细胞因子的典型副作用。此次,作者还介绍了一种可穿戴的取暖升温器件,该器件可以通过智能手机进行远程控制。总之,该工作代表了一种安全有效的过继转移免疫治疗方法,具有临床转化的潜力。相关工作以“Proinflammatory polarization of engineered heat-inducible macrophages reprogram the tumor immune microenvironment during cancer immunotherapy”为题发表在Nature Communications。

【文章要点】
干扰素-γ(IFN-γ)作为一类重要的促炎细胞因子,经常被用来将巨噬细胞重新极化为M1表型。然而,全身给药后,IFN-γ会迅速从血液中清除,因此需要频繁重新给药IFN-γ以确保M2至M1的极化,然而这类措施通常会导致全身毒性和副作用。有鉴于此,作者开发了一种工程化巨噬细胞(eMac),它可以通过无线遥控的方式在肿瘤组织中局部分泌IFN-γ,以诱导其向M1表型的极化,用于癌症免疫治疗。作者首先建立了一个升级的dCas9系统,该系统与10个拷贝的GCN4(编码激活转录因子)融合,分别与scFv(单链可变片段)-p65-HSF1连接,以诱导更有效的转录激活。由于热休克(HSP70)启动子允许以时空方式精确控制基因表达,因此将HSP70启动子安装到升级的dCas9系统中可确保精确调节Ifng响应温和升温的转录激活。同时,通过慢病毒转染实现巨噬细胞的基因工程,使HSP70-dCas9系统整合到巨噬细胞基因组中,最终使巨噬细胞成为产生IFN-γ的细胞工厂(图1)。
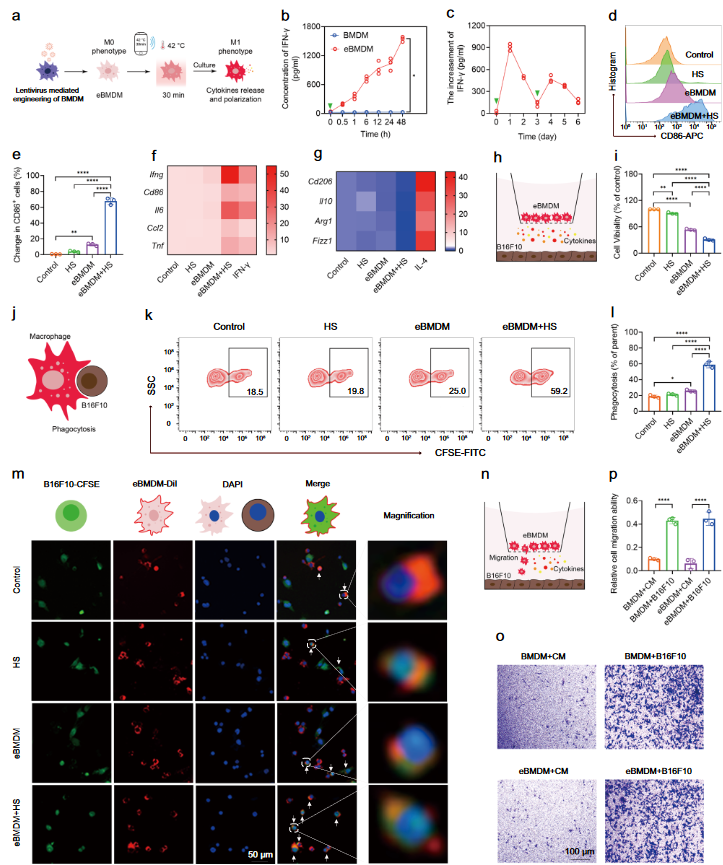
图1 热休克蛋白可极化巨噬细胞
此外,作者还开发了名为iWarm的可穿戴加热器件,可以控制肿瘤的温和变温,从而使eMac变成可分泌IFN-γ的开关,从而时空控制内源基因的激活和失活,以避免不必要的副作用(图2)。过继转移后,eMac的内在肿瘤趋向性有助于TME中的积累,与此同时iWarm可使局部区域温度升高至〜42 °C,从而介导转移的eMac的自极化和TAM的再极化。这种方式很好地避免了IFN-γ全身给药所遇到的快速清除障碍、剂量依赖性毒性和副作用。不仅如此,由于iWarm可以定制成可穿戴设备,并由智能手机或可以连接到互联网的电子设备(如笔记本电脑)进行远程控制,上述策略为向患者提供远程和精确的药物提供了可能性。
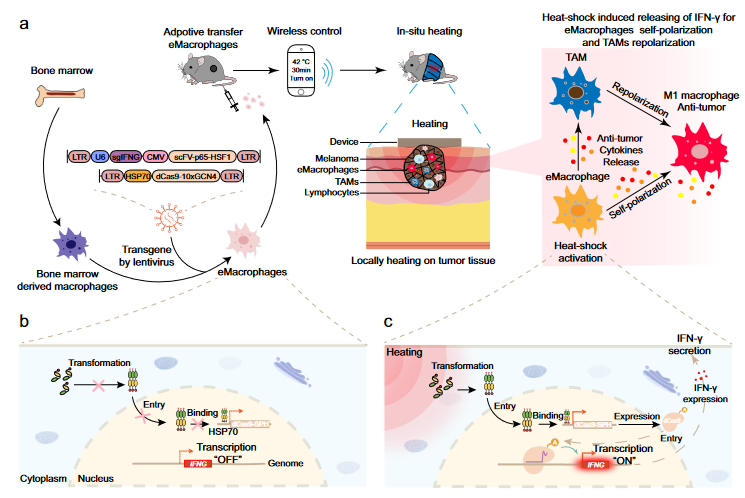
图2 无线远程激活巨噬细胞实现免疫疗法
原文链接:
https://www.nature.com/articles/s41467-024-46210-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#巨噬细胞# #免疫疗法# #工程化巨噬细胞#
11