【论著】| 食管癌新辅助放化疗中放疗累及野照射的初步研究
2023-08-03 中国癌症杂志 中国癌症杂志 发表于上海
本中心建议的IFI在保证临床疗效的同时显著降低了肺、心脏和脊髓等器官的辐射受量,具有一定的可行性。
[摘要] 背景与目的:局部晚期食管癌患者的标准治疗方案是新辅助放化疗(neoadjuvant chemoradiotherapy,NCRT)联合根治性切除术,但临床上实施这一综合性治疗策略的技术环节存在一定差异性,特别是NCRT中放疗靶区范围的定义一直存在争议。本研究旨在分析局部晚期食管癌NCRT采用累及野照射(involving field irradiation,IFI)的可行性。方法:回顾性分析2016年7月—2017年5月在上海交通大学医学院附属胸科医院接受NCRT联合手术的局部晚期食管鳞癌患者,所有患者的放疗靶区均为我们推荐的IFI,再分别按照选择性淋巴引流区预防照射(elective node irradiation,ENI)和原发灶亚临床病灶照射(subclinical lesion irradiation,SLI)两种传统靶区勾画方式对入组患者重新制订放疗计划。比较3组计划的剂量学参数以及双肺、心脏、脊髓等危及器官(organ at risk,OAR)受照剂量差异,并分析IFI失败模式与靶区的关系。结果:共入组26例患者。IFI的靶区平均体积为(277±77)cm3,明显低于ENI和SLI(P<0.05)。剂量学分析发现,IFI能显著降低双肺受到5、20 Gy以上剂量照射的相对体积分数(V5、V20)、双肺平均受照剂量(Dmean)、心脏V30、心脏Dmean和脊髓最大受照剂量(Dmax)(P<0.05),双肺V20、双肺Dmean、心脏Dmean和脊髓Dmax较ENI分别下降27.1%、22.5%、27.4%和6.4%,较SLI分别下降24.1%、22.0%、24.8%和5.7%。经过28~69个月的随访,13例患者发生复发转移,其中7例患者为单纯远处转移,4例患者为照射野内复发,1例患者为照射野外局部复发,3年总生存(overall survival,OS)率和无病生存(disease-free survival,DFS)率分别为50.0%和42.3%。结论:本中心建议的IFI在保证临床疗效的同时显著降低了肺、心脏和脊髓等器官的辐射受量,具有一定的可行性。
[关键词] 食管鳞癌;新辅助放化疗;放疗靶区;危及器官;剂量学;失败模式
[Abstract]Background and purpose: The standard treatment for patients with locally advanced esophageal cancer is neoadjuvant chemoradiotherapy (NCRT) plus radical rep. However, the technical aspects for implementing this comprehensive treatment strategy differ, especially in the controversial definition of the radiotherapy target area in NCRT. This study aimed to analyze the feasibility of involving field irradiation (IFI) in NCRT for locally advanced esophageal cancer. Methods: Retrospective analysis of locally advanced esophageal squamous cell carcinoma patients receiving NCRT in Shanghai Chest Hospital, Shanghai Jiao Tong University School of Medicine from July 2016 to May 2017 showed that the radiotherapy target of all patients was our recommended IFI. The radiotherapy plan was redesigned for the enrolled patients according to the two traditional target delineation of elective node irradiation (ENI) and primary subclinical lesion irradiation (SLI). The dosimetric parameters of the three groups and the dose differences of organ at risk (OAR), such as lungs, heart and spinal cord, were compared, and the relationship between IFI Recurrence pattern and radiation target volumes was analyzed. Results: A total of 26 patients were enrolled. The average target volume of IFI was (277±77) cm3, which was significantly lower compared with ENI and SLI (P<0.05). IFI could significantly reduce relative volume fraction of lungs irradiated more than 5 and 20 Gy (V5 and V20), lungs average dose (Dmean), heart V30, heart Dmean and spinal cord maximum dose (Dmax) (P<0.05), compared with ENI. Lungs V20, lungs Dmean, heart Dmean and spinal cord Dmax decreased by 27.1%, 22.5%, 27.4% and 6.4% compared with ENI, and 24.1%, 22.0%, 24.8% and 5.7% compared with SLI, respectively. After 28 to 69 months of follow-up, 13 patients had recurrence and metastasis, of whom 7 patients had distant metastasis, 4 patients had recurrence in the irradiation field, and 1 patient had local recurrence in the irradiation field. The 3-year overall survival (OS) rate and disease-free survival (DFS) rate were 50.0% and 42.3%, respectively. Conclusion: IFI recommended by our institution is feasible to ensure clinical efficacy while significantly reducing the radiation dose of lungs, heart and spinal cord.
[Key words] Esophageal squamous carcinoma; Neoadjuvant chemoradiotherapy; Target volume; Organ at risk; Dosimetry; Recurrence pattern
食管癌多以鳞癌为主,由于早期缺乏有效的筛查手段,大多数患者确诊时已经为局部晚期[1]。局部晚期食管癌患者的标准治疗方案是新辅助放化疗(neoadjuvant chemoradiotherapy,NCRT)联合根治性切除术,但临床上实施这一综合性治疗策略的技术环节存在一定差异性,特别是NCRT中放疗靶区范围的定义一直存在争议[2]。目前,关于食管癌综合治疗的代表性研究主要为CROSS和NEOCRTEC5010研究[3-4],然而这两项研究中关于放疗临床靶区(clinical target volume,CTV)的勾画存在一定差异,CROSS研究为选择性淋巴引流区预防照射(elective node irradiation,ENI),NEOCRTEC5010研究为原发灶亚临床病灶照射(subclinical lesion irradiation,SLI),两种放疗计划均有较高的围手术期心肺不良反应发生率,因此需要探讨是否存在进一步缩小新辅助放疗中的靶区范围,从而降低正常组织器官特别是心肺的受照剂量,减少正常组织器官损伤,提高治疗依从性,进而提高临床疗效的路径。本研究总结1组接受累及野照射(involving filed irradiation,IFI)的食管癌病例,通过分析IFI术后失败模式并与传统放疗靶区危及器官(organ at risk,OAR)受照剂量进行对比,探讨IFI的可行性。
1 资料和方法
1.1 患者资料
回顾性分析2016年7月—2017年5月在上海交通大学医学院附属胸科医院接受NCRT联合手术的局部晚期食管癌患者。入组标准:① 原发肿瘤位于胸段;② 经病理组织学检查证实为食管鳞癌;③ 接受NCRT且放疗计划保存完整;④ 具有较为完整的临床分期检查,按照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版TNM分期标准判定为局部晚期。排除标准:① 原发灶位于颈段或胃食管交界处;② 既往有胸部放疗病史;③ 一般情况差,心、肝、肾等器官功能差,无法耐受放化疗;④ 拒绝放疗。本研究经上海交通大学医学院附属胸科医院伦理委员会批准。
1.2 靶区与OAR的定义与勾画
从Pinnacle治疗计划系统调取入组患者既往定位/计算机体层成像(computed tomography,CT)图像。所有患者均接受IFI,其CTV由原发病灶和转移淋巴结的大体靶区(gross target volume,GTV)直接构成,不进行任何外放射治疗,计划靶区(planning target volume,PTV)由原发灶PTV(PTV of primary lesion,PTVp)和病理淋巴结PTV(PTV of pathological lymph nodes,PTVn)共同组成。其中PTVp由原发灶GTV(GTV of primary lesion,GTVp)头脚方向外扩1.0~1.5 cm,四周外扩0.8~1.0 cm,PTVn由病理淋巴结GTV(GTV of pathological lymph nodes,GTVn)向各个方向外扩0.8~1.0 cm。根据本课题的定义,每例患者需要额外勾画两种CTV。ENI的CTV参照CROSS研究:原发灶CTV(CTV of primary lesion,CTVp)为GTVp在食管走向的纵轴上下外扩3.0 cm,四周外扩0.8 cm,病理淋巴结CTV(CTV of pathological lymph nodes,CTVn)包括病理淋巴结所在的淋巴结站区域、阳性淋巴结站与站之间的淋巴引流区以及CTVp周围淋巴引流区域,由CTVp和CTVn共同构成ENI的CTV。SLI的CTV参照NEOCRTEC5010研究:CTVp由GTVp纵轴上下外扩3.0 cm,四周外扩0.8 cm,CTVn由GTVn各个方向外扩1.0 cm,由CTVp和CTVn共同构成SLI的CTV。CTV在所有层面勾画时遇到解剖屏障均需进行调整。考虑到3种靶区生理运动范围一致,内在靶体积(internal target volume,ITV)没有进行勾画。PTV由相对应的CTV直接外扩0.8 cm生成,分别称为PTVENI和PTVSLI。OAR主要包括脊髓、心脏及两侧肺组织,其勾画原则同其他胸部肿瘤。
1.3 肿瘤处方剂量及正常组织器官安全耐受剂量限制
PTV处方剂量为41.4 Gy/23次,1.8 Gy/次,1次/d,5次/周。要求不低于95%的靶体积接受处方剂量的照射,不低于99%的靶体积接受95%的处方剂量,同时靶区内剂量分布尽可能均匀。脊髓接受的最大剂量(Dmax)<45 Gy,心脏受到 30 Gy以上剂量照射的相对体积分数(V30)<30%、平均剂量(Dmean)<30 Gy,双肺V20<20%,Dmean<20 Gy。
1.4 计划设计及评估
选择6 MV的X射线,采用调强放疗(intensity modulated radiation therapy,IMRT)技术,使用Pinnacle 9.1治疗计划系统进行逆向计划设计及优化。依据治疗计划中剂量-体积直方图(dose-volume histograms,DVH)的数据进行放疗计划评估。靶区评估指标:PTV体积;正常组织器官辐射受量评估包括双肺V5、V20和Dmean,心脏V30和Dmean,脊髓Dmax。评估IFI正常组织器官辐射受量降低幅度,计算方法:(IFIx-ENIx)/ENIx×100%,(IFIx-SLIx)/SLIx×100%。
1.5 生存及预后评估
总生存期(overall survival,OS)定义为从放化疗第1天开始,至患者(任意原因)死亡的时间,未死亡的患者以最后1次随访时间为终点。无病生存期(disease-free survival,DFS)定义为从手术第1天开始,至疾病复发或由于非肿瘤原因导致患者死亡的时间,未发生复发转移的患者以最后1次随访时间或非肿瘤特异性死亡的时间为终点。
1.6 统计学处理
正态分布的计量资料以x±s表示,采用双侧配对t检验,非正态分布的计量资料以中位数(范围)表示,采用Wilcoxon秩和检验,P <0.05为差异有统计学意义。
2 结 果
2.1 患者临床资料
根据入组和排除标准最终纳入26例临床分期为ⅡA~ⅣA期的食管癌患者,其中男性22例,女性4例,中位年龄61岁(45~72岁)。入组病例中胸上段3例,胸中段10例,胸下段13例,20例患者伴有1站或多站淋巴结转移,治疗前食管镜检查显示,肿瘤长度为2~17 cm,中位长度为6 cm,所有患者均经活检证实为鳞状细胞癌并接受NCRT联合手术治疗(表1)。

2.2 靶区设计及评估结果
依据本研究所定义的靶区设计规范,ENI、SLI、IFI靶区设计见图1,3组治疗计划均满足靶区剂量要求。在PTV的比较中,IFI的靶区平均体积为(277±77)cm3,明显低于ENI和SLI,差异有统计学意义(P<0.05)。在OAR辐射受量的比较中,IFI双肺V5、V20、Dmean,心脏V30、 Dmean,IFI脊髓Dmax均显著低于ENI和SLI,差异有统计学意义(P<0.05)。3组计划的评估结果见表2。
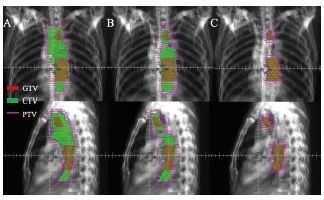
图1 3组计划靶区示例图
Fig. 1 Comparison of target delineation in three plans
A: ENI; B: SLI; C: IFI. The patient was a 59-year-old male with clinical stage of cT3N1M0.

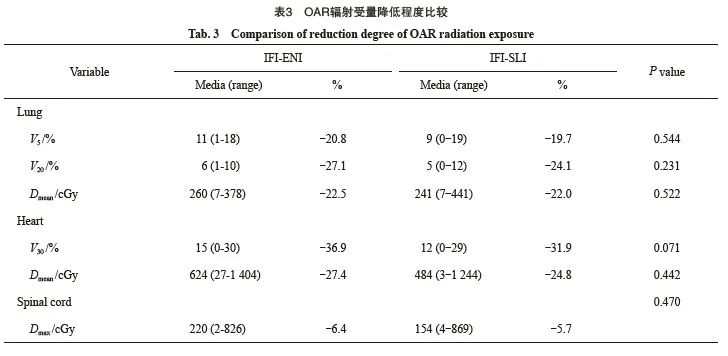
2.3 OAR辐射受量降低程度
相较于ENI、SLI,IFI双肺V5分别减少20.8%、19.7%,V20减少27.1%、24.1%,双肺Dmean降低22.5%、22.0%;心脏V30分别减少36.9%、31.9%,心脏Dmean降低27.4%、24.8%;脊髓Dmax分别降低6.4%、5.7%,两组靶区降低程度差异无统计学意义(P>0.05,表3)。
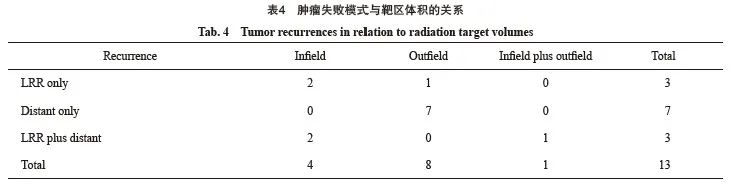
2.4 随访及复发模式
所有患者均采用IFI,中位OS和DFS分别为38和29个月,3年OS率和DFS率分别为50.0%和42.3%。在中位随访57个月(四分位距为28~69个月)后,共有13例(50.0%)患者出现复发进展,失败模式以远处转移(26.9%)为主。首发出现局部区域治疗失败的详细资料:照射野内复发4例(15.4%),照射野外转移1例(3.8%),野内复发合并野外复发1例(3.8%),详见表4。
3 讨 论
采用标准模式治疗局部晚期食管癌患者,尽管NCRT不明显增加不良反应,但与单纯手术相比,围手术期的心肺并发症呈增加趋势[4-5]。这些围手术期心肺并发症与术前新辅助治疗密切相关,提示NCRT技术参数仍需进一步优化。在食管癌NCRT中,放疗靶区一直存在争议,不同临床中心差异较大,因此探讨放疗靶区有无进一步缩小和优化的空间及如何优化是临床上亟待解决的问题。
从临床角度来看新辅助放疗靶区可以进一步缩小:① NCRT联合手术治疗的肿瘤失败模式以远处转移为主,局部区域复发为少数[6-7];② Kumagai等[8]的meta分析显示,NCRT会增加食管鳞癌患者术后不良反应的发生率,术后并发症以心肺及相关不良反应为主;③ 尽管CROSS研究对部分高危淋巴结区域进行预防性照射,但与NEOCRTEC5010研究相比并未增加局部控制率和延长生存率[6-7],Liu等[9]的meta分析也证实ENI不能提高患者的长期生存,两种放疗方式在R0切除率、无进展生存期及复发模式上无明显区别。多项研究[10-11]显示,缩小放疗范围可以有效地减少放射性损伤的发生,从CROSS研究的放疗靶区缩小到NEOCRTEC5010研究的放疗靶区是可行的。
支持新辅助放疗靶区进一步缩小还有一定的理论依据:① NCRT后有手术参与,食管癌根治术帮助清除包括原发灶上下5 cm的食管以及颈、胸、腹部的高危淋巴结[2];② 食管癌CTVp到底有多大,沿着食管走向的纵向CTVp根据Gao等[12]研究资料显示的鳞癌纵向外扩3 cm有一定参考依据,但横向的CTVp范围目前没有达成共识;③ 食管癌淋巴结转移及空间分布无明显规律性,Hagens等[13]的meta分析结果显示,胸中段食管癌患者锁骨上淋巴结、腹腔淋巴结转移率分别为17%、20%,与病灶旁淋巴结转移率相当,并且胸上段与胸下段食管癌也会出现上行和下行转移,因此无法根据原发灶的位置准确定量给出CTVn尺寸;④ Ji等[14]对39例接受放疗的食管癌患者进行剂量学分析,发现靶区周围区域会接受较大剂量的意外照射,加之同步化疗增敏,可能已经达到控制亚临床病灶的目的;⑤ 放射线在杀死肿瘤细胞、降低肿瘤负荷的同时也会杀伤T淋巴细胞,多项研究[15-16]表明,淋巴细胞减少是患者治疗后预后不佳的重要因素。美国MD Anderson癌症中心总结了860例食管癌患者的放疗资料,发现较大的PTV对淋巴细胞消耗影响更大,建议通过减少靶区体积、采用质子放疗等措施以降低食管癌放疗后淋巴细胞减少的风险[17]。
基于以上临床表征和理论估计,本中心提出仅包括原发病灶和转移淋巴结的IFI,不进行任何针对原发病灶、淋巴结亚临床灶的预防性照射。
在双肺保护方面,降低双肺V5、V20可以减少放射性肺炎的发生风险。美国放射治疗肿瘤协作组(Radiation Therapy Oncology Group,RTOG)的前瞻性研究[18]发现,V20与放射性肺炎的严重程度明显相关,当V20<22%时,无放射性肺炎发生,当V20为22%~31%时,8%的患者发生2级放射性肺炎,当V20≥32%时,有3~5级放射性肺炎发生。另有研究[19]发现,双肺V5是放射性肺损伤的独立危险因素,建议双肺V5应控制在65%。本研究IFI双肺V5、V20仅38.50%、15.42%,较ENI和SLI减少20%以上,提示IFI有可能降低围手术期肺损伤风险。
在心脏保护方面,既往研究[20]表明,肿瘤位置与心脏疾病相关死亡风险相关,胸段食管癌死亡风险最高,因此有必要在控制肿瘤的前提下尽可能减少心脏组织受量。Wei等[21]的研究发现,心包V30是心包积液发生的主要危险因素,当V30<46%、Dmean<26 Gy时,心包积液的发生率由73%降至13%。近年来随着对心脏放射线耐受性认识的提升,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[2]推荐胸部肿瘤同期放化疗中的心脏耐受剂量逐年降低,目前食管癌推荐Dmean<30 Gy,肺癌Dmean<20 Gy。本研究IFI心脏V30为30%,较ENI、SLI分别减少36.9%、31.9%,Dmean为18 Gy,较ENI、SLI分别减少27.4、24.8%。IFI可以减少近1/3的心脏受量,提示缩小靶区能带来更加明显可靠的心脏保护。
在脊髓保护方面,高剂量照射会导致放射性脊髓炎。Schultheiss[22]通过回顾性分析得出脊髓接受45 Gy照射时放射性脊髓炎发生率仅为0.03%,由于处方剂量较低,3组计划脊髓Dmax均不超过45 Gy,并且IFI较传统放疗能降低6%的辐射受量,进一步降低脊髓损伤风险。
预防性照射旨在降低局部复发率,本研究结果显示,IFI术后主要失败模式为远处转移,其次是照射野内复发,仅1例患者发生颈部淋巴结转移。回顾既往临床研究[3-4,23-24]的生存数据,NCRT后3年OS率为47%~65%,3年DFS率为44%~64%,本研究的生存数据与既往文献报道相近,提示减少原发灶和淋巴结亚临床病灶照射并不会影响患者预后。
本研究存在一些不足之处:由于病例数较少,食管癌的原发病灶和转移淋巴结空间分布存在一定异质性,靶区设计对OAR的剂量学影响还有待更大样本量或其他队列的观察验证。优化靶区、缩小照射范围的目的是降低正常组织损伤,但目前只有剂量学上的数据,需要进行不同放疗方式与IFI之间的随机对照临床研究。
综上所述,本中心建议的IFI在保证临床疗效的同时显著降低了肺、心脏和脊髓等器官的辐射受量,具有一定的可行性。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] AJANI J A, D’AMICO T A, BENTREM D J, et al. Esophageal and esophagogastric junction cancers, version 2.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(7): 855-883.
[3] HAGEN P V, HULSHOF M C C M, LANSCHOT J J B V, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer[J]. N Engl J Med, 2012, 366(22): 2074-2084.
[4] YANG H, LIU H, CHEN Y P, et al. Neoadjuvant chemoradiotherapy followed by surgery versus surgery alone for locally advanced squamous cell carcinoma of the esophagus (NEOCRTEC5010): a phase Ⅲ multicenter, randomized, openlabel clinical trial[J]. J Clin Oncol, 2018, 36(27): 2796-2803.
[5] LV J, CAO X F, ZHU B, et al. Long-term efficacy of perioperative chemoradiotherapy on esophageal squamous cell carcinoma[J]. World J Gastroenterol, 2010, 16(13): 1649-1654.
[6] OPPEDIJK V, VAN DER GAAST A, VAN LANSCHOT J J, et al. Patterns of recurrence after surgery alone versus preoperative chemoradiotherapy and surgery in the CROSS trials[J]. J Clin Oncol, 2014, 32(5): 385-391.
[7] LIU S L, WEN J, YANG H, et al. Recurrence patterns after neoadjuvant chemoradiotherapy compared with surgery alone in oesophageal squamous cell carcinoma: results from the multicenter phase Ⅲ trial NEOCRTEC5010[J]. Eur J Cancer, 2020, 138: 113-121.
[8] KUMAGAI K, ROUVELAS I, TSAI J A, et al. Meta-analysis of postoperative morbidity and perioperative mortality in patients receiving neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal and gastro-oesophageal junctional cancers[J]. Br J Surg, 2014, 101(4): 321-338.
[9] LIU T T, DING S L, DANG J, et al. Elective nodal irradiation versus involved-field irradiation in patients with esophageal cancer receiving neoadjuvant chemoradiotherapy: a network meta-analysis[J]. Radiat Oncol, 2019, 14(1): 176.
[10] YAMASHITA H, TAKENAKA R, OMORI M, et al. Involvedfield radiotherapy (IFRT) versus elective nodal irradiation (ENI) in combination with concurrent chemotherapy for 239 esophageal cancers: a single institutional retrospective study[J]. Radiat Oncol, 2015, 10: 171.
[11] JING W, ZHU H, GUO H B, et al. Feasibility of elective nodal irradiation (ENI) and involved field irradiation (IFI) in radiotherapy for the elderly patients (aged ≥ 70 years) with esophageal squamous cell cancer: a retrospective analysis from a single institute[J]. PLoS One, 2015, 10(12): e0143007.
[12] GAO X S, QIAO X Y, WU F P, et al. Pathological analysis of clinical target volume margin for radiotherapy in patients with esophageal and gastroesophageal junction carcinoma[J]. Int J Radiat Oncol Biol Phys, 2007, 67(2): 389-396.
[13] HAGENS E R C, VAN BERGE HENEGOUWEN M I, GISBERTZ S S. Distribution of lymph node metastases in esophageal carcinoma patients undergoing upfront surgery: a systematic review[J]. Cancers (Basel), 2020, 12(6): E1592.
[14] JI K, ZHAO L J, YANG C W, et al. Three-dimensional conformal radiation for esophageal squamous cell carcinoma with involved-field irradiation may deliver considerable doses of incidental nodal irradiation[J]. Radiat Oncol, 2012, 7: 200.
[15] LAMBIN P, LIEVERSE R I Y, ECKERT F, et al. Lymphocytesparing radiotherapy: the rationale for protecting lymphocyterich organs when combining radiotherapy with immunotherapy[J]. Semin Radiat Oncol, 2020, 30(2): 187-193.
[16] LADBURY C J, RUSTHOVEN C G, CAMIDGE D R, et al. Impact of radiation dose to the host immune system on tumor control and survival for stage Ⅲ non-small cell lung cancer treated with definitive radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2019, 105(2): 346-355.
[17] VAN ROSSUM P S N, DENG W, ROUTMAN D M, et al. Prediction of severe lymphopenia during chemoradiation therapy for esophageal cancer: development and validation of a pretreatment nomogram[J]. Pract Radiat Oncol, 2020, 10(1): e16-e26.
[18] GRAHAM M V, PURDY J A, EMAMI B, et al. Clinical dosevolume histogram analysis for pneumonitis after 3D treatment for non-small cell lung cancer (NSCLC)[J]. Int J Radiat Oncol Biol Phys, 1999, 45(2): 323-329.
[19] JIANG Z Q, YANG K Y, KOMAKI R, et al. Long-term clinical outcome of intensity-modulated radiotherapy for inoperable non-small cell lung cancer: the MD Anderson experience[J]. Int J Radiat Oncol, 2012, 83(1): 332-339.
[20] FRANDSEN J, BOOTHE D, GAFFNEY D K, et al. Increased risk of death due to heart disease after radiotherapy for esophageal cancer[J]. J Gastrointest Oncol, 2015, 6(5): 516-523.
[21] WEI X, LIU H H, TUCKER S L, et al. Risk factors for pericardial effusion in inoperable esophageal cancer patients treated with definitive chemoradiation therapy[J]. Int J Radiat Oncol Biol Phys, 2008, 70(3): 707-714.
[22] SCHULTHEISS T E. The radiation dose-response of the human spinal cord[J]. Int J Radiat Oncol Biol Phys, 2008, 71(5): 1455-1459.
[23] HASHIMOTO J, KATO K, ITO Y, et al. Phase Ⅱ feasibility study of preoperative concurrent chemoradiotherapy with cisplatin plus 5-fluorouracil and elective lymph node irradiation for clinical stage Ⅱ/Ⅲ esophageal squamous cell carcinoma[J]. Int J Clin Oncol, 2019, 24(1): 60-67.
[24] KLEVEBRO F, VON DÖBELN G A, WANG N, et al. A randomized clinical trial of neoadjuvant chemotherapy versus neoadjuvant chemoradiotherapy for cancer of the oesophagus or gastro-oesophageal junction[J]. Ann Oncol, 2016, 27(4): 660-667.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言