Circ Res 中山大学张峰团队联合耶鲁大学阐明淋巴管通透性和吸收功能的全新调节机制
2023-07-24 论道心血管 论道心血管 发表于上海
本研究大大加深了对淋巴管功能调节方式的全面理解,并为淋巴管功能障碍相关疾病的治疗提供了全新的思路和潜在靶点。
淋巴管是循环系统不可或缺的一部分,在体液、脂肪和免疫细胞的吸收和运输中发挥关键作用,极大地控制着机体循环稳态平衡。淋巴管功能障碍可诱发全身系统性疾病如水肿、肥胖和慢性炎症,同时也与老年痴呆和青光眼等组织特异性疾病的发生发展密切相关。既往研究虽已明确了淋巴管的组织分布,并初步阐明了其在生理和病理过程中的细胞起源和形态发生,但对其功能调节方式的认识仍十分不足。
直至孕中晚期,胚胎的淋巴管系统仅形成初步的网络结构,而不具备成熟的功能。但在围产期的短短几天内,淋巴管即可获得高效的吸收功能,从而满足出生后机体对脂肪摄取和免疫防御的巨大需求。出生后淋巴管如何快速获取功能是解析机体循环稳态维持的一个重要科学问题,其机制有待阐明。
2023年7月18日,中山大学张峰团队联合耶鲁大学Anne Eichmann团队在Circulation Research杂志上发表题为“Chylomicrons regulate lacteal permeability and intestinal lipid absorption”的研究论文,通过研究毛细淋巴管对乳糜微粒(脂肪在体内的吸收和运输形式)和体液的吸收过程,揭示了乳糜微粒自身可通过诱导毛细淋巴管细胞间连接由低通透性的“拉链状连接”转变为高通透性的“纽扣状连接”,从而促进出生后淋巴管获得吸收功能,并进一步阐明了VEGFR2/VEGFR3-PI3K-RAC1-ROCK信号轴在其中的作用。本研究大大加深了对淋巴管功能调节方式的全面理解,并为淋巴管功能障碍相关疾病的治疗提供了全新的思路和潜在靶点。

研究人员首先分析了临产期小鼠胚胎和刚接受母乳喂养的初生小鼠的乳糜淋巴管(一种特化的毛细淋巴管)的细胞间连接结构,发现经母乳喂养后,小鼠乳糜淋巴管细胞间连接出现一个由“拉链状连接”向“纽扣状连接”的明显转变。由于“纽扣状连接”的出现在时间上与乳糜微粒的存在相吻合,研究人员使用乳糜微粒和花生四烯酸(母乳中最丰富的长链多不饱和脂肪酸)分别对淋巴管内皮细胞HDLEC进行处理,发现两者均可导致细胞出现不连续的细胞间连接,并引起细胞骨架相关蛋白-肌球蛋白轻链2(MLC2)磷酸化水平的升高(图1)。这些结果表明乳糜微粒自身可诱导新生淋巴管功能成熟,并提示机体出生后淋巴管可因其所处微环境的刺激,自主获得相应的脂肪和体液吸收功能。
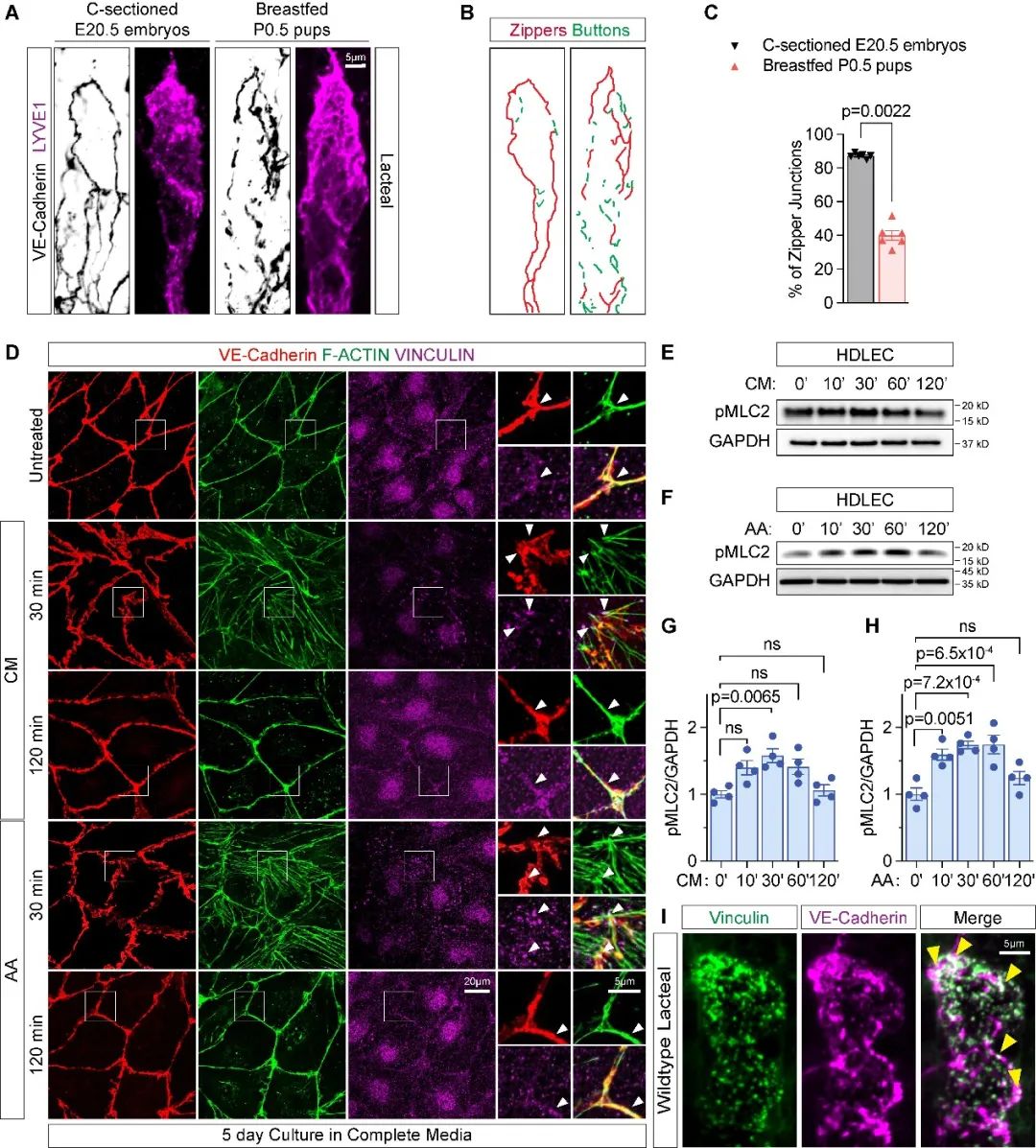
图1. 乳糜微粒通过促进细胞骨架收缩而诱导淋巴管内皮细胞间连接由“拉链状连接”转变为“纽扣状连接”
随后,考虑到ROCK(调节细胞骨架收缩的重要蛋白)在介导MLC2磷酸化和细胞间连接重塑中的关键作用,研究人员构建了ROCK1和ROCK2的淋巴管内皮细胞条件性敲除小鼠。通过他莫昔芬在新生小鼠中诱导双敲除ROCK1/2,可抑制毛细淋巴管“纽扣状连接”的形成,将其保持在低通透性的“拉链状”,且降低新生小鼠中淋巴管系统对脂质的吸收(图2)。
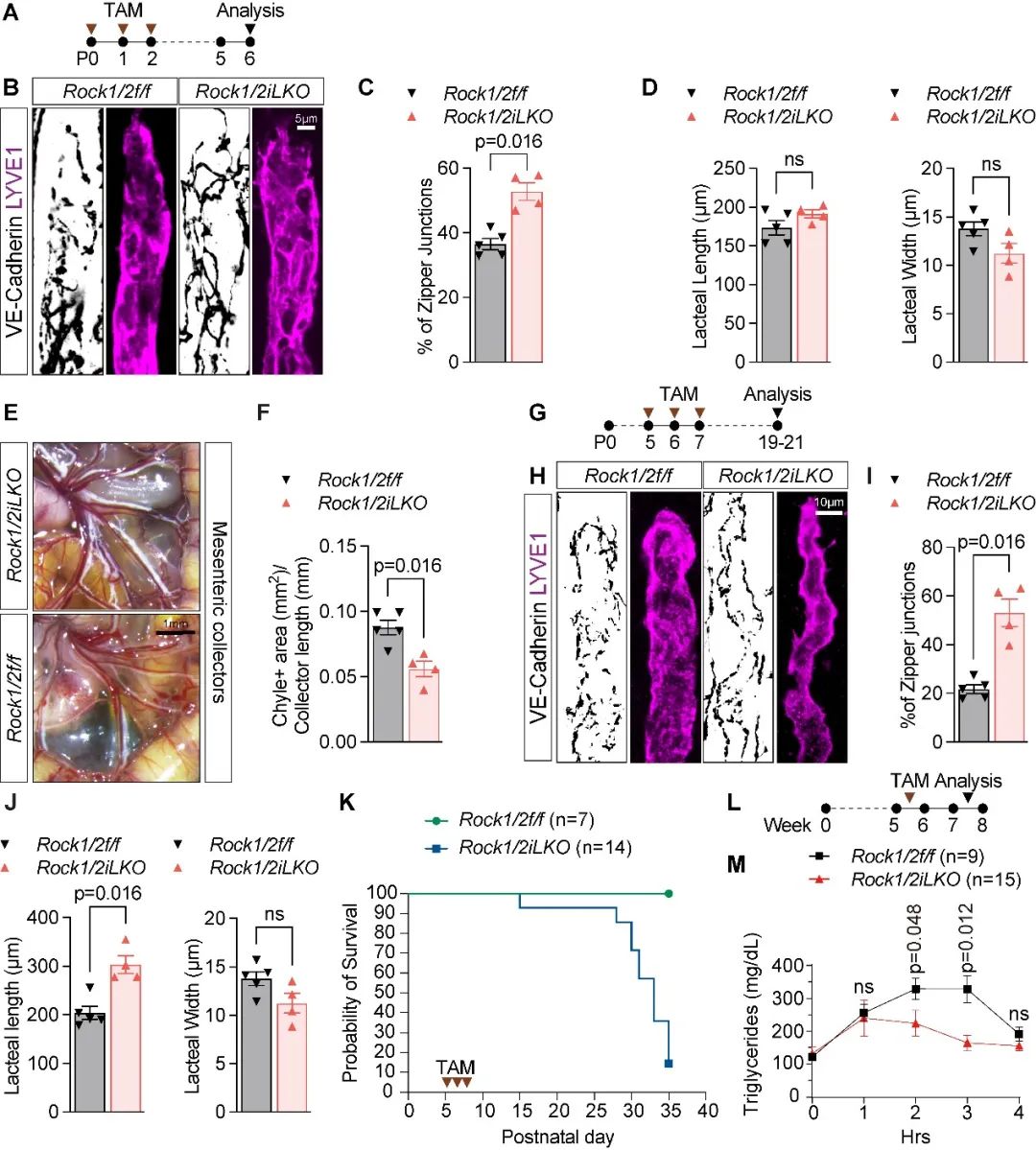
图2. 条件性敲除ROCK1/2促使乳糜淋巴管细胞间连接由“纽扣状连接”转变为“拉链状连接”并抑制脂质吸收
VEGF-A及其受体VEGFR2是调节血管通透性的首要信号通路,但其在淋巴管中的作用尚不明确。为了进一步明确乳糜微粒调节淋巴管通透性的精细机制,研究人员将视角聚焦在VEGF-A/VEGFR2通路上。作者发现,经母乳喂养初生小鼠的小肠中VEGFR2受体的磷酸化水平受到显著抑制。
随后,通过使用Vegfr2淋巴管内皮细胞特异性敲除小鼠以及Vegfr2持续激活点突变小鼠,作者证实VEGFR2受到抑制是毛细淋巴管上形成和维持“纽扣状”连接的必要条件(图3)。这些结果表明,乳糜微粒可以通过抑制淋巴管内皮细胞中的VEGF-A/VEGFR2信号,而促使毛细淋巴管形成高通透性的“纽扣状连接”,从而获得吸收功能。
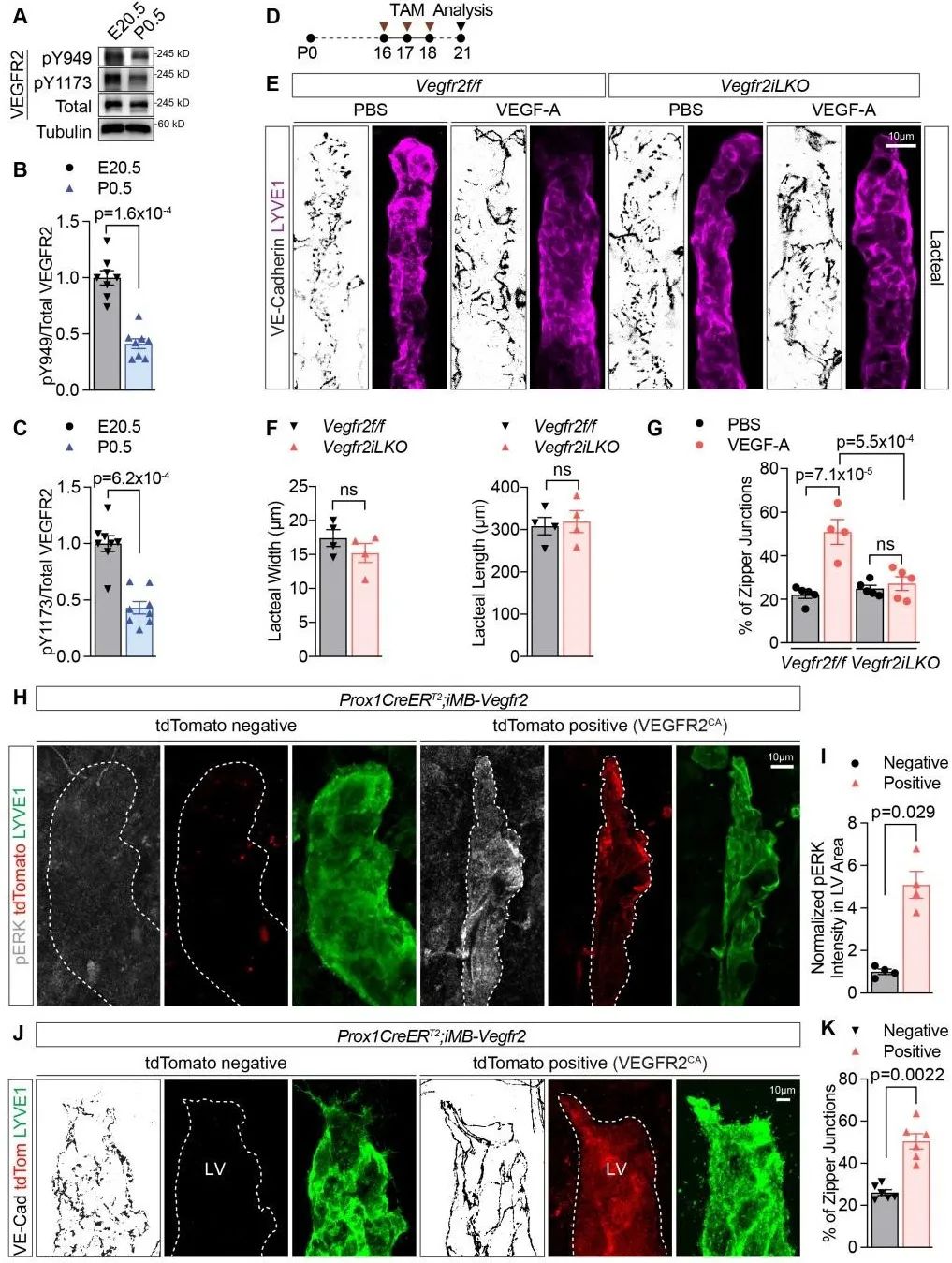
图3. VEGF-A/VEGFR2信号抑制可维持毛细淋巴管上的“纽扣状连接”
VEGFR3是参与淋巴管发育和结构维持的首要生长因子受体。作者同样使用了Vegfr3淋巴管内皮细胞特异性敲除小鼠,发现VEGFR3条件性敲除可阻断VEGF-A/VEGFR2活化所诱导的毛细淋巴管细胞间连接的转变。VEGFR3的配体为VEGF-C和VEGF-D,其并不直接与VEGF-A结合,因此作者猜测VEGFR3是通过调节VEGFR2的表达或者与VEGF2形成VEGFR2/VEGFR3异二聚体发挥作用。进一步的研究结果显示,VEGFR3敲除不影响VEGFR2的表达,却可阻断VEGF-A/VEGFR2下游的PI3K/AKT信号传导,结果提示VEGFR3是通过与VEGFR2形成VEGFR2/VEGFR3异二聚体参与调节乳糜管细胞间连接(图4)。
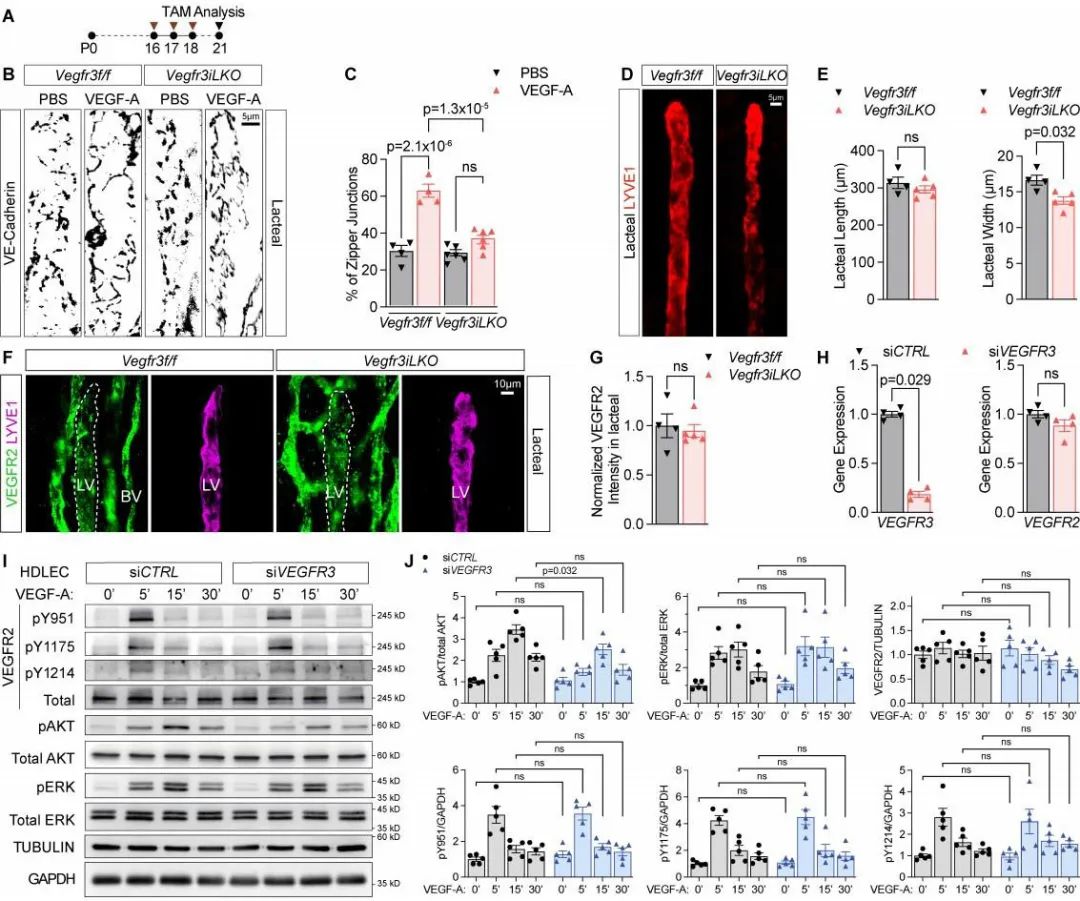
图4. VEGFR3参与调节VEGF-A/VEGFR2诱导的乳糜毛细淋巴管细胞间连接转变
作者随即对VEGFR2及VEGFR3下游共同的PI3K/AKT信号轴展开研究。通过使用Akt1敲除鼠和注射PI3K抑制剂Wortmannin,作者发现PI3K/AKT是介导VEGFR2/VEGFR3调节淋巴管细胞间连接和通透性的主要信号轴。与此形成鲜明对比, PLCγ/ERK(图5)以及VEGFR2 Y949/TsAD/Src(参见原文)这些VEGFR2的下游信号轴并不参与对淋巴管通透性的调节。
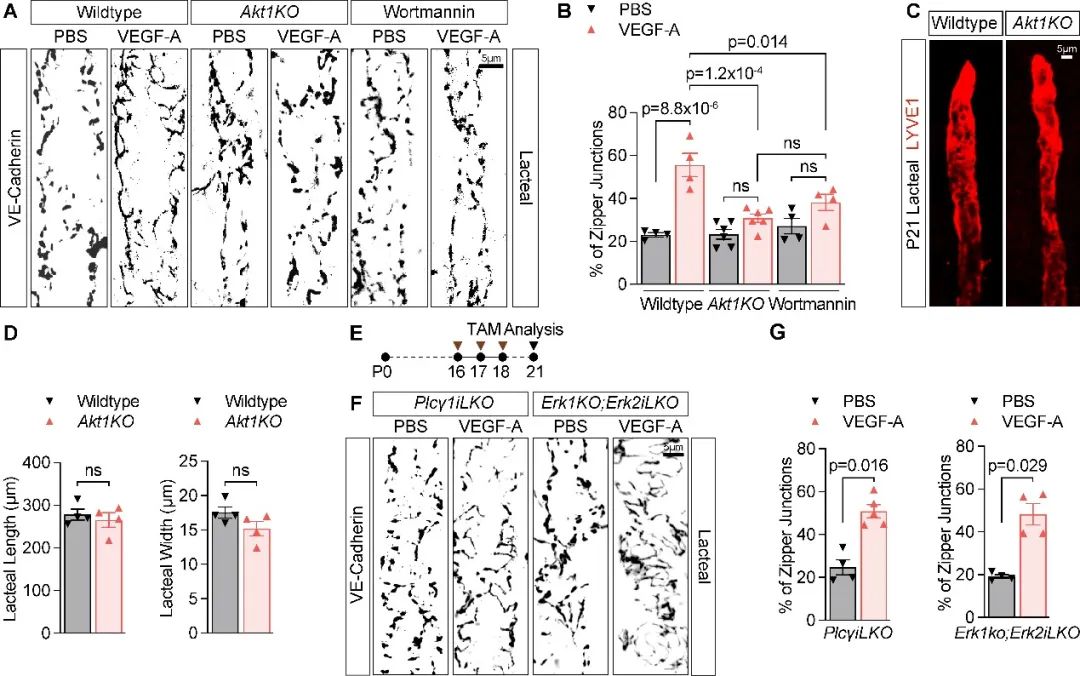
图5. VEGF-A通过VEGFR2/PI3K信号轴诱导乳糜管细胞间连接转变为“拉链状连接”
作者从分子水平上进一步明确,VEGF-A/VEGFR2是通过激活RAC1并抑制RhoA/ROCK/MLC2等下游信号,进而调节淋巴管内皮细胞间连接的重塑过程和通透性(图6)。
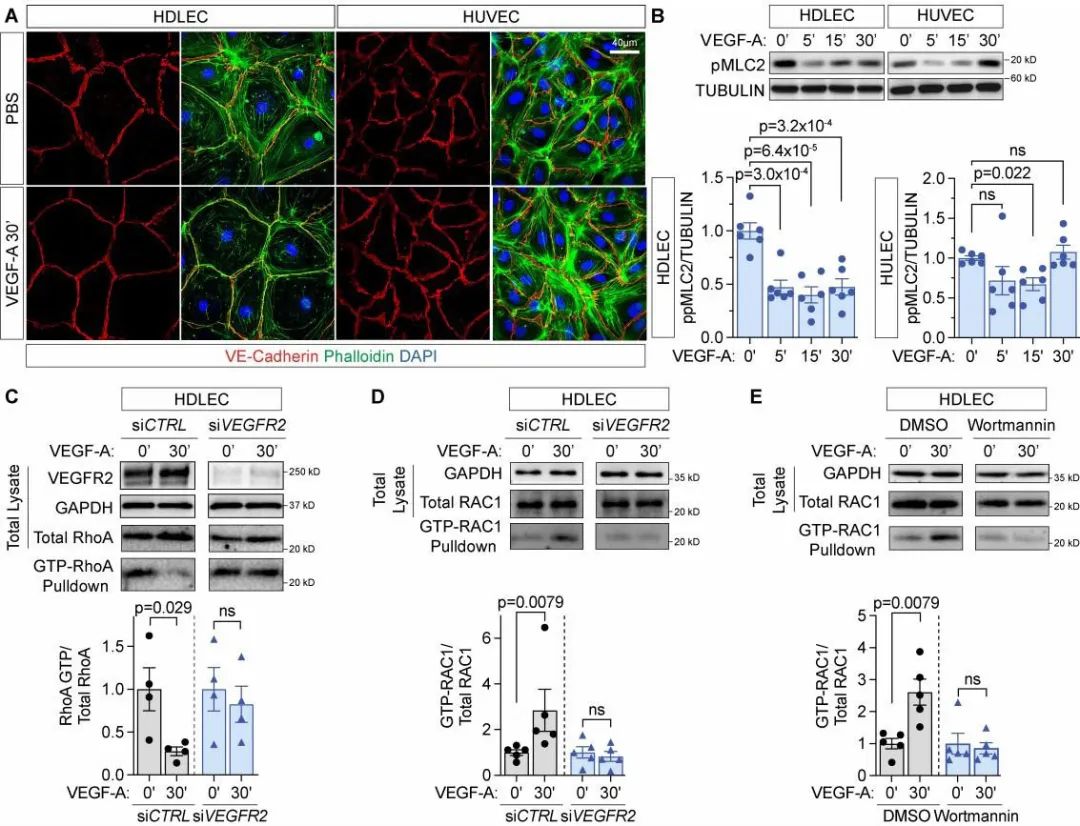
图6. VEGF-A通过激活RAC1阻断淋巴管内皮细胞应力纤维的形成
最后,作者对全身其它组织中的毛细淋巴管内皮细胞间连接进行分析,发现ROCK1/2条件性敲除以及VEGF-A/VEGFR2的激活也可促使皮肤毛细淋巴管细胞间连接由“纽扣状连接”转变为“拉链状连接”,且抑制小鼠皮肤毛细淋巴管对组织间液的吸收能力,从而证实VEGF-A/VEGFR2/PI3K/AKT/RhoA/ROCK/MLC2参与对淋巴管通透性和吸收功能的普适性调节(图7)。不过,皮肤中是否有其他上游因子调节淋巴管内皮细胞中的VEGF-A/VEGFR2通路尚需进一步研究。
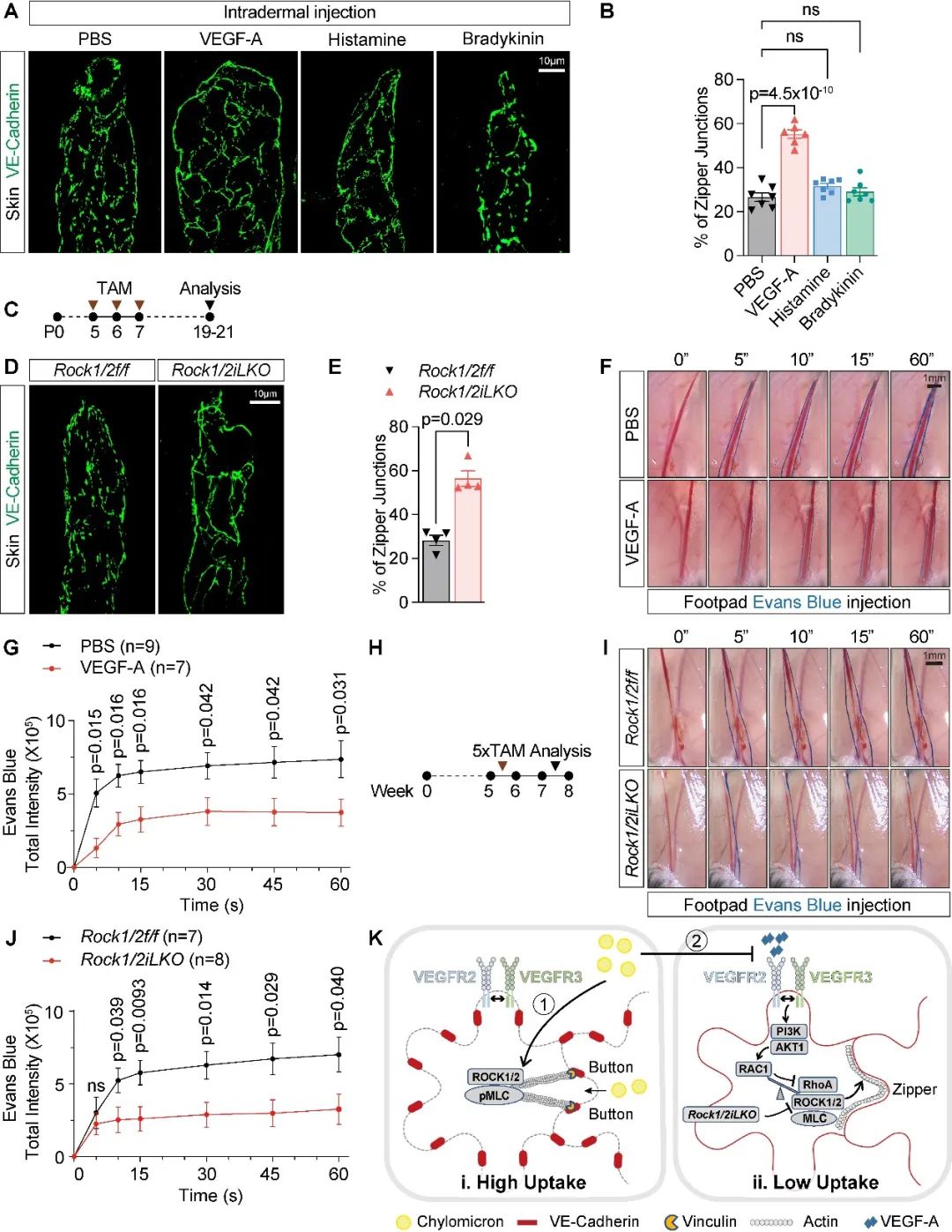
图7. ROCK调节皮肤毛细淋巴管的内皮细胞间连接和吸收功能
综上,本研究阐明了新生淋巴管获得脂质吸收功能的重要机制,揭示了乳糜微粒通过VEGF-A/VEGFR2和ROCK1/2通路调节淋巴管内皮细胞间连接和通透性的双重调节机制,为解析淋巴管生理功能调节机理提供了全新认识,并有助于开发脂代谢紊乱、水肿及免疫缺陷等淋巴管功能障碍相关疾病的全新治疗靶点。
本研究由中山大学中山眼科中心张峰团队与耶鲁大学心血管研究中心Anne Eichmann团队合作完成。耶鲁大学博士后Georgia Zarkada和中山大学中山眼科中心博士生陈洵为本文共同第一作者。Anne Eichmann教授为共同通讯作者,张峰教授为最后通讯作者。研究受到国家重点研发计划、国自然面上和专项项目以及NIH R01等经费的资助。
原文链接:
https://doi.org/10.1161/CIRCRESAHA.123.322607
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







