Nat. Med. 细胞衰老与Senolytics: 通往临床之路
2023-01-04 brainnew神内神外 brainnew神内神 发表于安徽省
消除衰老细胞已成为预防、延缓或减轻多种疾病和与年龄有关的功能障碍的一种可行的治疗策略。Senolytics在临床前模型的结果提示在该领域有治疗和预防的应用前景,有望延缓多重病症和增加健康期。
Senolytics(选择性消除衰老细胞的药物)自2015年首次被报道以来就引起了广泛关注,毕竟,相比持续的限食和锻炼,通过药物来缓解病痛,维持健康要更加轻松方便。Senolytics延缓衰老的原理是清除衰老细胞,然而这种方法背后的机制是什么?细胞衰老和机体衰老之间的联系是怎样的?“药物防老”这条路现在又走到了哪里?梅奥医学中心的James L. Kirkland教授在2022年8月发表在Nature medicine的综述“Cellular senescence and Senolytics: the path to the clinic”中,通过概述将衰老细胞作为终生疾病治疗靶点的基本原理以及讨论近来诸多将干预措施转化为临床应用的临床试验,对以上问题一一做出了回答。
摘要
相互关联的衰老基础生物学过程似乎是许多机能失调和疾病的根源。细胞衰老便是其中之一,它通过抑制细胞周期来应对破坏性刺激。衰老细胞在整个生命周期中都可以出现,如果细胞衰老持续地出现,组织功能会因其分泌的许多异常蛋白质而受到损害。在临床前模型中,针对那些持续存在并导致组织损伤的衰老细胞进行干预已被证明可以延缓、预防或缓解多种疾病。
与此同时,选择性清除衰老细胞的小分子药物的发现为预防或治疗人类多种与年龄相关的疾病提供了有前景的策略。在这篇综述中,作者概述了将衰老细胞作为终生疾病治疗靶点的基本原理,并讨论了最近和正在进行的临床试验最有前景的策略,包括最近和正在进行的将小分子Senolytics和其他衰老靶向干预措施转化为临床应用的临床试验。
正文
老龄群体数量正在不断增长。世界卫生组织(WHO)估计,到2030年,6人之中将有1人是老年人,即21亿人的年龄将超过60岁。时序年龄无论在低、中、高收入国家,都是发病率、死亡率和医疗费用中高成本疾病的主要预测因素。
在整个生命周期中,衰老进程的加速可能发生在多种急性和慢性疾病的病灶,即使在儿童中也是如此。事实上,基础的衰老过程甚至可以发生在受孕之前,比如唐氏综合征患者的卵母细胞衰老就是这种情况。细胞衰老正是一种日益受到关注的基本衰老机制。衰老细胞在衰老过程中积累,也在多种疾病过程中的发病部位积累。Senolytics(选择性消除衰老细胞的药物)在2015年首获报导之后,其有希望的临床前研究结果推动了早期临床试验的进展,以评估Senolytics的安全性和有效性,其中一些结果现已发表(表1)。
基本的衰老机制可以归类为几种人们常说的衰老特征,包括基因组不稳定、干细胞耗竭/功能障碍、端粒和表观遗传变化、蛋白质稳态失调、营养感应改变、线粒体功能障碍、细胞间通讯改变、慢性低度炎症、纤维化、微生物组失调和细胞衰老。目前的衰老假说理论认为,包括细胞衰老在内的衰老特征,倾向于与多种疾病的病理发生、年龄相关的功能障碍(包括老年综合征,如虚弱、行动不便、肌肉减少/肌肉萎缩、轻度认知障碍和失禁)和恢复力丧失(例如,从损伤、手术、化疗或感染等压力中恢复的能力降低,或对免疫产生抗体反应的能力降低)协同发展。基本衰老机制的统一理论建立在衰老假说理论的基础上,即认为针对任何一种基本机制的干预措施都可能影响其他机制。例如,衰老和慢性病实验动物模型中的研究发现,针对细胞衰老的干预措施往往会削弱其他基本衰老机制,使得炎症减轻、干细胞耗竭减少、纤维化减少、改善线粒体功能障碍并在一定程度上恢复微生物组。
如果能够理解和靶向细胞衰老和其他衰老生物学基础,而不是针对衰老过程下游的单个疾病,那么会减少多重发病的情况,延长健康寿命,这会带来巨大的社会和经济效益。作者在文中深入讨论了衰老细胞作为治疗靶点的潜在价值、Senolytics药物开发的现状以及将针对衰老细胞的预防和治疗策略引入临床的途径。
细胞衰老:机制和途径
1961年,Hayflick和Moorhead在连续传代培养人类成纤维细胞后首次报道了细胞衰老。衰老细胞处于不可逆的细胞周期停滞状态,但仍保持活性。在个体水平的整个生命周期中,它们会随着个体衰老积累,尤其是在虚弱的个体,也会在实验动物或人类多种疾病发生的过程中和疾病的致病部位积累。细胞衰老的命运可由多种应激因素触发,包括DNA损伤、癌基因突变或癌基因激活、线粒体功能障碍、反应性代谢产物、高氧或缺氧、蛋白毒性应激、细胞外信号、感染、使细胞变形的机械应力或剪切应力、抵抗细胞变形和其他衰老细胞分泌的因子。许多使DNA损伤反应信号激活的应激源和p53/p21CIP1/WAF1、p16INK4a/视网膜母细胞瘤蛋白或其他途径的激活导致了细胞周期停滞和衰老相关分泌表型(senescence-associated secretory phenotype,SASP)的发展(图1)。
通过上调促存活和抗凋亡途径,如SRC激酶、PI3K–AKT信号通路、热休克蛋白(heat shock protein,HSP)通路、丝氨酸、线粒体通路或凋亡调节因子BCL-2相关蛋白,这些衰老细胞产生了细胞毒性的微环境,但它们在促凋亡SASP条件下仍可存活。

图 1 衰老相关分泌表型。SASP是细胞衰老的一个重要特征。细胞压力诱导DNA损伤反应信号,激活包括NF-κB、CCAAT/增强子结合蛋白-β(C/EBPβ)、GATA结合蛋白4(GATA4)、p38和JAK-STAT在内的关键转录因子和信号,从而驱动和调节SASP。各种形式的SASP包括趋化因子、细胞外基质蛋白酶、重塑因子、生物活性脂质、非编码核苷酸和反应性代谢产物。IL-6,白细胞介素-6;ROS,活性氧;TGF-β,转化生长因子β;TIMPs,金属蛋白酶组织抑制剂;TNF,肿瘤坏死因子。
衰老相关分泌表型。大多数衰老的细胞都会逐渐产生SASP(图1)。在30-70%的衰老细胞中,这种SASP包含促炎因子、促凋亡因子和促纤维化因子,其中一些因子可通过内分泌方式影响相邻或相距较远的未衰老细胞。由于衰老细胞的积聚和持续存在,促凋亡的SASP可对局部和全身产生负面影响。在另一些衰老细胞中,SASP似乎包含生长和其他再生因子,这些衰老细胞与促凋亡、促炎症的衰老细胞相比,可能会减少凋亡、组织损伤和纤维化,甚至可以促进组织修复(例如,通过生长因子VEGF-A和PDGF-AA)。
如果衰老细胞仅暂时存在,由于SASP吸引、锚定和激活免疫细胞的能力,促凋亡和促生长类型SASP的有益功能可以共同协调组织重塑(在胎儿发育、年轻个体生长和细胞或组织损伤后),在感染或组织损伤时诱导免疫反应,或通过胎盘中衰老细胞释放的SASP因子促进分娩,此外它们还能够通过促炎性SASP诱导清除这些衰老细胞。
持续表达促凋亡SASP衰老细胞的不利影响。通常,衰老细胞产生后的几天到几周内会被自然杀伤细胞和其他类型免疫细胞清除。然而,如果衰老细胞超出可被清除的阈值,衰老细胞就会积累下来,这可能是因为表达促凋亡SASP的衰老细胞以旁分泌和内分泌的方式诱导其他部位衰老,而这已经超出了免疫清除的速度,并产生了新的衰老细胞(图2)。一旦衰老细胞超出可被清除的阈值,促凋亡/促炎症的衰老细胞持续增加可能会导致组织损伤,从而导致多重疾病及衰老相关疾病的产生或加剧(表2),另外,免疫失调也能进一步放大前馈回路中的衰老细胞积累。虽然不是每个衰老细胞都产生促凋亡或促炎症的SASP,但这种衰老细胞的积聚和持续存在会导致慢性低度促纤维化炎症状态(通常与衰老和慢性疾病相关),称为“炎症”。这种无菌炎症状态可引起邻近和远处的非衰老细胞(如干细胞)的功能障碍,并导致组织功能受损和再生能力下降。与此相一致的是,衰老细胞的持续存在能够引起与组织炎症、纤维化和细胞外基质降解有关的紊乱,以及脂肪组织产生胰岛素抵抗,抗阻运动后肌肥大减少,老年人骨折修复受损,同时促进恶性病变等现象。
衰老细胞的SASP不是固定的,它可以随着时间的推移而变化,并根据衰老的细胞类型和衰老的诱导方式而变化。胞内和胞外环境可以调节SASP因子的产生及其丰度。持续处于衰老状态的细胞似乎对细胞外信号高度敏感,如损伤相关的分子模式(Damage-associated Molecular Patterns, DAMPs)和病原体相关的分子模式(Pathogen-associated Molecular Patterns, PAMPs),这会加剧SASP的促凋亡和促炎性质。例如,在SARS-CoV-2感染的情况下,其中一些细胞外信号通过Toll样受体3和血管紧张素转换酶2,导致新型冠状病毒肺炎(COVID-19)的发病。在SASP产生的数周或数月后,细胞内的信号会加剧SASP的损伤和促炎特性。细胞内的信号包括逆转录转座元件(如LINE-1)、胞浆线粒体DNA或环状DNA,这些都能激活cGAS-STING通路,触发促炎基因的表达。

图2 衰老细胞积累阈值理论。该理论假定,一旦衰老细胞的积累超过阈值,并通过旁分泌和内分泌使SASP的信号放大,其扩散就能超过免疫系统清除衰老细胞的速度。此外,SASP因子的增加可能阻碍免疫系统功能,进一步增加衰老细胞的累积。衰老细胞的积累也可能加速其他基本衰老机制的发生。在将衰老细胞与非衰老细胞移植到中年小鼠体内的研究中,发现只有移植衰老细胞才会产生衰老表型。在衰老细胞积累已经很高的情况下,如肥胖小鼠中,仅移植较少的衰老细胞就能够与相同年龄的瘦小鼠中产生相同的效果。与此相一致的是,在接受过可导致DNA损伤的抗癌治疗的儿童中,随后的加速衰老表型可能比没有儿童时期癌症治疗史的人更早。因此,具有促凋亡、促炎症SASP的衰老细胞可能需要超过阈值才能发挥有害作用。通过遗传学或药理学手段对衰老细胞的系统性清除往往会减弱导致衰老的其他诱因,并可以延缓、预防或减轻多种与衰老有关的紊乱和疾病。
Senolytics药物的探索与发展
第一个Senolytics药物是通过假设及药物机理筛选的方法发现的(图3)。由于那些30-70%具有促凋亡、组织破坏性SASP的衰老细胞本身对凋亡具有抗性,因此推测这些衰老细胞依赖于抗凋亡、促生存的途径来避免自我破坏。对蛋白质组学和转录组学数据的分析表明,衰老细胞中确实存在一种或多种衰老细胞抗凋亡途径(Senescent Cell Antiapoptotic Pathways, SCAPs)的上调。SCAP途径可能会保护某些类型的癌细胞,如B细胞淋巴瘤细胞或慢性淋巴细胞白血病细胞,它们也释放破坏组织的促凋亡因子,但自身能够避免凋亡。瞬时阻断SCAP途径能够导致具有组织破坏性SASP的衰老细胞凋亡,而非衰老细胞或那些具有促生长、非凋亡SASP的衰老细胞仍能存活。
生物信息学分析确定了46种靶向SCAP途径的化合物,这些化合物可能是潜在的Senolytics药物。第一批用于进一步研究的备选Senolytics药剂具备以下特点:(1)靶向几个SCAPs,而不是针对一种药物/一个分子靶点/一种疾病的传统药物开发方法,(2)可以口服给药,(3)是已知安全的天然产物或已经被FDA批准用于其他适应症,以方便从基础研究到临床的转化。其中包括SRC/酪氨酸激酶抑制剂达沙替尼(Dasatinib, D),该药物自2006年获批准并广泛使用,具有相当好的安全性,以及存在于水果和其他食物中的天然黄酮类化合物槲皮素(Quercetin, Q)和非瑟酮(Fisetin, F)。
在某些类型的衰老细胞中,SCAPs可能是多余的,因此靶向单个SCAP可能不会清除这些细胞,但靶向多个SCAPs的配伍治疗可能是有效的。例如,来自Ercc1-/-小鼠的胚胎间质成纤维细胞和来自衰老小鼠的骨髓间充质干细胞不能单独被D或Q消除,而能被二者的组合药物所清除。与SCAPs在不同类型衰老细胞中的异质性一致,老年人的脂肪干细胞(前脂肪细胞或间充质干细胞)对D敏感,而对Q或F不敏感,而老年人脐静脉内皮细胞对Q或F敏感,而对D不敏感。自从第一批SCAPs被发现以来,其他SCAPs也陆续被确认。基于此,更多的Senolytics药物治疗策略已经被开发出来。例如,FOXO4蛋白将p53保留在细胞核中,因此干扰这两种肽的相互作用可以诱导某些类型的衰老细胞中p53介导的凋亡。HSP90能够阻止AKT的蛋白酶体降解,因此抑制HSP90可以导致依赖SCAP的生存信号通路失效,从而使某些类型的衰老细胞被消除。与此相一致的是,某些HSP90抑制药物,如格尔德霉素,对特定类型的衰老细胞具有类似Senolytics药物的作用。
在某些情况下,针对单个SCAP节点的Senolytics化合物,如BCL-2途径抑制剂N(ABT-263)、A1331852或A1155463,倾向于在特定类型的衰老细胞内诱导凋亡。但值得注意的是,即使短暂使用N,也可引起血小板减少和中性粒细胞减少,这就引发了一个问题,由于脱靶效应,完全抑制单个SCAP节点需要剂量较高,靶向单一分子途径的药物是否有更大的毒性风险。也许通过使用“轻微”影响多个节点的药物或配伍药物,在使用每种药物的较低剂量的同时针对更广泛类型的衰老细胞是可行的,从而潜在地改善这些药物的副作用。例如,后一种方法已经被用于提高抗生素治疗的耐受性。
现在正在使用高通量文库筛选和其他方法来识别第二代Senolytics药物。一种方法源于许多衰老细胞中溶酶体质量和衰老相关β-半乳糖苷酶活性的增加,因此半乳寡糖包被的纳米颗粒和β-半乳糖苷酶激活的前体药物似乎能够消除这些衰老细胞中的相关影响。另一种方法是基于某些衰老细胞的高溶酶体活性,使得这些衰老细胞对溶酶体ATP酶抑制剂敏感。由于部分衰老细胞溶酶体膜发生破裂,其又依赖谷氨酰胺代谢作为pH缓冲系统,因此抑制谷氨酰胺代谢即可诱导其易感凋亡。
其他能够降低衰老细胞累积和减轻相关病理条件的策略包括调节衰老细胞的免疫清除。某些细胞表面蛋白在衰老细胞中的表达往往比其他类型细胞更高。这促使了针对这些细胞表面标记的嵌合抗原受体(Chimeric Antigen Receptor, CAR)T细胞、疫苗和抗体药物结合物设计的发展。尽管在某些情况下,激活的巨噬细胞和其他类型非衰老细胞也会受到影响,但这些方法都能消除衰老细胞。目前还不清楚这些方法是否主要清除那些具有促凋亡、促炎症、破坏组织的SASP的衰老细胞,还是那些主要具有促进生长的SASP的细胞,又或者两种类型都被清除。与疫苗或移植的CAR-T细胞相比,可能小分子Senolytics的一个优势是,如果需要衰老细胞,例如在伤口愈合、组织重塑或怀孕期间,治疗是可以停止的,而疫苗或CAR-T策略诱导的持续清除衰老细胞这一方法可能不容易立即停止。此外,CAR-T细胞治疗费用昂贵,通常必须针对每个接受治疗的个体量身定制,并可能引起移植排异,需要接受长期有风险的免疫抑制治疗。
应该注意的是,在常用的临床前模型中,是通过基于p16INK4a或p21CIP1/WAF1的遗传清除手段来消除衰老的,这种衰老靶向方法的机制不同于第一代、以SCAP为靶向的小分子Senolytics药物机制,因此,靶向的衰老细胞类型可能存在差异。例如,激活的巨噬细胞等细胞类型,可能不是典型的衰老细胞,但有高p16INK4a表达,却不是D+Q的靶向细胞。作者实验室未发表的工作表明,与野生型小鼠相比,转基因小鼠靶向衰老细胞的表型效应(如与伤口愈合和健康相关的效应)可能存在差异。这与最近的报告一致,清除表达高水平p16INK4a的衰老细胞可导致小鼠的纤维化,而小分子Senolytics药物似乎可以减少几种小鼠组织的纤维化。事实上,在清除衰老细胞的遗传模型发表之前,开发Senolytics药物的工作就开始了,并且不依赖于这些模型。这些遗传模型在精确定位那些表达特定衰老相关标记的细胞(例如p16INK4a或p21CIP1/WAF1)以及作为衰老概念验证研究的辅助工具方面十分有用(表2)。然而鉴于他们无法消除自然出现的异质性衰老细胞池(即不表达p16INK4a或p21CIP1/WAF1的衰老细胞或两者均不表达的衰老细胞),以及靶向激活的巨噬细胞等非衰老细胞的事实,所以这些遗传模型在评估Senolytics药物的转化潜力方面作用有限,但对其机制探究仍然有用。
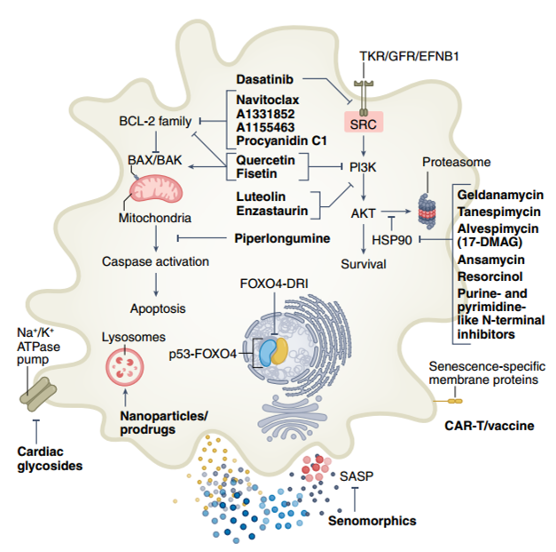
图 3第一代和第二代Senolytics药物策略。第一代Senolytics药物针对不同的SCAPs,包括酪氨酸激酶受体(TKRs)、生长因子受体(GFRs)、Ephrin受体B1(EFNB1)、SRC激酶、PI3K-AKT、HSP90、BCL-2家族成员、caspase抑制和p53。高通量文库筛选和其他方法已经为第二代Senolytics药物筛选策略提供了支持,包括溶酶体和SA-β-Gal激活的前体药物和纳米药物,钠钾泵(Na+/K+-ATP酶)依赖性凋亡、SASP抑制和CAR T细胞、抗体药物结合物或疫苗介导的免疫清除。
表1 已完成、正在进行或是计划中的Senolytics临床试验

D + Q, 达沙替尼和槲皮素; F, fisetin, 非瑟酮; N, navitoclax, 那维托克; Q, 槲皮素
表2 临床前模型中与衰老细胞积累相关并由Senolytics缓解的障碍和疾病
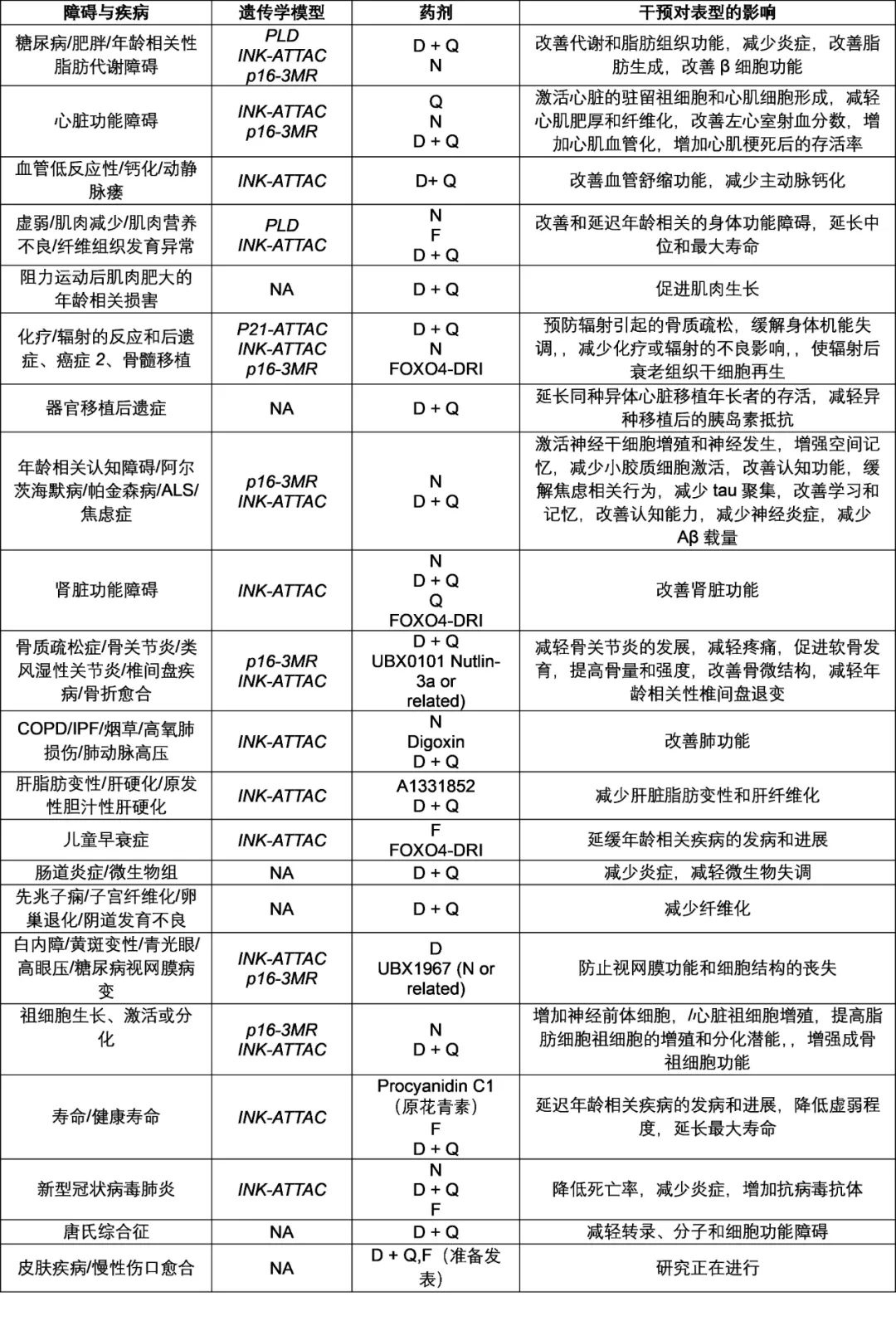
ALS,肌萎缩侧索硬化症;COPD,慢性阻塞性肺病;FOXO4-DRI,forkhead box O transcription factor 4-d-retro-inverso;INK-ATTAC,p16Ink4a通过靶向激活caspase凋亡;NA,未评估;p16-3MR,p16Ink4a三模态报告子;p21-ATTAC,清除表达p21Cip1衰老细胞的小鼠模型;PLD,p21-Cre/+;LUC(Gt(ROSA)26Sor启动子和萤火虫荧光素酶之间的Flixed loxP-flanked STOP盒)/DTA(ROSA启动子驱动的Flixed-STOP盒,后接白喉毒素A)小鼠。
SASP抑制剂
在不消除衰老细胞的情况下抑制SASP表达是缓解细胞衰老相关表型或疾病的另一种方法。SASP抑制剂(senomorphics)可通过抑制转录因子核因子(NF)-κB、JAK-STAT信号转导通路、丝氨酸/苏氨酸蛋白激酶mTOR、线粒体复合物-1或4相关靶点或其他参与SASP诱导和维持的通路,直接或间接减弱衰老细胞的SASP。在体外和体内,NF-κB(介导细胞对炎症反应)的抑制剂可以减少促炎的SASP细胞因子和趋化因子。此外,RNA介导的干扰筛选显示,针对衰老细胞中的可变剪接可能是抑制SASP的一种可行方法。雷帕霉素及其类似物通过抑制mTOR抑制SASP,似乎可以延长小鼠的健康期和寿命。抗糖尿病药物二甲双胍,除其他治疗活性外,可以抑制SASP,缓解几种与年龄有关的疾病和慢性疾病。一项临床试验(TAME,二甲双胍靶向衰老),准备测试二甲双胍是否会推迟已经患有一种与年龄相关疾病的患者发生第二种与年龄相关疾病的时间。
Senolytics与SASP抑制剂的优缺点
SASP抑制剂和Senolytics之间有重要的区别。SASP抑制剂可能抑制生长以及促凋亡、炎症和组织破坏的SASP因子,而第一代Senolytics靶向产生有害SASP因子的潜在原因,通过消除那些释放促凋亡因子的衰老细胞来发挥功能。SASP抑制剂一般需要持续治疗以维持对SASP的抑制,但仍有一些药物,如雷帕霉素,可以在短暂的给药过程后产生长期的效果。这可能是抑制了SASP介导的衰老扩散的结果,从而允许先天和适应性免疫系统进一步减少衰老细胞负担,与整体阈值理论一致(图2)。对于Senolytics,间歇给药似乎与持续治疗一样有效,两者都可以减少衰老细胞负担。这种间歇性的“打了就跑”的给药策略可以减少D等药物的副作用,这些副作用通常在连续给药几周到几个月后出现。在这方面,D、Q或F与其他Senolytics相比的优点是它们的半衰期短(在人体中分别为4、11或3-4小时)和快速消除。与间歇给药的Senolytics相比,SASP抑制剂更大的持续给药需求可能导致更多的副作用,也可能由于抑制细胞因子的分泌(即使这种细胞因子是必需的)而导致脱靶效应,这是由非衰老细胞如先天或适应性免疫细胞引起的。此外,一些SASP抑制剂可能具有药物特异性脱靶效应,例如雷帕霉素,它可能导致肾毒性、代谢损伤和感染易感性,至少在小鼠中是严重的。
Senolytics导致表达SASP的衰老细胞发生凋亡,这些衰老细胞存在于功能障碍的部位。有趣的是,一项涉及移植间充质干细胞的研究可能暗示了Senolytics药物诱导凋亡的可能机制。间充质干细胞在多种疾病模型中都有治疗作用。研究表明,间充质干细胞的凋亡是其治疗作用的必要条件,可能是通过凋亡过程的下游免疫抑制作用。这提出了一个有趣的假设,Senolytics诱导表达SASP衰老细胞的凋亡,集中在病理位点,可能有助于解释Senolytics的有益作用,目前的报道中显示其尚未在临床前模型中直接测试。
考虑到不同的细胞群受Senolytics和SASP抑制剂干预的影响,是否表达有害的组织破坏或有益的促生长因子分泌表型,对SASP抑制剂干预的成功开发是至关重要的。消除所有的衰老细胞或对SASP的普遍抑制,在某些情况下,可能是有害的。然而,主要针对持续的、组织破坏性的表达SASP的衰老细胞的干预,可能具有更好的治疗潜力和较少的脱靶效应。
Senolytics临床前模型
第一代Senolytics,如D+Q,已经在几个衰老和疾病的临床前模型中进行了测试,包括2型糖尿病,以及骨、心、肾、肝、肺、肌肉和神经疾病(表2)。在临床前模型中,移植衰老细胞会缩短健康期和寿命,而消除移植或内源性衰老细胞则会增加健康期,从而满足Koch的因果关系假设。
在饮食诱导肥胖的小鼠模型中,通过给药D+Q减少脂肪组织中衰老细胞的负担,减轻脂肪组织炎症,缓解代谢功能障碍,恢复前脂肪细胞分化为功能成熟、胰岛素应答的脂肪细胞的能力。高脂饮食(HFDs)和肥胖导致衰老细胞堆积,导致多器官功能受损,例如,HFD诱导的小鼠肾脏细胞衰老与肾脏纤维化和功能损害有关;Q治疗可降低衰老细胞负担和SASP标记物表达,减轻肾脏纤维化,改善肾功能。在HFD喂养的小鼠肝脏中,口服D+Q减轻了衰老肝细胞的负担和肝脏脂肪变性。肥胖还导致小鼠大脑第三脑室附近衰老细胞的积累,以及神经精神功能障碍的发展,特别是焦虑,这是由于位于第三脑室附近的边缘系统的功能改变。口服D+Q可减轻肥胖小鼠的神经炎症,增加神经发生的标志物,减少胶质细胞增生,减轻焦虑。纤维化可能是一种衰老驱动的进行性过程,导致器官功能下降;在特发性肺纤维化(IPF)小鼠模型中,D+Q治疗改善了肺顺应性并减少了虚弱症状。在与小鼠衰老样骨细胞和骨髓细胞相关的年龄相关性骨质疏松症中,D+Q减少了破骨细胞的发育,同时增加了骨形成功能的成骨细胞,从而恢复骨量。与年轻小鼠相比,阻抗运动后,老年小鼠肌肉中衰老细胞的增加与运动诱导的肌肉肥厚受损相一致。D+Q可以缓解衰老对肌肉生长的负面影响。最近,由于SASP因子分泌的放大效应,衰老细胞被认为与加重病毒感染的严重程度有关,导致细胞因子风暴和多器官衰竭。在感染了鼠冠状病毒的小鼠中,服用D+Q或F后死亡率降低。
移植来自老年小鼠的衰老细胞或器官已被证明可以将衰老表型传播到受体小鼠的远处部位,在移植后容易产生有害的结果。对老年供体小鼠、移植前从老年供体获得的器官或受体进行D+Q治疗,可以减少衰老细胞负担,增加受体小鼠的存活率——因此,其结果与接受年轻供体移植的小鼠观察到的结果相似。因此,Senolytics的潜在新应用可能是对目前由于器官衰竭或异体排斥反应风险增加而被丢弃的老年供体器官进行体外灌注,从而可能弥补移植器官的短缺。
最近的一项研究表明唐氏综合征(21三体)细胞衰老的影响和Senolytics的有益作用。神经祖细胞中第21号染色体的第3个拷贝导致了与衰老细胞相似的转录和核组织变化。有趣的是,D+Q可以缓解体外人神经细胞唐氏综合征模型的转录变化和细胞功能障碍。在暴露于辐射、高重力、零重力和舱内空气质量的宇航员身上观察到一种加速衰老的表型。因此,Senolytics可能通过清除宇宙和太阳辐射引起的衰老细胞来支持远距离的太空探索,特别是范艾伦辐射带以外的区域。2022年4月,在前往国际空间站的公理1号任务期间,研究人员对太空旅行对宇航员衰老生物标志物和培养的人类脂肪细胞干细胞的影响进行了测试(数据未公布)。
整体水平调控与组织水平调控
根据细胞衰老的阈值理论,衰老细胞可以没有临床表现,但如果其数量超过阈值,衰老细胞负担会进一步增加,导致局部和全身功能障碍和多种疾病的发展(图2)。衰老细胞由于其SASP甚至可以扩散到很远的部位;因此,除眼、皮肤或口腔局部或其他局部应用外,全身、间歇性给药治疗衰老相关疾病可能比局部给药更有前景。在体内给药的Senolytics可能不需要有严格的细胞类型特异性。可以说,一旦全身Senolytics治疗降低了整体衰老细胞负担到阈值以下,免疫系统就可能可以清除剩余的衰老细胞,包括那些对特定Senolytics有抵抗力的细胞。这对老年人或患有慢性疾病的人尤其重要,他们已经有很高的全身衰老细胞负担。系统给药的策略包括口服或静脉注射,口服通常更容易被患者接受,且给药费用较低。时间、所使用的特定Senolytics、年龄、性别和个体的其他特征都可能影响Senolytics的有效性。例如,对于尚未积累大量衰老细胞的健康年轻雌性小鼠,F可能是有益的,而D是有害的。
临床试验和未来方向
基于临床前模型的有希望的结果,超过20个Senolytics疗法的临床试验已经完成、正在进行或计划进行(表1)。由于Senolytics对人类的副作用还不完全清楚,并且为了最大化效益-风险比,第一个临床试验正在有严重健康状况的患者中进行,如糖尿病肾病、阿尔茨海默病、虚弱和IPF(特发性肺纤维化)。Senolytics(D+Q)的首次人体试验,造血干细胞移植幸存者研究,仍在进行中(NCT02652052;第一名患者于2016年4月1日给药)。第一个发表的Senolytics临床试验是一项开放实验的先导研究,其中14名IPF患者每周3天接受间歇性D+Q治疗,持续3周。结果表明,Senolytics改善了这些虚弱患者的身体功能。此外,一项涉及20名IPF患者的研究分析显示,口服D+Q后尿中“老年保护”因子α-Klotho的水平高于治疗前。在一项针对9名糖尿病肾病患者的开放实验临床一期初步研究中,在最后一剂Senolytics后,口服D+Q 3天疗程足以在至少11天内减少脂肪组织衰老细胞负担、炎症、纤维化和循环SASP因子,表明靶点发挥作用,并提示间断给药方案可能对人类有效。这些早期数据鼓励人们对衰老相关疾病进行更大规模随机、双盲、安慰剂对照试验的评估,其中一些试验正在进行中(表1)。
值得注意的是,在一项临床2期随机、双盲、安慰剂对照临床试验(NCT04349956)中,Senolytics药剂p53-不稳定蛋白MDM2抑制剂UBX0101(也称为Nutlin-3a),在12周的随访中,没有达到改善膝骨关节炎患者疼痛的效果。Nutlin-3a不显示或只显示微弱的延缓衰老活性,在某些情况下,甚至可以诱导细胞衰老。但在骨关节炎小鼠模型中,联合使用UBX0101和N对恢复衰老的关节结构是必要的。因此,该临床试验的失败似乎与所使用的特定药物有关,该药物可能不是完全有效的抗衰老药物。
衰老细胞负荷和Senolytics
的生物标志物:老年诊断
考虑到衰老细胞命运的背景和复杂的调节,如果仅仅基于组织活检的分析,原位识别和监测衰老细胞负荷,特别是在评估安全性和有效性的临床试验中,可能是具有挑战性的。然而,SASP因子、衰老标记物和其他基本衰老过程标记物(例如α-Klotho)可以在尿液、唾液、血液或脑脊液等体液中进行检测。此外,目前正在努力确定和定义衰老细胞积累的生物标志物(衰老生物标志物)和满足监管部门要求的衰老细胞在Senolytics治疗过程中被破坏的生物标志物。在临床试验和最终的临床实践中,SASP因子和Senolytics标志物将作为多种疾病的诊断/预测指标,在监测靶点起效和为患者制定个性化诊断方案中,发挥重要作用。事实上,为了促进针对基本衰老过程的干预措施的发展,并最终用于临床实践,这些指标需要不仅仅是“生物钟”。需要可复制、可靠、可行和廉价的指标,不仅反映生物学年龄,而且还与临床功能和/或临床残疾相关。这些指标也应随着干预措施的变化而变化,预测或反映这些干预措施引起的临床功能的变化,并指出哪种Senolytics或SASP抑制剂可能最适合特定患者。这种生物标记物或生物标记物的复合评分被称为“老年诊断”。事实上,第一个对Senolytics敏感的人类老年诊断评分是2019年发布的血液综合评分。此外,作者提出了“老年诊断比率”的概念,即随着衰老或与基本衰老机制加速相关的疾病而增加的老年诊断指标可以被概括为分子的复合物(例如,衰老细胞标记物、SASP因子、CD38和mTOR活性指标),而有益的老年保护因子(例如,α-Klotho或烟酰胺腺嘌呤二核苷酸(NAD+)或Sirt-6)可以被概括为分母。这种方法既能提高灵敏度,又能减少“分母效应”,例如,肌酐常被用作尿液分析物的显性指标,引入了肌肉质量这一混杂变量,肌酐水平取决于肌肉质量。
未来十年的临床计划。为了验证早期临床试验的初步结果,需要进行大型随机对照试验,以评估和确保Senolytics的安全性、益处和靶点有效性(表1)。如果Senolytics的安全性和有效性首次在目前治疗方法不足的严重疾病患者中得到证实,那么就可以接受对不太严重的衰老相关疾病进行测试。如果对这些情况安全有效,可能会进一步在老年人中测试Senolytics对年龄相关的功能障碍和疾病的预防作用,使用类似TAME研究中计划用于二甲双胍的策略。TAME将测试二甲双胍是否能延缓已经患有第二种年龄相关疾病的患者出现第二种年龄相关疾病,这将是一个不完全纳入健康的老年人的试验。如果延长人类健康寿命的尝试是有效的,未来的研究可能旨在评估Senolytics疗法在延长人类寿命中的作用。
综合治疗策略。针对其他衰老特征的老年科学干预的临床研究目前正在进行或正在计划中。根据对动物模型的研究,饮食干预,如热量限制和间歇性禁食,可能有助于预防与年龄相关的功能障碍和疾病的发展。运动可以延缓衰老细胞的形成,减少小鼠的炎症、虚弱和慢性疾病的发作。二甲双胍、白藜芦醇和雷帕霉素(与雷帕霉素有关的药物)是SASP抑制剂,在一定程度模拟热量限制或锻炼的一些相似的调节过程。Sirtuins促进DNA损伤修复,部分依赖于氧化的NAD+。衰老细胞可以通过SASP激活巨噬细胞表面的NAD降解酶CD38来减少NAD+,值得注意的是,Senolytics部分恢复组织NAD+水平。NAD+或NAD前体可延长实验动物的健康寿命。非女性化的雌激素,17α-雌二醇,在女性和男性中随着年龄的增长而下降,17α-雌二醇治疗延长了小鼠的健康期,缓解了与年龄相关的代谢功能障碍和炎症。如上所述,Senolytics可以增加α‐Klotho水平,α‐Klotho具有老年保护、神经保护作用,并与小鼠的健康寿命有关。有趣的是,α‐Klotho在小鼠中的过表达可增加30%的健康期和寿命。因此,与基本衰老机制的统一理论一致的是,针对不同基本衰老机制的干预措施似乎减轻了衰老表型,延缓、预防或治疗多种疾病,并在临床前模型中延长了健康期。测试这些生活方式、营养、天然产物和药物干预的组合可能会提供信息。然而,如果假设是正确的,它们的作用可能小于相加效应,因为基本的衰老机制是紧密相连的。一个更有前途的策略可能是将衰老医学研究与针对疾病的干预措施结合起来。
总结
消除衰老细胞已成为预防、延缓或减轻多种疾病和与年龄有关的功能障碍的一种可行的治疗策略。Senolytics在临床前模型的结果提示在该领域有治疗和预防的应用前景,有望延缓多重病症和增加健康期。虽然随机对照试验将确定Senolytics策略的安全性和潜在效益,但如果Senolytics要用于临床,必须在近期解决科学和监管方面的挑战(框1)。
一个关键的优先事项应该是确定可靠、灵敏和特异性的老年诊断方法——量化衰老细胞丰度、SASP和Senolytics以及其他衰老特征的生物标志物。调节SASP的干预措施(包括那些专门上调或下调组织破坏因子的干预措施)或外用Senolytics药物,特别是那些消除衰老细胞的促凋亡SASP,可以加速伤口愈合,这一可能性需要实验测试并与老年诊断预测相关。
世卫组织国际疾病分类(ICD)中缺乏对多重病症、骨骼肌减少症、健康期或老年综合征的分类,这是目前衰老临床应用发展的障碍。这种国际疾病分类准则将促进监管部门评估和批准在医院和保险记录中记录与基本衰老过程有关的情况、流行病学研究、医生和医院报销以及制药业参与。人们需要研究基本衰老机制之间可能的相互依赖性,以加深对基本衰老机制和疾病病因的认识,并制定治疗策略以减少多重病症和延长健康期。
最后,需要注意,即使临床前数据很有希望,除非经过仔细监测,严格的临床试验证明Senolytics或SASP抑制剂的安全性和有效性,否则也不应批准它们用于预防或治疗非处方或临床实践中的疾病。与此同时,正在进行的和计划中的临床试验,将为以细胞衰老为衰老相关疾病治疗靶点的研究,提供丰富的数据并加深对其的理解。有可能在不久的将来,小分子Senolytics将转化为临床应用。
框1 科学、后勤和监管的障碍
➤ 需要设计出阻止疫苗或CAR-T细胞等干预措施效果的方法,以防它们在患者中影响有益的基本衰老机制,例如组织修复、伤口愈合或怀孕。
➤ 在临床前模型中似乎有效的干预措施,例如在小鼠身上,往往在临床试验中失败。临床试验失败是不可避免的,这可能成为心理障碍,使该领域止步不前。缓解这一问题的策略可能涉及对不同的衰老医学干预进行多个并行的小型试验(例如,Senolytics vs SASP抑制剂vs NAD+前体vs Sirtuin激活剂vs安慰剂),针对不同的症状,每个症状都与基本的衰老机制相关。这些研究可以在多个机构之间进行,但有共享的结果变量(例如,血液、唾液或尿液的老年诊断、影像学研究、身体特征评估、活动或其他指标和/或问卷调查)。
➤ 目前没有FDA认可的老年诊断作为临床试验的主要结果,也没有任何基于共识的建议来指导研究设计。
➤ 缺乏相关临床状态的ICD编码,如虚弱、多重病症或肌少症。
➤ 鉴于衰老医学领域的重要性和潜力,缺少足够的资金机会和激励来促进进展。
➤ 在基础或临床前衰老医学研究或介入临床试验方面具有专业知识的学术老年病学专家很少,也没有资源来培训足够数量的此类人员。
➤ 偶尔夸大的“抗衰老”宣传和牟取暴利的行为引起了公众怀疑。
➤ 许多公司和企业家对生活方式、天然产品或重新利用专利到期的制剂不感兴趣,这些可能是有效的衰老医学干预措施,但无法实现知识产权保护。
➤ 药品监管机构往往缺乏足够的专业知识和对衰老医学干预措施的熟悉,这可能会大大减缓从实验到临床的转化。
➤ 科研人员、学科和机构之间的学术或资本野心、激励和竞争可能阻碍衰老医学干预措施的发现和测试。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







