Nature子刊:南方医科大学刘克玄团队发现肠缺血再灌注损伤发生发展的新机制
2023-09-22 iNature iNature 发表于上海
该研究揭示了血浆外泌体circEZH2_005有望作为肠I/R肠损伤敏感及特异的诊断生物标志物。
肠缺血再灌注损伤 (Ischemia/Reperfusion, I/R)常见于严重创伤、休克、感染、绞窄性肠梗阻、急性肠系膜缺血及体外循环等多种临床情况。如果及早治疗,急性肠缺血通常可以逆转,延误诊断则会导致多器官功能不全甚至衰竭,死亡率极高。然而目前,由于患者临床表现模糊且缺乏早期特异性诊断生物标志物,肠 I/R 损伤早期诊断十分困难。常用的肠损伤诊断标志物包括肠脂肪酸结合蛋白(I-FABP)、二胺氧化酶 (DAO)、谷胱甘肽 S 转移酶、瓜氨酸、平滑肌蛋白(SM22)等。I-FABP 在肠粘膜上皮细胞损伤后被释放到循环中,目前被认为是早期识别肠缺血和损伤的一个较敏感的标志物。然而,I-FABP 水平在其他类型的小肠疾病中也会升高,如急性小肠结肠炎、克罗恩病和单纯性肠梗阻,影响了其特异性[1]。SM22能够及时检测肠肌层严重的缺血性损害,而不能及时发现早期肠粘膜损伤[2]。总体而言,现有的血清、尿液及组织中的标志物诊断效能依然较低,迫切需要寻找更加敏感和更具肠道特异性的肠损伤标志物。

肠 I/R 肠损伤的机制目前尚未阐明,我们研究团队及他人研究表明,肠 I/R 引起的肠损伤与缺血缺氧导致能量生成减少,进而大量钙离子进入细胞诱导细胞膜损伤有关[3]。细胞受损时释放的炎性介质又进一步触发炎症反应,导致大量的白细胞黏附及释放、活性氧自由基堆积、补体激活,从而进一步加重细胞凋亡、坏死等[4]。根据肠 I/R 损伤机理,目前的治疗策略如抑制炎症反应、改善免疫微环境以及缺血预处理等,均有一定的保护效果[5-6]。然而,由于目前仍缺乏针对肠粘膜上皮损伤的可调控靶点,以上防治方法依然不能有效降低肠 I/R导致的不良后果。因此,阐明肠 I/R 发生发展的新机制,开发针对肠 I/R 肠粘膜上皮损伤的创新治疗策略至关重要。
2023年9月6日,南方医科大学南方医院麻醉科刘克玄教授团队在Nature Communications 杂志在线发表了题为“Exosomal circEZH2_005, an intestinal injury biomarker, alleviates intestinal ischemia/reperfusion injury by mediating Gprc5a signaling”的工作。该研究揭示了血浆外泌体circEZH2_005有望作为肠I/R肠损伤敏感及特异的诊断生物标志物,而且提出靶向circEZH2_005/hnRNPA 1/Gprc5a信号轴可能是肠I/R损伤的潜在治疗策略。
在本研究中,研究人员首先通过超高速离心及密度梯度离心方法提取了肠I/R小鼠肠组织外泌体(图1a-c),接着通过circRNA高通量测序技术鉴定了肠I/R小鼠肠组织外泌体circRNA表达谱 (图1d-f)。进一步在小鼠肠组织、肠组织外泌体、血浆外泌体中筛选验证发现circEZH2_005在肠I/R后的肠组织外泌体及血浆外泌体中表达降低,且其表达与肠损伤严重程度呈负相关(图1g, h)。这一发现支持将血浆外泌体circEZH2_005作为肠I/R肠损伤诊断标志物的可能性。
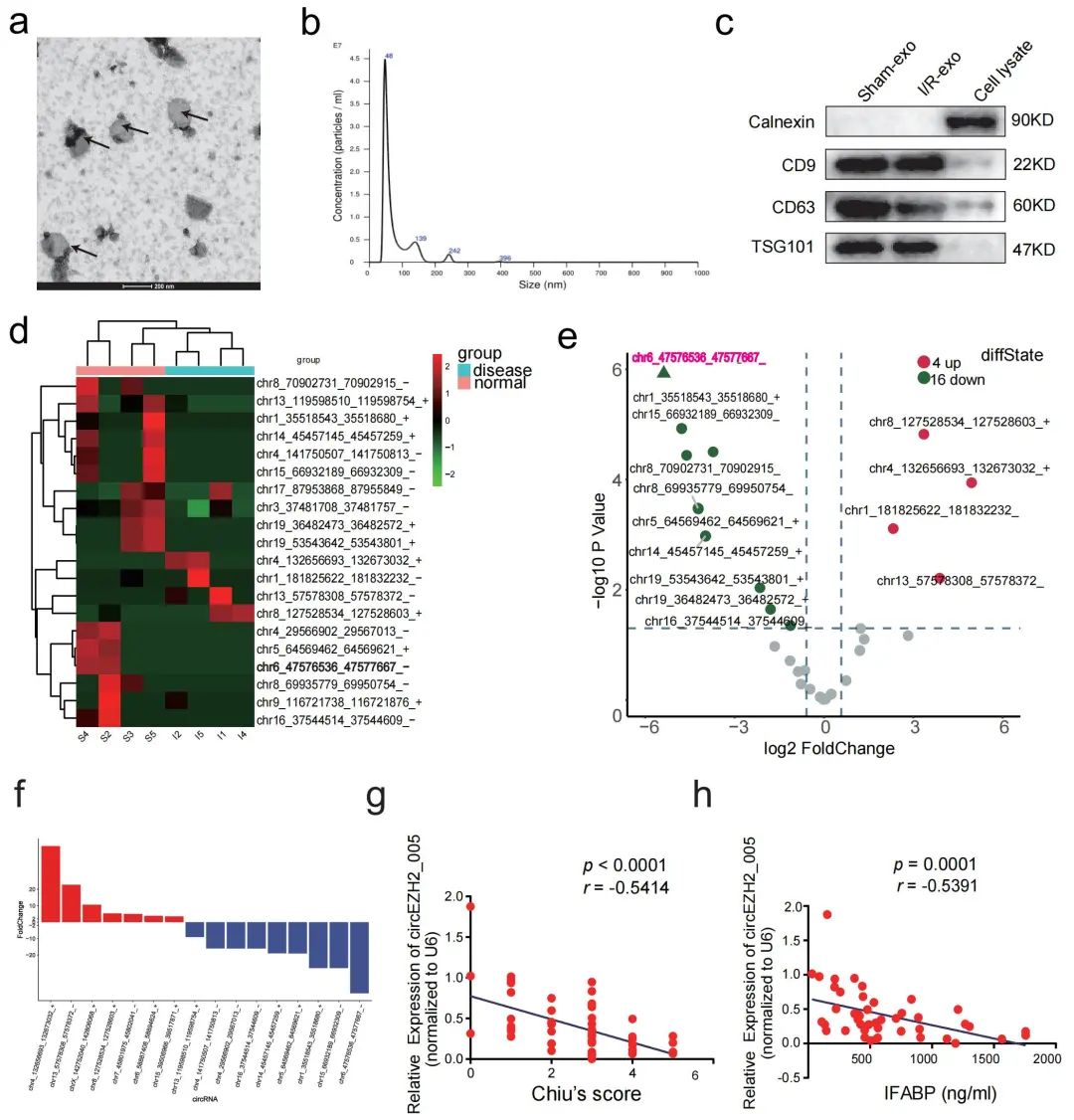
图1. 外泌体circEZH2_005表达与I/R诱导的肠损伤相关
接着,研究人员发现circEZH2_005在人和小鼠之间具有高度同源性,因此该团队采用接受体外循环(cardiopulmonary bypass,CPB)心脏手术患者的血浆标本进行临床验证。结果如图2所示:在39例术后发生胃肠功能障碍的患者中,血浆外泌体circEZH2_005的表达在手术后即刻降低,在再灌注后6小时达到峰值,并且circEZH2_005的表达水平与I-FABP及D-Lactate的表达呈负相关(图2a, f, g)。进一步通过制作ROC曲线发现,血浆外泌体circEZH2_005能够良好的区分术后发生肠损伤的患者,其曲线下面积(AUC)值为0.732,当其与肠损伤现有标志物IFABP进行联合诊断时,诊断效能提高至0.846,反映了良好的临床应用价值(图2d)。此外,circEZH2_005的表达和肠损伤AGI评分呈负相关(图2h)。这些数据提示外泌体circEZH2_005可能是术后诊断肠损伤的潜在生物标志物。
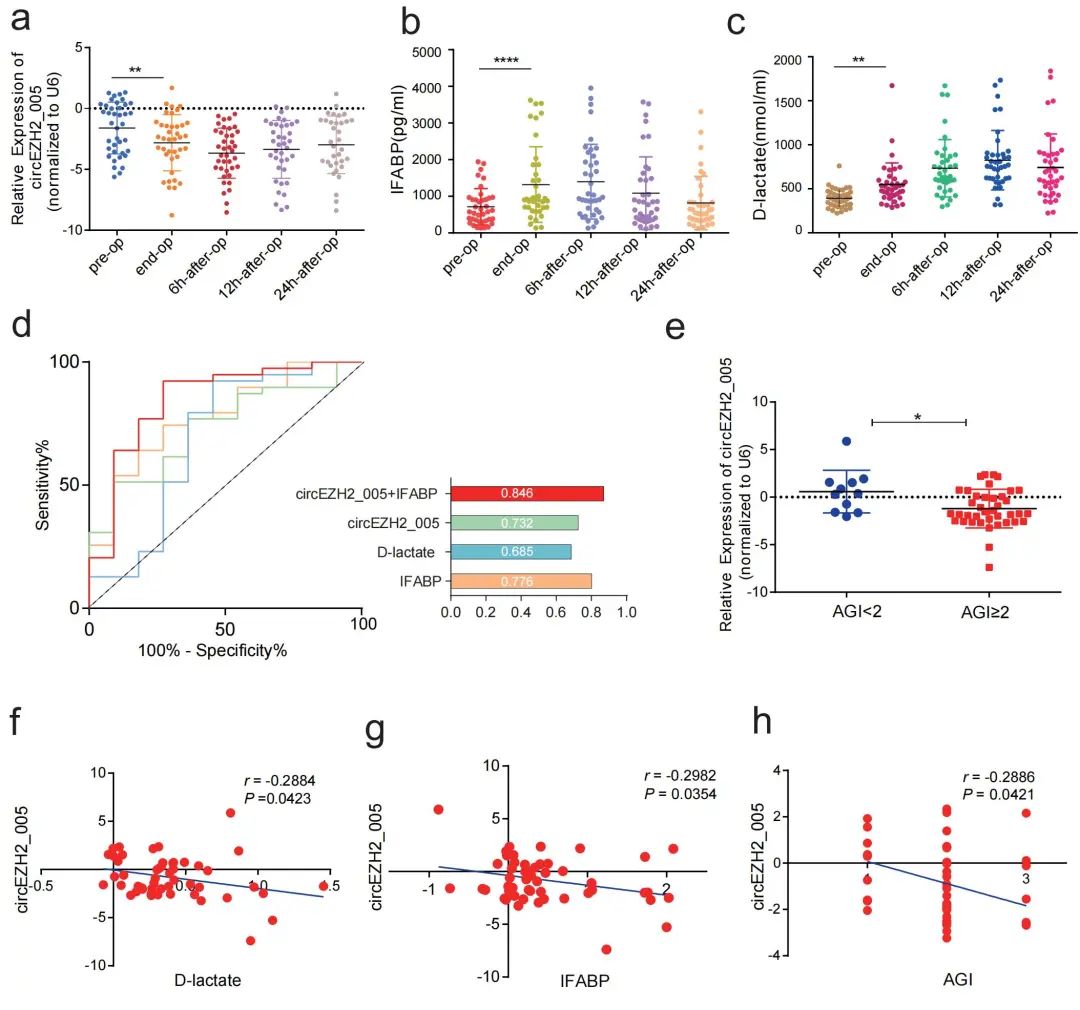
图2. 外泌体circEZH2_005在体外循环术后患者血浆中的表达
此外,研究者进一步检测circEZH2_005的组织器官表达特异性,发现circEZH2_005在小鼠肠组织中的表达均高于肝、肾、脑和肺组织(图3b)。同时FISH检测circEZH2_005在肠组织中的定位情况,发现circEZH2_005主要表达于肠隠窝细胞,与Lgr5+隐窝干细胞具有明显共定位,且随着肠损伤的加重circEZH2_005在肠隠窝干细胞中的表达显著降低(图3e-g),此结果提示circEZH2_005可能在肠I/R肠隠窝干细胞损伤修复中发挥重要的功能。

图3. circEZH2_005在肠组织中的表达及定位
进一步,该团队采用小鼠肠I/R在体模型和小肠类器官离体模型探讨了circEZH2_005在肠I/R中的作用,发现circEZH2_005可以促进H/R损伤后的小肠隐窝干细胞的增殖(图4)。此外过表达circEZH2_005明显减轻I/R诱导的肠绒毛高度和隐窝深度的降低,逆转了I/R诱导的肠隠窝干细胞数量的减少(图5)。这些结果表明circEZH2_005可以通过促进小肠隐窝干细胞的增殖来修复肠道I/R损伤。
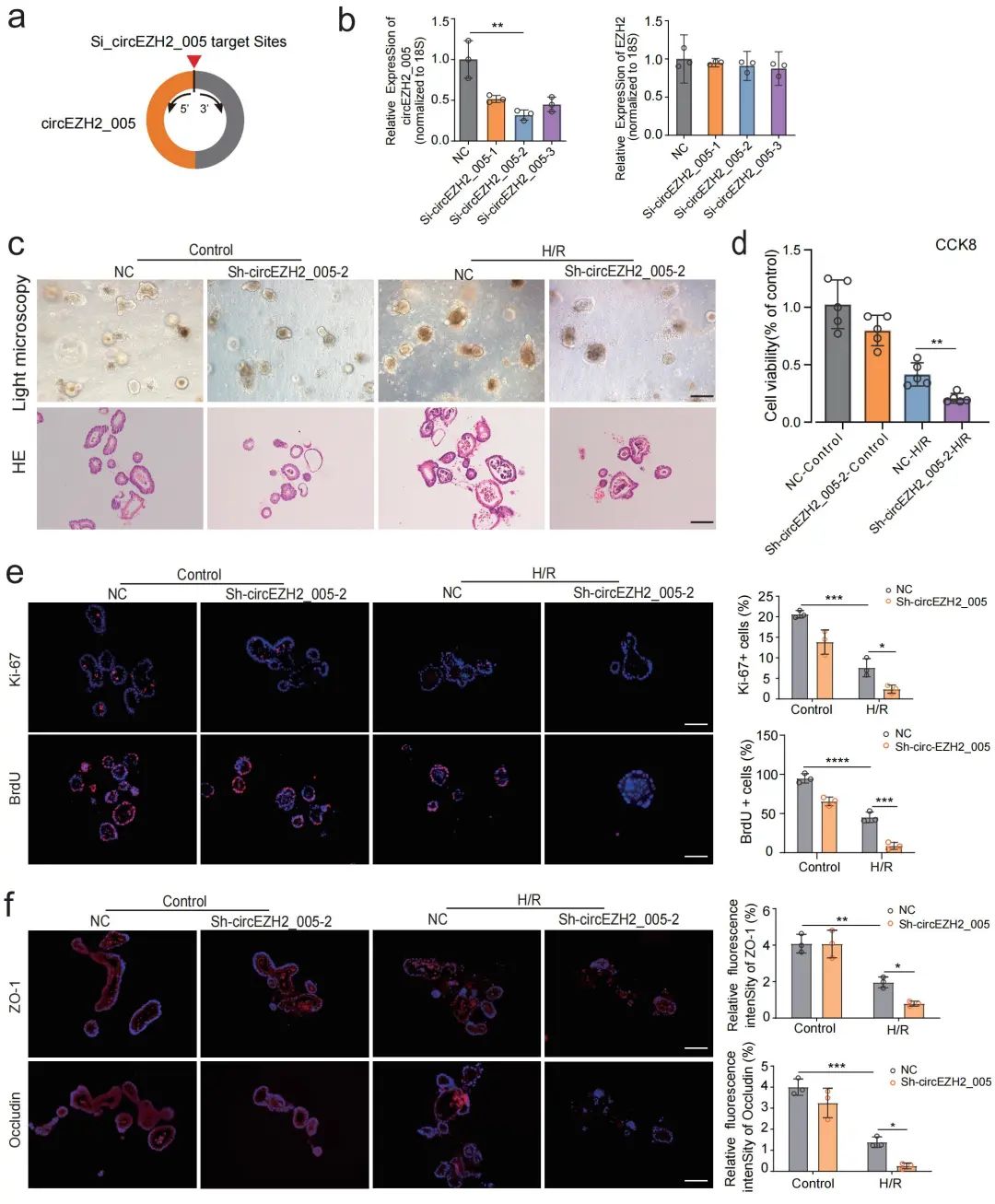
图4.circEZH2_005在体外可保护肠道类器官免受H/R损伤
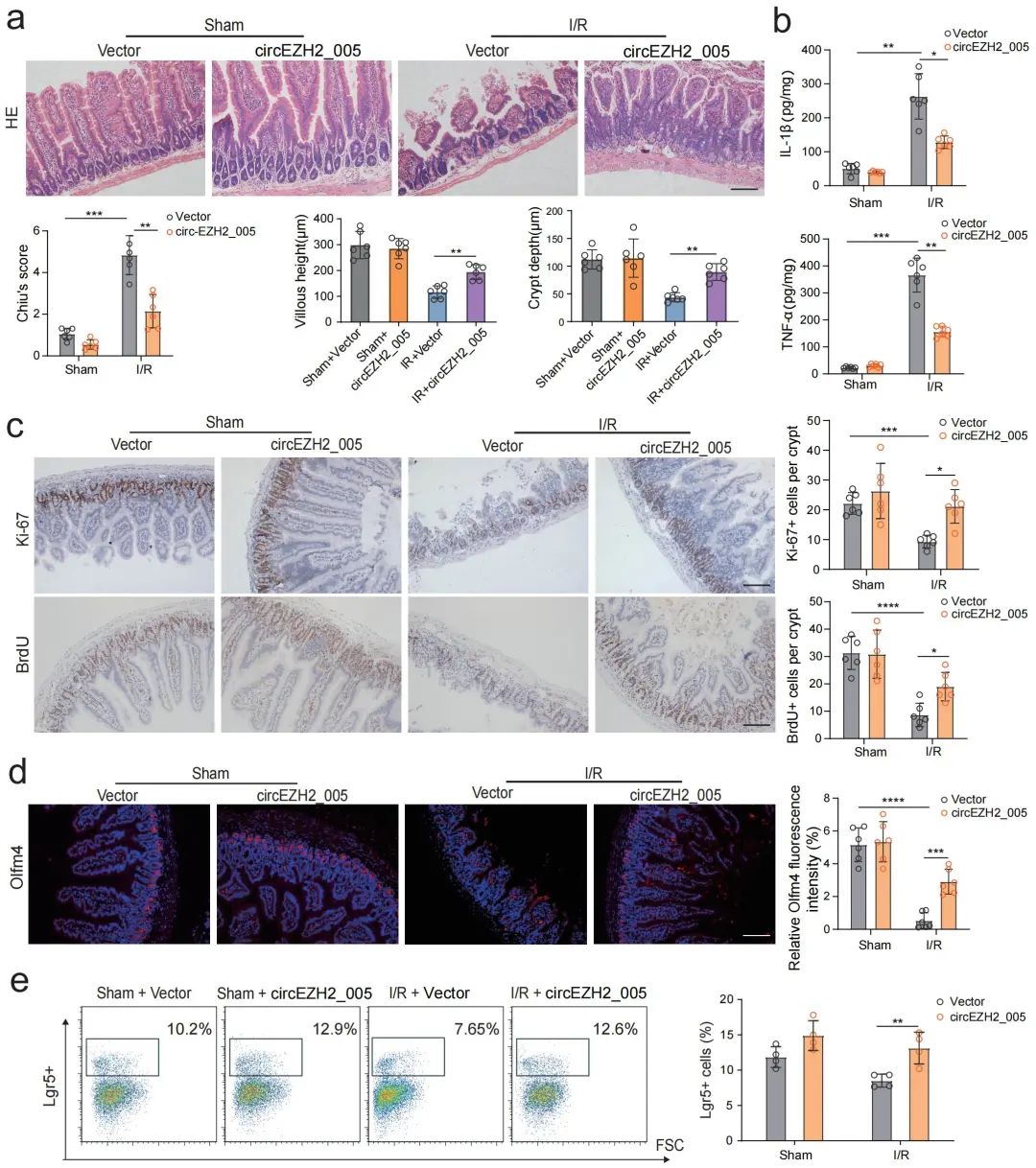
图5. circEZH2_005改善体内I/R诱导的肠I/R损伤
最后,为了探索circEZH2_005调控肠隐窝干细胞的潜在机制,研究人员通过RNA pull-down和蛋白质组学分析鉴定了与circEZH2_005特异性相互作用的蛋白(图6a,b)。数据库预测分析和RIP实验证实了hnRNPA1是circEZH2_005的RBP候选蛋白(图6c,d)。此外,当hnRNPA1响应I/R刺激定位于细胞核时,可观察到circEZH2_005对hnRNPA1的调节作用。circEZH2_005的敲低降低了hnRNPA1的细胞质水平,而circEZH2_005过表达促进了hnRNPA1蛋白从细胞核向细胞质的输出(图6e,f)。进一步的实验显示,hnRNPA1的RNA识别基序2(RRM2)结构域是circEZH2_005结合所必需的,且hnRNPA1是与circEZH2_005的171 -252nt片段结合(图6h-i)。

图6. HnRNPA1与隐窝干细胞中的circEZH2_005结合并促进其细胞质易位
由于hnRNPA1在调控mRNA合成、稳定性和翻译中起关键作用。因此,研究人员通过RNA转录组测序来评估过表达circEZH2_005的肠隐窝细胞(图7a,b)。结果发现Gprc5a上调最明显,且预测与hnRNPA1结合(图7c,g)。沉默Gprc5a加重了类器官H/R损伤,在功能上消除了circEZH2_005对H/R损伤的类器官保护作用(图7e,f)。进一步的RIP实验证实了hnRNPA1与Gprc5a mRNA结合,并且沉默hnRNPA1降低了Gprc5a mRNA的稳定性(图7h)。此外,研究发现circEZH2_005敲低或过表达可降低或增加Gprc5a mRNA与hnRNPA1的结合(图7j,k)。另外,circEZH2_005可调节Gprc5a mRNA的稳定性,这种作用可被hnRNPA1逆转(图7i)。这些结果表明circEZH2_005通过与hnRNPA1结合提高Gprc5a的稳定性,从而促进肠I/R损伤期间ISC的增殖。
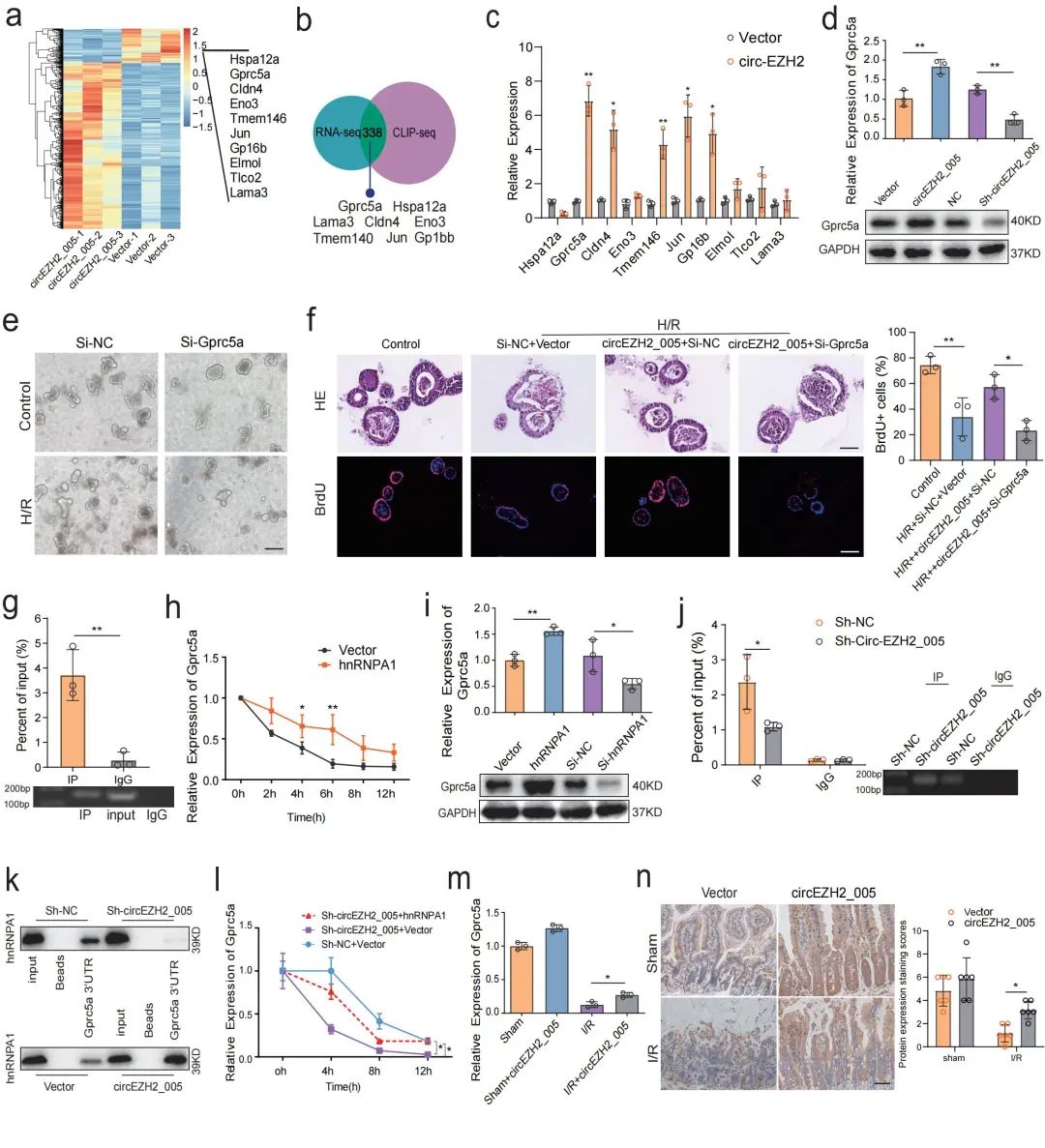
图7. CircEZH2_005通过稳定Gprc5a预防肠道I/R损伤
综上所述,研究人员综合利用肠I/R动物模型、体外循环(cardiopulmonary bypass,CPB)心脏手术临床模型、小肠类器官H/R模型和分子生物学等技术手段,揭示了一个与肠I/R肠损伤相关的外泌体circRNA分子 circEZH2_005,证实了外泌体 circEZH2_005可以有效地区分术后肠I/R肠损伤患者和非肠损伤患者。circEZH2_005在小肠隠窝干细胞中高表达,通过与hnRNPA1直接相互作用增强缺氧诱导相关蛋白Gprc5a的稳定性促进隐窝干细胞增殖,从而减轻I/R诱导的肠粘膜损伤(图8)。因此,该研究不仅为肠I/R肠道损伤的早期检测提供了一种有希望的非侵入性生物标志物,而且为防止肠I/R损伤的治疗策略开辟了一条新途径。
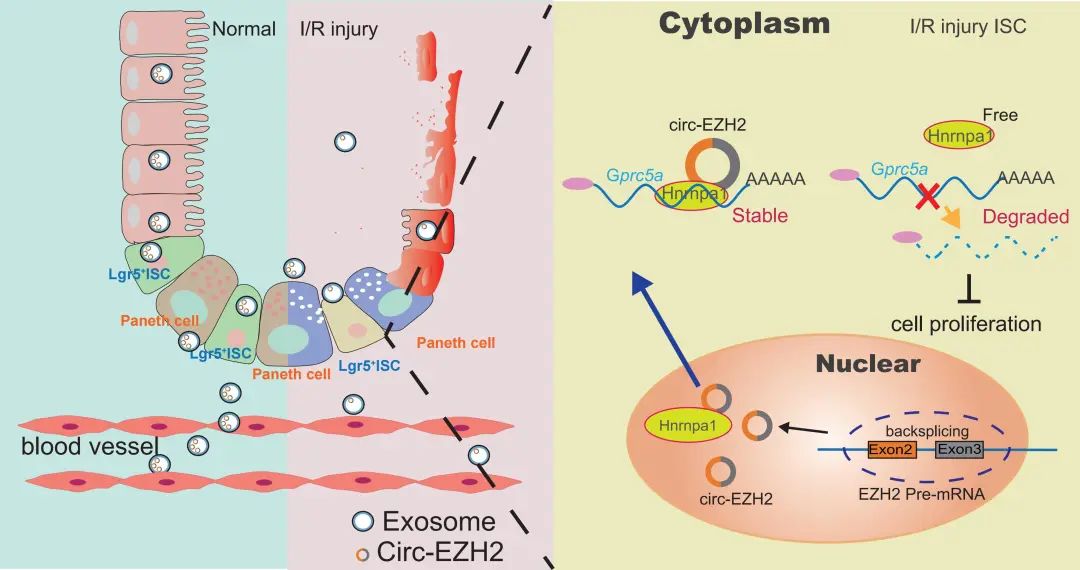
图8 circEZH2_005保护肠I/R肠损伤的分子机制示意图
南方医院麻醉科张文娟博士和周柏伟博士后为论文共同第一作者,刘克玄教授和李偲教授为论文通讯作者。
参考消息:
https://www.nature.com/articles/s41467-023-41147-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







