盘点2023|钱红纲教授:2023年度肝癌系统治疗进展
2024-02-22 医悦汇 医悦汇 发表于上海
2023年肝癌治疗研究领域进展颇丰,一些大型临床研究公布了最新更新的数据和阳性结果,一些早期的临床研究也展现出值得期待的应用前景。在此,特将2023年国内外肝癌领域的一些研究进展汇总如下。
盘点2023 肝癌系统治疗进展
根据2023年癌症事实与数据报告,肝癌是导致癌症死亡的第二大原因,预计2023年将有约85万人死于肝癌。2023年肝癌治疗研究领域进展颇丰,一些大型临床研究公布了最新更新的数据和阳性结果,一些早期的临床研究也展现出值得期待的应用前景。在此,特将2023年国内外肝癌领域的一些研究进展汇总如下。
1 新辅助治疗
2023年ASCO会议上一项国内多中心前瞻性III期临床研究结果显示,对于可手术切除的超出米兰标准的BCLC A/B期肝细胞癌患者,采用术前新辅助FOLFOX方案肝动脉灌注化疗(HAIC),较直接手术的患者显著延长了OS和PFS(表1),而且相关不良事件未明显增多,ITT人群97.9%出现0~2级的HAIC相关不良事件(HRAEs),程度均较轻且可逆。两组的手术相关不良事件(ORAEs)相似(P=0.265)[1]。
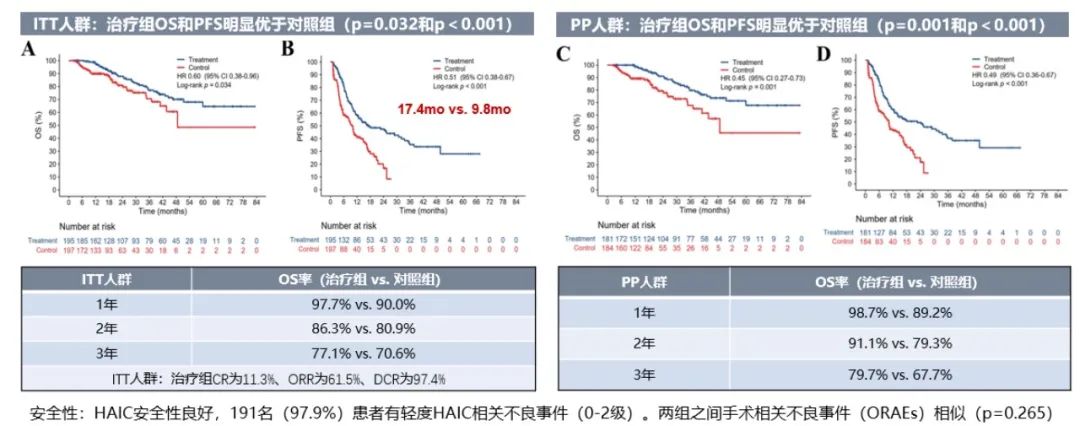
表1 可手术切除的超出米兰标准的BCLC A/B期肝细胞癌患者新辅助治疗组(治疗组)与直接手术组(对照组)比较
一些临床常用的靶免联合方案在术前新辅助方面的应用也到了初步的研究结果。2023ASCO会议发布了国内一项替雷利珠单抗联合仑伐替尼的新辅助治疗单臂II期临床研究结果,提示主要病理缓解率(mPR)和病理完全缓解率(pCR)分别为35.3%(6/17)和17.6%(3/17)[2]。一项针对CNLC Ⅰb-Ⅲa期中高复发风险肝癌患者的2/3期临床研究前期结果显示,卡瑞利珠单抗联合阿帕替尼新辅助治疗(研究组)与直接手术(对照组)对比,研究组的mPR较高,达40%(24/60),且安全可耐受[3]。提示肝癌新辅助靶免联合的疗效较好,但仍需大样本RCT研究证实。
另一项前瞻性随机对照研究结论提示,可切除单发乙肝相关肝癌病灶易伴有微血管侵犯(MVI),新辅助放疗的ORR为25%(7/28),且毒副反应轻微[4],提示术前放疗在肝癌免疫治疗时代也不失为一种选择。
2023年12月,中华外科杂志发表了由中国研究型医院学会和中国抗癌协会联合发布的《肝癌新辅助治疗中国专家共识(2023版)》,集中展示了近年,包括2023年肝癌新辅助治疗的进展和可选择方法,值得广泛的学习和临床应用[5]。
2 转化治疗
目前尚无Ⅲ期临床研究结论公布,多为小样本Ⅱ期临床研究或回顾性研究结论。
一项前瞻性单臂II期临床研究结果提示,33例局部晚期不可切除肝癌患者,经序贯TACE、立体定向放疗(SBRT)和抗PD-L1单克隆抗体阿维鲁单抗(Avelumab)等转化治疗后,55%(18/33)的患者获得了根治机会[6]。另一项前瞻单臂II期研究,纳入了56例不可切除BCLC B/C期HCC患者,给予仑伐替尼联合PD-1抑制剂,转化成功率为55.4%(31/56), ORR53.6%,中位OS为23.9个月,R0手术转化率达85.7%(21/31)[7]。此结论亦在2023年ESMO会议发布。同期会议中,国内的一项替雷利珠单抗联合TKIs和FOLFOX4-HAIC转化治疗研究结论提示,ORR为93.9%(31/33),其中75.8%(25/33)达完全缓解,R0手术转化率为69.7%(23/33),不良事件均可耐受[8]。
日本一项多中心概念验证研究(Proof-Of-Concept Study, POC study)提示,在不可切除且不适合TACE介入治疗的110例中期肝细胞癌患者中,阿替利珠单抗联合贝伐珠单抗获得的临床或病理完全缓解(CR)率为34.5%(38/110),其中7例获得手术切除,22.7%(25/110)的患者获得根治后无需后续药物治疗状态(drug-free status)[9]。
转化治疗可为初始不可切肝癌患者争取根治性手术机会,但转化成功的影响因素较多,如不可切除的定义等。因此,我们需要注意在进行转化治疗临床研究时科学界定相应人群并设置合理的主要研究终点。
3 辅助治疗
IMbrave050研究作为首个取得阳性结果的HCC辅助治疗III期临床试验,其结论为肝癌的术后辅助治疗提供了坚实的依据[10]。研究探索了“T+A”方案在肝细胞癌根治性手术或消融治疗后辅助治疗的疗效和安全性(图1)。668例接受了根治或消融术的患者,采用T+A治疗后,RFS显示出统计显著性以及有临床意义的改善,复发风险下降28%(HR, 0.72 [95% CI: 0.56, 0.93]; P=0.012),安全性(试验组和对照组发生≥3级AE比例41% vs.13%)可控、可管理(图2)。
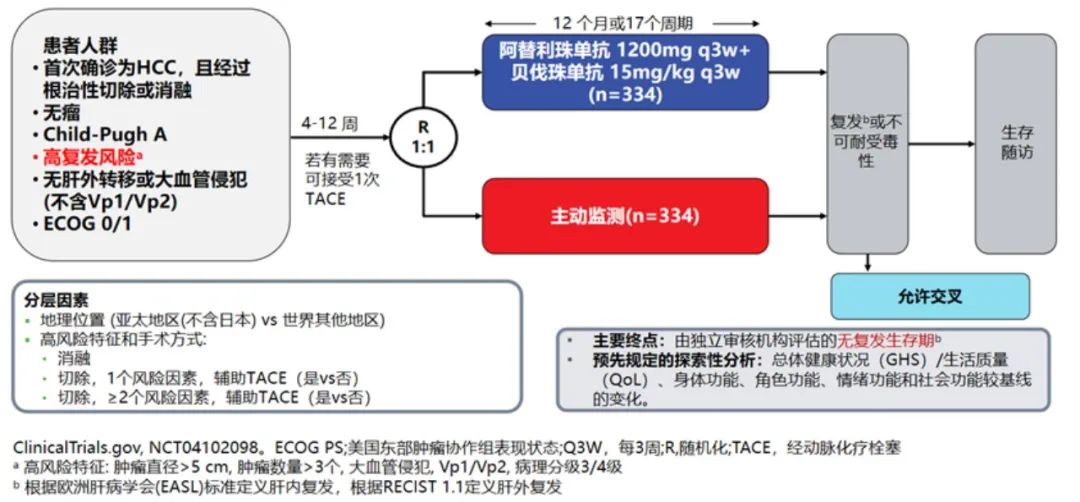
图1 IMbrave050研究设计

图2 IMbrave050研究结果
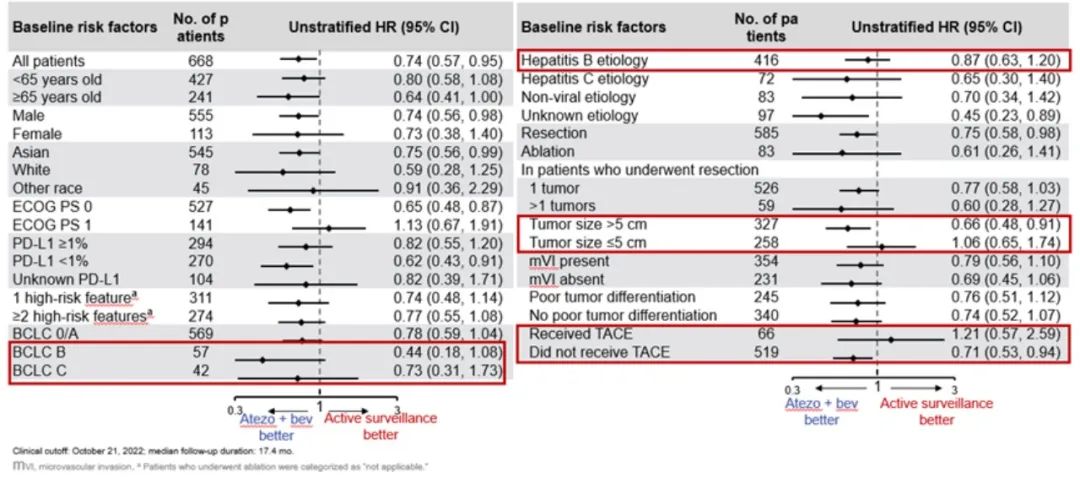
图3 IMbrave050研究设计
虽然IMbrave050研究获得了广泛瞩目,但仍需要我们深入思考的是:其研究设计尚存在较多争议,比如未采用安慰剂对照,主要终点设置RFS并非OS,而临床上术后辅助治疗的主要目标是延长总体生存期。另外为何PD-L1<1%的患者疗效更好,为何HBV患者的获益有限,而联合TACE的患者反而疗效一般等等(图3)。本项研究的RFS获益是否能转化为OS获益,值得期待。
国内发表的另外一项关于术后辅助HAIC介入治疗的多中心III期随机研究提示[11],合并微血管侵犯者,在根治术后应用FOLFOX-HAIC,能显著延长DFS(20.3个月 vs. 10.0个月,HR 0.59,P=0.001),且不良事件可控。国内的另一项多中心回顾性队列研究也证明[12],伴有微血管侵犯的HCC患者,根治术后接受TACE治疗者,DFS及OS均显著延长,再次证明了介入治疗在肝癌辅助治疗中的重要地位。
2023年ASCO GI上发表的一项国内多中心III期临床研究探索了索拉非尼联合TACE治疗在合并PVTT肝细胞癌患者术后辅助治疗的疗效和安全性(图4)。术后索拉非尼+TACE联合辅助治疗组,能够获得显著优势的RFS(16.8个月 vs. 12.6个月,HR 0.57,P=0.002)和OS(30.4个月 vs. 22.5个月,HR 0.57,P=0.017),且具有良好的耐受性[13]。从亚组分析来看,年龄≤50岁,男性、非HBV+HCC、多个肿瘤、主要肿瘤≥5cm患者的OS获益较明显。
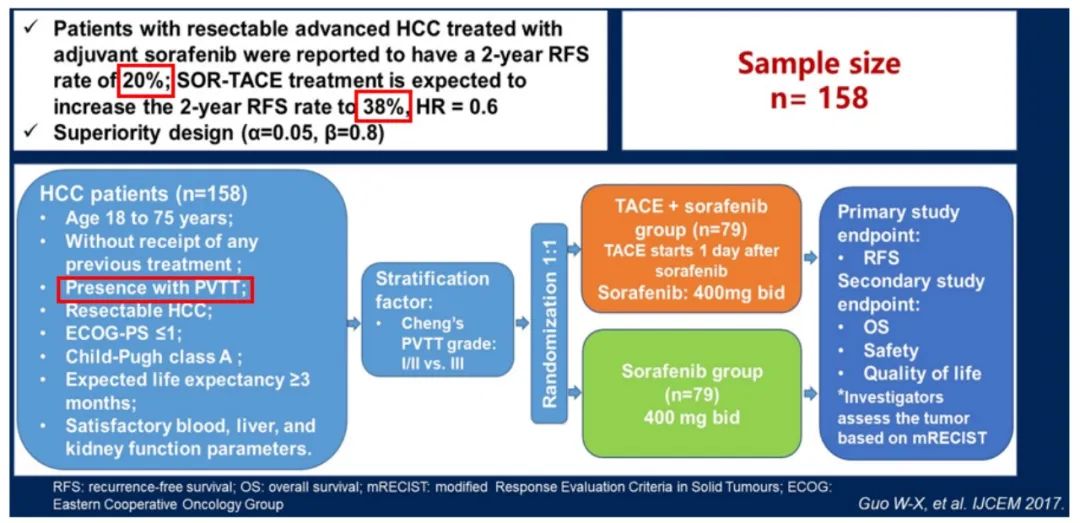
图4 SOR-TACE研究
4 晚期治疗
2023年WCGIC大会上公布了具有里程碑式的HIMALAYA研究(抗PD-L1度伐利尤单抗+抗CTLA-4替西木单抗的双免方案)最新随访结果(图5-9),STRIDE雷管方案作为晚期一线治疗的方案,4年OS率高达25.2%(索拉非尼组19.8%)。这也是目前唯一公布4年OS随访结果的Ⅲ期临床研究。其中达到疾病控制(Disease Control,DC)效果的患者,有更佳的获益趋势,3年OS率达44.6%,4年OS率达36.2%,且安全性可控,免疫不良反应可管理[14]。这也侧面反映了免疫治疗长期生存获益的特点,即使最佳疗效仅为疾病稳定(SD)的患者,仍然能从双免治疗(STRIDE)方案中得到生存获益。

图5 HIMALAYA研究
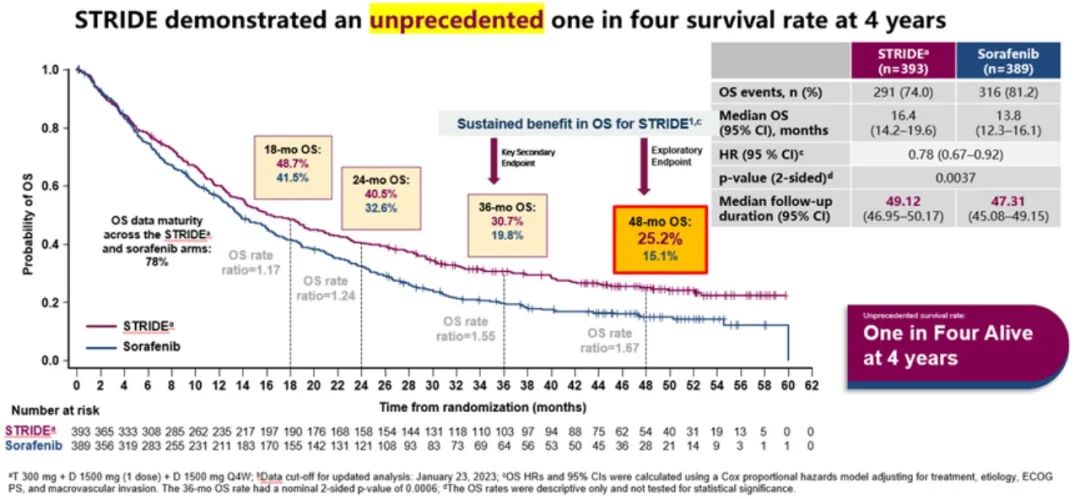
图6 HIMALAYA研究
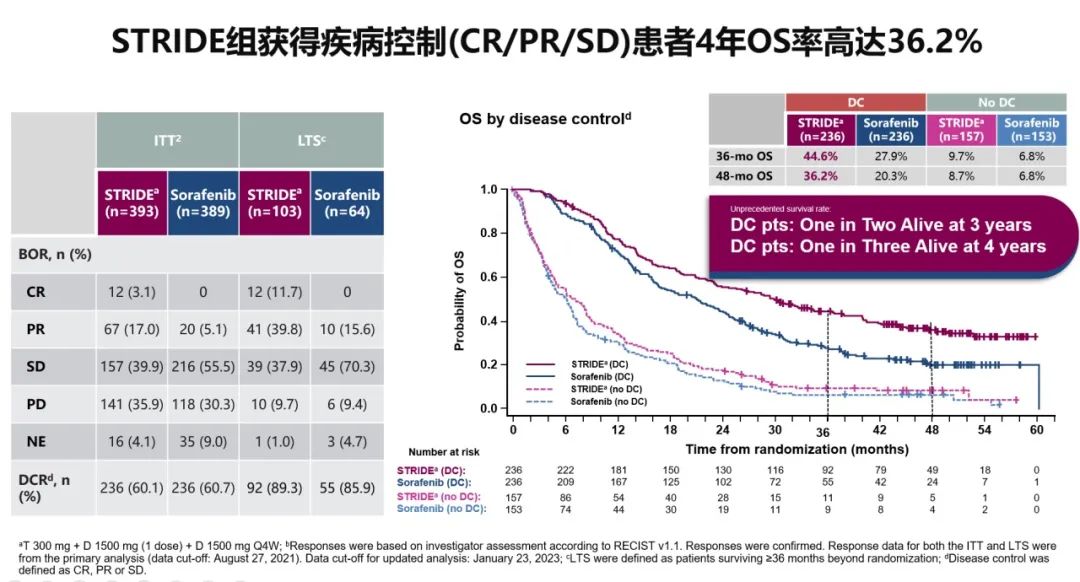
图7 HIMALAYA研究
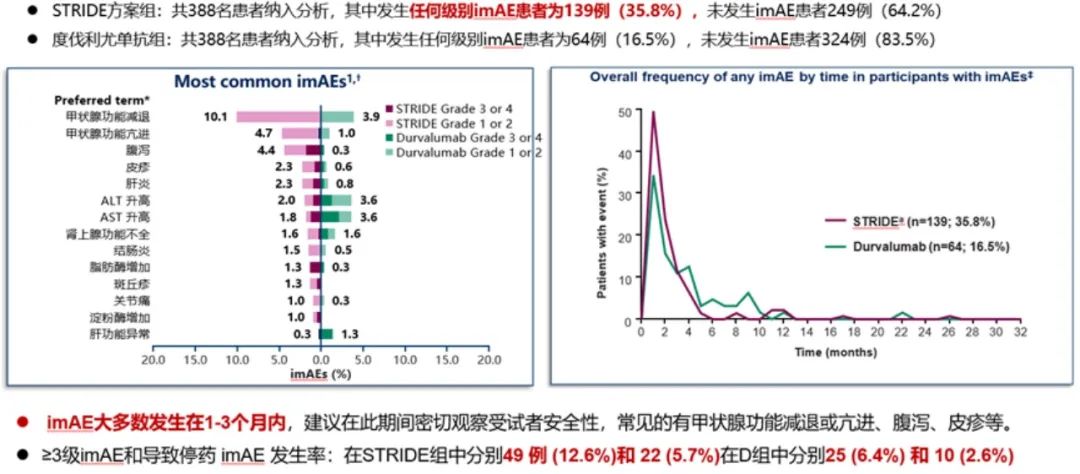
图8 HIMALAYA研究
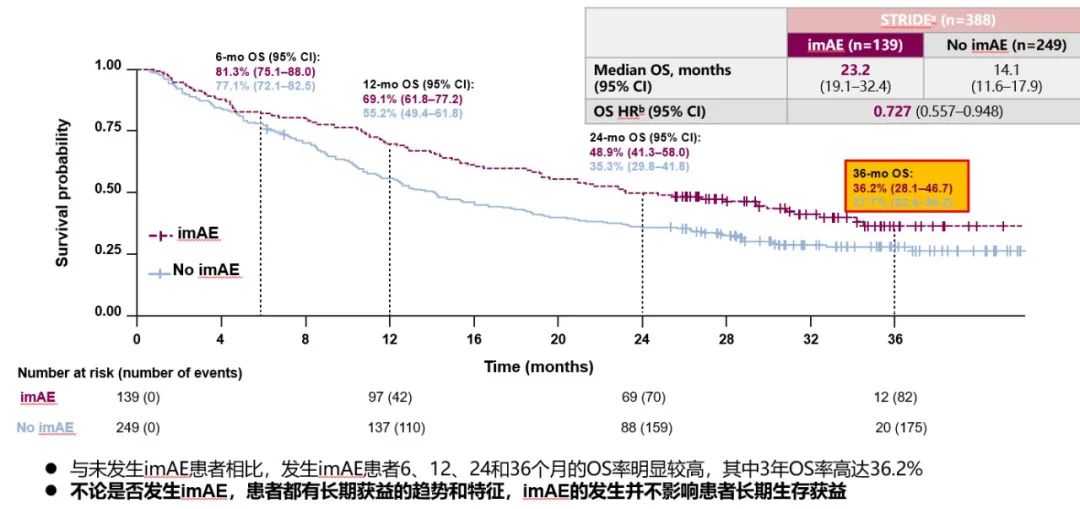
图9 HIMALAYA研究
Emerald-1研究[15]着力于在失去根治机会、此前未接受过TACE或系统治疗的HCC患者中,采用TACE[包括传统TACE、药物缓释微球肝动脉化疗栓塞术(DEB-TACE两种模式)]联合度伐利尤单抗±贝伐单抗治疗的疗效和安全性。结果显示,D+B+TACE与TACE相比,PFS显著改善(15.0 vs. 8.2个月, HR0.77, 95% CI, 0.61–0.98, p=0.032)。也预示着晚期肝癌正式进入TACE联合靶免治疗时代。
此外,CARES-310研究[16]结果显示,使用卡瑞利珠单抗联合阿帕替尼对比索拉非尼用于晚期一线治疗, PFS(5.6 vs. 3.7个月,HR 0.52,P<0.0001)和OS(22.1 vs. 15.2个月,HR 0.62,P<0.0001)均显著改善,为晚期肝癌提供新的治疗组合方案。
总之,对于肝癌患者的治疗,临床专家需要在紧跟最新研究进展的同时,细致的观察入组患者基线,从循证医学的角度谨慎参考较早期临床研究的初步结论,理清治疗思路,为患者提供遵循指南兼具个性化的最适治疗。我们也期待在未来的工作中,临床专家能在符合规范的前提下,大胆创新,开展更适合中国人群的临床试验,为肝癌患者提供更获益的治疗方案。
参考文献
[1] Wei Wei, Shaohua Li, Rongce Zhao, et al. Neoadjuvant hepatic arterial infusion chemotherapy with FOLFOX could improve outcomes of resectable BCLC stage A/B hepatocellular carcinoma patients beyond Milan criteria: a multi-center, phase 3, randomized, controlled clinical trial. ASCO 2023 (Abstract 4023), https://doi.org/10.1200/JCO.2023.41.16_suppl.4023.
[2] SONG T Q. A prospective, single-arm, phase II clinical study of tislelizumab in combination with lenvatinib for perioperative treatment of resectable primary hepatocellular carcinoma with high risk of recurrence. ASCO 2023 (Abstract e16218), https://doi.org/10.1200/JCO.2023.41.16_suppl.e16218.
[3] ZHOU J, FAN J, Fang-Ming Gu, et al. A phase Ⅱ/Ⅲ study of camrelizumab plus apatinib as perioperative treatment of resectable hepatocellular carcinoma at intermediate-high risk of recurrence: primary results of major pathologic response from phase Ⅱ stage. ASCO 2023 (Abstract 4126). https://doi.org/10.1200/JCO.2023.41.16_suppl.4126.
[4] Wei X, Jiang Y, Feng S, et al. Neoadjuvant intensity modulated radiotherapy for a single and small (≤5 cm) hepatitis B virus-related hepatocellular carcinoma predicted to have high risks of microvascular invasion: a randomized clinical trial[J]. Int J Surg, 2023,109(10):3052-3060. DOI: 10.1097/JS9.0000000000000574.
[5] 肝癌新辅助治疗中国专家共识协作组, 中国研究型医院学会消化外科专业委员会, 中国抗癌协会肝癌专业委员会. 肝癌新辅助治疗中国专家共识(2023版)[J]. 中华外科杂志,2023,61(12):1035-1045. DOI: 10.3760/cma.j.cn112139-20230914-00121.
[6] Chiang CL, Chiu K, Chan K, et al. Sequential transarterial chemoembolisation and stereotactic body radiotherapy followed by immunotherapy as conversion therapy for patients with locally advanced, unresectable hepatocellular carcinoma (START-FIT): a single-arm, phase 2 trial[J]. Lancet Gastroenterol Hepatol, 2023,8(2):169-178. DOI: 10.1016/S2468-1253(22)00339-9.
[7] Zhang W, Tong S, Hu B, et al. Lenvatinib plus anti-PD-1 antibodies as conversion therapy for patients with unresectable intermediate-advanced hepatocellular carcinoma: a single-arm, phase II trial[J]. J Immunother Cancer, 2023,11(9):e007366. DOI: 10.1136/jitc-2023-007366.
[8] Kai Tan, Xiaojun He, Li Zang, et al. Efficacy and safety of tislelizumab combined with TKIs and FOLFOX4-HAIC in conversion therapy of unresectable hepatocellular carcinoma.ESMO 2023 (Abstract 1002P), ESMO Congress 2023 | OncologyPRO.
[9] Kudo M, Aoki T, Ueshima K, et al. Achievement of Complete Response and Drug-Free Status by Atezolizumab plus Bevacizumab Combined with or without Curative Conversion in Patients with Transarterial Chemoembolization-Unsuitable, Intermediate-Stage Hepatocellular Carcinoma: A Multicenter Proof-Of-Concept Study[J]. Liver Cancer, 2023,12(4):321-338. DOI: 10.1159/000529574.
[10] Qin S, Chen M, Cheng AL, et al. Atezolizumab plus bevacizumab versus active surveillance in patients with resected or ablated high-risk hepatocellular carcinoma (IMbrave050): a randomised, open-label, multicentre, phase 3 trial[J]. Lancet, 2023,402(10415):1835-1847. DOI: 10.1016/S0140-6736(23)01796-8.
[11] Li SH, Mei J, Cheng Y, et al. Postoperative Adjuvant Hepatic Arterial Infusion Chemotherapy With FOLFOX in Hepatocellular Carcinoma With Microvascular Invasion: A Multicenter, Phase III, Randomized Study[J]. J Clin Oncol, 2023,41(10):1898-1908. DOI: 10.1200/JCO.22.01142.
[12] Luo L, Shan R, Cui L, et al. Postoperative adjuvant transarterial chemoembolisation improves survival of hepatocellular carcinoma patients with microvascular invasion: A multicenter retrospective cohort[J]. United European Gastroenterol J, 2023,11(2):228-241. DOI: 10.1002/ueg2.12365.
[13] Ming Kuang, Zhenwei Peng, Wenzhe Fan, et al. Adjuvant transarterial chemoembolization with sorafenib for patients with hepatocellular carcinoma with portal vein tumor thrombus after surgery: A phase III, multicenter, randomized, controlled trial. ASCO 2023 (Abstract 493), https://doi.org/10.1200/JCO.2023.41.4_suppl.493.
[14] George Lau, Ann-Lii Cheng, Bruno Sangro, et al. Outcomes by occurrence of immune-mediated adverse events (imAEs) with tremelimumab (T) plus durvalumab (D) in the phase 3 HIMALAYA study in unresectable hepatocellular carcinoma (uHCC). ASCO 2023 (Abstract 4004), https://doi.org/10.1200/JCO.2023.41.16_suppl.4004.
[15] Riccardo Lencioni, Masatoshi Kudo, Joseph Erinjeri, et al. EMERALD-1: A phase 3, randomized, placebo-controlled study of transarterial chemoembolization combined with durvalumab with or without bevacizumab in participants with unresectable hepatocellular carcinoma eligible for embolization. Journal of Clinical Oncology Volume 42, Number 3_suppl. https://doi.org/10.1200/JCO.2024.42.3_suppl.LBA432.
[16] Qin S, Chan SL, Gu S, et al. Camrelizumab plus rivoceranib versus sorafenib as first-line therapy for unresectable hepatocellular carcinoma (CARES-310): a randomised, open-label, international phase 3 study[J]. Lancet, 2023,402(10408):1133-1146. DOI: 10.1016/S0140-6736(23)00961-3.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#肝癌# #系统治疗#
25