Cancer Cell:神经母细胞瘤新方案:靶向ALK的CAR T与ALK抑制剂联合治疗
2024-01-02 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
作者团队开发了一款新型ALK.CAR-T 细胞,并在临床前模型中证明了ALK.CAR-T单药或联合ALK抑制剂治疗神经母细胞瘤的疗效及安全性。
神经母细胞瘤是儿童期颅外实体瘤中最常见的一种,约占儿童癌症相关死亡的12%-15%。复发/难治性神经母细胞瘤患者的预后较差,目前仍然缺乏令人满意的治疗方案。研究发现ALK受体在有些神经母细胞瘤中特异性表达,是神经母细胞瘤的致癌驱动因子,因此ALK成为治疗神经母细胞瘤的潜在靶点。
近日,Roberto Chiarle 教授团队于 Cancer Cell 上发表题为 ALK inhibitors increase ALK expression and sensitize neuroblastoma cells to ALK.CAR-T cells 的重磅研究。作者团队开发了一款新型ALK.CAR-T 细胞,并在临床前模型中证明了ALK.CAR-T单药或联合ALK抑制剂治疗神经母细胞瘤的疗效及安全性。结果显示,对于ALK高表达的神经母细胞瘤,ALK.CAR-T单药治疗安全有效,但对于ALK低表达的神经母细胞瘤,单用活性不佳。幸运的是,研究同时发现,通过联合ALK抑制剂可上调ALK表达水平,特异性提升ALK.CAR-T肿瘤杀伤效果。这项研究证明,ALK.CAR-T单用或联合ALK抑制剂治疗神经母细胞瘤安全有效。

ALK.CAR-T细胞有效靶向ALK高表达的神经母细胞瘤
为了评估CAR-T细胞的肿瘤杀伤活性,作者首先在一系列神经母细胞瘤细胞系中对比不同CAR-T细胞的活性,包括:非转导T细胞(UT,阴性对照)、CD19.CAR-Ts(阴性对照),GD2.CAR-Ts(阳性对照)和ALK.CAR-Ts。结果显示,与非转导T细胞、CD19.CAR-Ts相比,ALK.CAR-Ts及GD2.CAR-Ts均可有效地清除大多数肿瘤细胞。具体而言,ALK.CAR-Ts可以有效清除ALK高表达的神经母细胞瘤细胞系(如NB-1),但是对于ALK低表达GD2高表达的细胞系(Kelly、SH-SY5Y),ALK.CAR-Ts的活性不及GD2.CAR-Ts(阳性对照)。
为了,评估ALK.CAR-T在体内的肿瘤杀伤活性,作者分别构建了ALK高表达和ALK低表达两种情况的神经母细胞瘤的转移模型。
首先,作者探索了CAR-T细胞在ALK高表达神经母细胞瘤的转移小鼠(移植NB-1细胞系,ALK、GD2均高表达)中的活性。当肿瘤中位生物发光强度为1.2 × 10^7时,注射CAR-T细胞。结果显示,ALK.CAR-Ts和GD2.CAR-Ts均可快速且有效控制肿瘤生长,部分小鼠甚至保持无瘤生存120天以上(图1A)。而UT或CD19.CAR-Ts无法有效控制肿瘤。更重要的是,免疫组化结果显示扩散至肝、肾上腺、肾的肿瘤细胞也都被ALK.CAR-Ts和GD2.CAR-Ts有效清除(图1B)。

图1.A:ALK.CAR-Ts和GD2.CAR-Ts均可快速且有效控制ALK及GD2高表达神经母细胞瘤的生长。B: 免疫组化结果显示扩散的肿瘤细胞被ALK.CAR-Ts和GD2.CAR-Ts有效清除。
接着,作者探索了CAR-T细胞在ALK和GD2低表达两种的神经母细胞瘤(SK-N-SH和NGP)小鼠中的活性。在SK-N-SH肿瘤转移的小鼠中,ALK.CAR-Ts单用的抗肿瘤及延长生存期的作用十分有限,而GD2.CAR-Ts没有显示出显著活性(图2)。在NGP肿瘤转移小鼠中,ALK.CAR-Ts和GD2.CAR-Ts 单用均未能控制肿瘤生长。
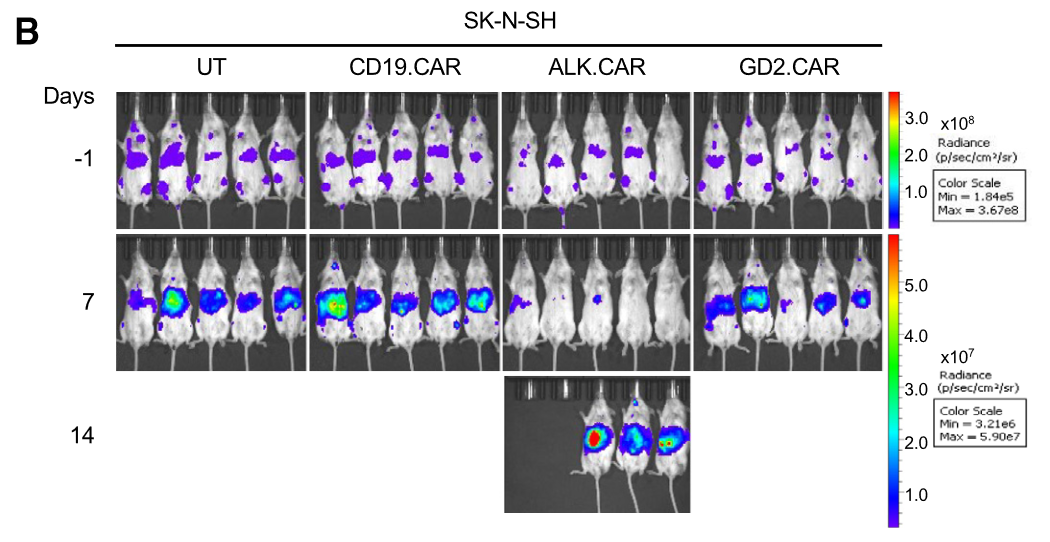
图2.对于ALK和GD2低表达的神经母细胞瘤(SK-N-SH),ALK.CAR-Ts抗肿瘤活性有限
这些结果表明,ALK.CAR-Ts和GD2.CAR-Ts针对抗原高表达的神经母细胞瘤效果相当显著。但对于抗原低表达的神经母细胞瘤,活性有限。因此对于这类肿瘤仍需进一步探索其他治疗策略。
ALK抑制剂与ALK.CAR-Ts联用,可进一步提升疗效
ALK抑制剂,如ceritinib和lorlatinib,在小鼠模型以及携带ALK突变或扩增的神经母细胞瘤患者中展现抗肿瘤活性。既往研究表明,ALK受体激活后会被内吞并下调表达量,而ALK抑制剂可以上调ALK的表达。因此,作者推断,ALK抑制剂可提高神经母细胞瘤细胞中ALK表达及其稳定性,进而增强ALK.CAR-T的靶向作用。
与作者猜想的一致,在神经母细胞瘤细胞系以及小鼠模型中,ALK抑制剂lorlatinib可增加ALK表达水平。不仅如此,对于ALK突变和ALK野生型两种细胞系,lorlatinib与ALK.CAR-Ts联用显示出良好的抗肿瘤作用。
接着,作者在ALK低表达小鼠模型中探索lorlatinib和ALK.CAR-Ts联用的活性。SK-N-SH神经母细胞瘤转移小鼠接受lorlatinib处理4天,然后接受ALK.CAR-Ts或GD2.CAR-Ts输注,然后再次接受lorlatinib处理5天,共2个周期。结果显示,ALK.CAR-Ts与lorlatinib联用显著减缓肿瘤生长速度并延长生存期(图3)。类似的结果在另外两种神经母细胞瘤转移模型(NGP和SH-SY5Y)中也同样得到验证。

图3.对于ALK和GD2低表达的神经母细胞瘤(SK-N-SH),ALK抑制剂lorlatinib与ALK.CAR-Ts联用显著减缓肿瘤生长速度并延长生存期
最后,作者在Felix-PDX模型中验证了lorlatinib和ALK.CAR-Ts联用的疗效。Felix-PDX小鼠 接受CD19.CAR-Ts、ALK.CAR-Ts或GD2.CAR-Ts输注单用或联合lorlatinib。与之前的结果一致,lorlatinib和ALK.CAR-Ts联用显著减缓Felix-PDX模型中肿瘤生长并延长生存期(图4)。

图4.对于Felix-PDX模型,lorlatinib和ALK.CAR-Ts联用显著减缓肿瘤生长并延长生存期
ALK.CAR-T单用和联用方案安全性良好
安全性方面,与ALK.CAR-T细胞治疗单用的小鼠相比, lorlatinib联合治疗的小鼠T细胞在小肠和大肠中的浸润增加,但其大脑中T细胞浸润无影响。而肠道T细胞浸润增加是否具有远期毒性仍需进一步研究。整体而言,因为ALK在正常组织中几乎不表达,ALK.CAR-T 细胞单用或与lorlatinib联用未发现明显毒性。
综上,本研究开发了一款新型选择性靶向神经母细胞瘤ALK.CAR-T细胞,其活性与肿瘤细胞表面ALK受体的表达量相关。ALK.CAR-Ts可快速且深度清除ALK高表达的转移性神经母细胞瘤;而对于ALK低表达的肿瘤,ALK.CAR-T与ALK抑制剂lorlatinib联用可以显著提升其抗肿瘤活性。这项研究结果为进一步在临床上验证ALK.CAR-Ts治疗难治性/复发性神经母细胞瘤患者奠定了基础。值得注意的是,对于ALK低表达的肿瘤,联合疗法治疗后仍然有小部分ALK表达量极低的肿瘤细胞残留。因此,对于如何进一步优化ALK抑制剂的剂量以及给药周期,如何提高ALK的表达等问题,仍值得进一步探索。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#神经母细胞瘤# #ALK抑制剂# #CAR-T#
36