Nat Nanotech:靶向肝外组织,器官特异性LNP开启mRNA疗法新时代
2023-01-03 生物世界 生物世界 发表于上海
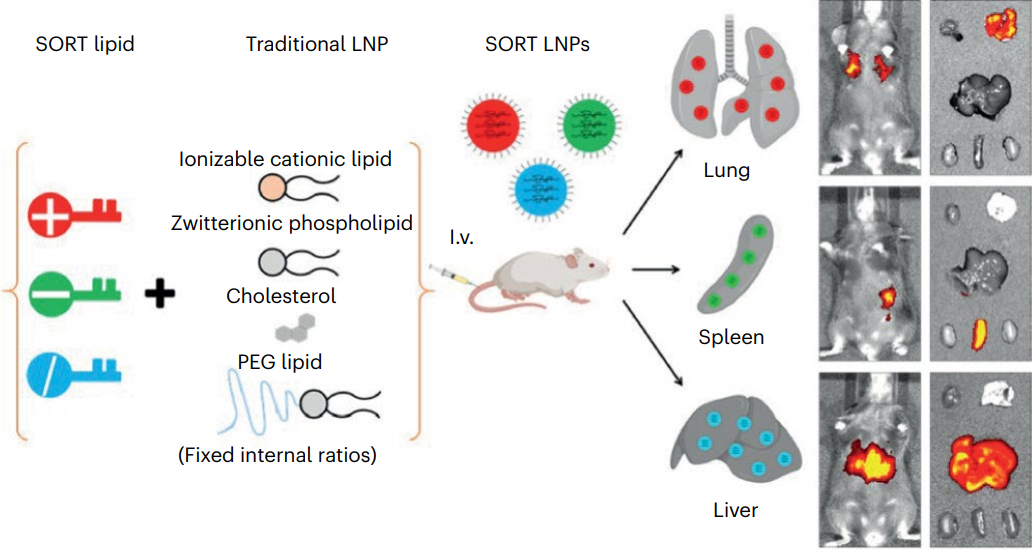
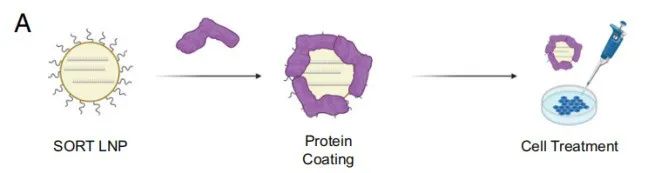
脂质纳米颗粒(LNP)可用于携带和递送治疗性核酸,如mRNA、siRNA,以及用于基因编辑的CRISPR组分。近几年,LNP递送的mRNA新冠疫苗大获成功。


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言