Nat Med:泼冷水!CRISPR可能增加癌症风险
2018-06-13 风铃 生物探索
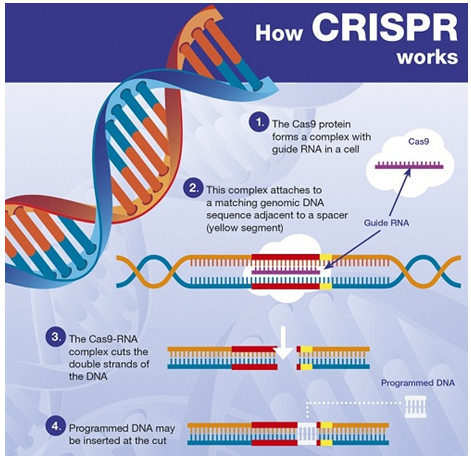
被誉为“世纪发现”的基因编辑工具CRISPR革新了生物医学研究,并为多种疾病的治疗带来了新的希望。然而,6月11日,发表在Nature Medicine上的2篇论文却给这一“魔剪”泼了盆冷水!研究称,使用CRISPR-Cas9可能会带来意想不到的后果——增加癌症风险!成果一经发表就引发了热议,同时还使相关公司的股价大跌!

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#Nat#
38
了解一下.谢谢分享!
0
#CRISPR#
26
#Med#
35
谢谢分享学习
63
学习了
52
学习了.谢谢分享.
0
了解一下.谢谢分享!
46
学了
24
学了
23