全新综述解读:重度抑郁和阿尔茨海默病中的成年海马神经发生
2022-09-16 brainnew神内神外 brainnew神内神外
抑郁症和痴呆症是主要的公共卫生问题。严重抑郁障碍和阿尔茨海默病相互增加彼此发病风险。两种疾病的治疗和预防目前都不完善,目前无有效的药物来治疗AD,同时大约三分之一的抑郁患者也表现出治疗耐药性。
抑郁症和痴呆症是主要的公共卫生问题。严重抑郁障碍(MDD)和阿尔茨海默病(AD)相互增加彼此发病风险。两种疾病的治疗和预防目前都不完善,目前无有效的药物来治疗AD,同时大约三分之一的抑郁患者也表现出治疗耐药性。MDD与AD具有很强的相关性,但生物学联系尚不清楚,揭示这一联系可能会开辟新的治疗和预防方法。《Trends in Molecular Medicine》期刊近期发表了名为“Adult Hippocampal Neurogenesis in Major Depressive Disorder and Alzheimer's Disease”的综述,专门讨论了最近的研究中人类成年海马神经发生(AHN)在MDD和AD中的作用。比较了不同的方法来分析MDD和AD对人类AHN的影响,并分析了不同的研究表明人类AHN作为MDD和AD中潜在的汇合机制的作用。
1神经发生能成为MDD和AD的联系吗?
海马在AD和MDD中都起着关键作用。齿状回(DG),是海马的一个亚区,新的神经元在整个生命过程中产生,称为AHN。新神经元的产生对记忆和其他认知功能以及情绪的调节起着至关重要的作用。神经发生随着年龄的增长而下降,如小鼠和非人类灵长类动物。在人类中,一些研究表明AHN与年龄相关的不同变化程度,而另一些研究则没有看到与年龄相关的神经发生减少。值得注意的是,最近的一项研究没有看到中间祖细胞和神经元的任何与年龄相关的变化。相反,他们观察到静止神经干细胞(NSCs)和血管生成的减少导致神经可塑性降低。AHN可以通过生活方式和营养来调节。几种神经精神疾病与神经源性生态位畸变有关,包括MDD和AD。观察到的AHN生物标志物与MDD或AD病理之间的相关性可能是由于与尚待确定的未知混杂因素的相关性引起的。尽管如此,人AHN仍是一个有趣的目标,可以更好地理解MDD和AD中的情绪和记忆异常,并且可能是MDD升高AD风险的一种融合机制。因此,增强AHN的干预措施可能有助于制定新颖的治疗策略,以应对两种疾病,并有助于预测痴呆症风险(图1)。在小鼠的研究中已经有了令人鼓舞的发现,表明新生神经元的活性是介导抗抑郁作用的关键。此外,一项使用AD小鼠模型的研究表明,AHN的增加改善了AD的认知,而神经发生的减少加剧了认知障碍。

图 1. 成年海马神经发生(AHN)在主要抑郁障碍(MDD)和阿尔茨海默病(AD)中的动力学
2在人AHN的发现与证据
几十年来,人们一直认为成人大脑中没有一种神经元是在出生后产生的。今天,我们知道大脑能适应环境变化并可以被调节,比以前想象的更具可塑性。在1965年,Altman和Das证明,在成年大鼠中,通过标记成年海马DG中的分裂细胞发现颗粒神经元(GNS)在出生后继续产生。30多年后,Eriksson等通过在患者死后组织中注射溴脱氧尿苷(BrdU)为AHN的存在提供了证据。Spalding和Bergmann提供了进一步的证据,他们进行了一种基于GN的DNA中同位素14C的测定方法,以证明新的GNs是在成年期(~700/天)产生的。最近人们对海马中成年神经的丰富性进行了讨论。Sorrells等人使用双皮质素(DCX)和多唾液酸-神经细胞粘附分子(PSA-NCAM)作为人类成年死后大脑中不成熟神经元的标志物,发现其水平几乎无法检出,从而质疑AHN对记忆和认知的重要性。随后,相反的研究提供了证据,通过检测捐献者脑样本中神经源性活性表明AHN在成年人中仍然存在,甚至在高达79岁的老年人中也是如此。其他研究表明,使用DCX和PSA-NCAM等标记物证明成年海马中存在神经发生。这些相反的发现可以用几个因素来解释,包括死后间隔、固定方法和持续时间,以及不同的量化方法。其他地方对此作了广泛分析。总之最新的研究表明,人类的AHN持续到老年。
3MDD与AHN的变化相关
海马参与情绪调节,神经源性活动的变化与MDD有关。多项研究表明MDD患者AHN减少。对人死后脑组织的研究表明,MDD患者海马体积减少,海马GNS数量减少,神经源性生态位血管化减少。血管化已被证明与神经发生密切相关,血管化的增加表明神经发生的水平增加,因为两者都受到重叠因素的调节。此外,磁共振成像(MRI)研究报告了与MDD相关的海马体积减少。应该注意的是,海马体积的增加仅仅是AHN改变的一个指标。体积变化也可能来源于其他因素,包括胶质细胞数量的改变或细胞存活的差异。因此,重要的是量化干细胞和新生神经元的数量,以获得对AHN变化的更有效评估。相反,选择性5-羟色胺再摄取抑制剂(SSRIs)似乎增加了海马神经祖细胞(NPCs)的数量。关于抑郁症动物模型中AHN的研究已经在其他地方进行了总结。对抑郁症和AHN的关联的支持来自于研究接受化疗而出现抑郁症状的癌症患者。药物干扰细胞分裂来影响海马神经祖细胞的增殖。
对抑郁症患者的人海马组织进行的死后免疫组织化学分析显示,海马中NeuN+ 颗粒神经元(GNS)的数量减少,水平下降到~30%。与此相吻合的是,前部DG体积减小了约40%,中部DG减小了50%,与MDD相关。Nissl染色和体视学分析表明,中部粒细胞层(GCL)的尺寸略有减小。值得注意的是,在抗抑郁治疗时,GN数的差异被逆转。与对照组相比,使用SSRIs治疗的MDD患者DG和中GCL大小均增大。GN的数量和DG大小与神经源性生态位的血管化有关。然而,应该指出的是GN数的减少和海马体积的变化可能不一定反映AHN的变化,可能源于其他变化,如细胞凋亡率的改变。最近的一项研究报告,除了GNs的数量减少外,MDD患者DG前部(80%)和中间(50%)的Nestin细胞数量减少,表明NSCs减少。
在同一项研究中,作者研究了AHN在抵御早期逆境(ELA)中的作用。ELA曾被提示增加抑郁症的患病风险。当将ELA健康人群与ELA MDD患者进行比较时,作者发现在体积和细胞数量上存在显著差异。健康ELA患者的组织中,DG前后体积和前NeuN+ 细胞计数均增加,而ELA MDD患者的趋势相反。作者认为ELA影响AHN。DG体积与NeuN+ 细胞的减少可能跟较高的压力敏感性相关,ELA后AHN升高可能是恢复力的机制。
除了免疫组织化学分析外,其他方法也被用来研究AHN在MDD中的作用。健康对照组和MDD患者DG组织的RNA测序证实MDD组血管生成抑制剂的mRNA水平升高。如前所述,血管化和血管生成与神经发生有关。因此,血管生成受损可能干扰海马的神经源性能力。此外,作者还发现了与MDD相关的DG的炎症以及神经发生相关的转录变化。
有几项研究表明,药理学和非药学干预都可能增强AHN,这不仅改善了抑郁症状,而且对认知也有有益的影响,可以降低痴呆的风险。据报道,对患者的NSI-189磷酸酯药理学治疗,NSI-189磷酸酯增加了小鼠的AHN,以及人海马祖细胞在体外模型中的增殖,改善抑郁评分。电休克疗法(ECT)用于治疗抑郁症患者。MRI数据表明,ECT导致海马体积的增加,这与抑郁分数的改善有关。
4AD中改变的人神经发生
对啮齿动物和人类的多项研究表明了AHN在AD病理中的作用。免疫细胞化学分析检测了健康对照者(n = 13)和直到90岁的AD患者(n = 45)的AHN,阐明了健康受试者与AD患者之间的明显差异。根据Braak分期对AD患者进行分组,研究AHN消耗增加是否与疾病进展有关。在不太严重的AD(Braak阶段I-II)中,DCX神经母细胞减少到大约60-70%的对照水平。随着AD病理的进展(Braak阶段IV-VI),DCX水平进一步下降到约30-40%。在所有DCX细胞中,PSA-NCAM、PROX1、NeuN、βIII-微管蛋白或钙结合素(CB)的共表达减少,表明神经元成熟受损。
Tobin等人在一个生命周期的十年中对包括认知健康的人(n=6)以及患有轻度认知障碍的患者的AHN进行了调查,他们描述的记忆问题还没有严重到可以归类为痴呆(n=6)或AD(n=6)。与Moreno-Jimenez等人相反,他们将神经源性下降与认知功能受损联系起来,而不是进行性Tau病理。作者报道了MCI患者海马DCX/增殖细胞核抗原(PCNA)细胞的减少,反映了神经母细胞的分裂。Logistic回归分析表明,神经母细胞数量的减少与认知能力受损有关。神经母细胞的数量还与神经递质释放所必需的SNARE蛋白的功能相互作用有关。认知与Nestin/SOX2/Ki67细胞数量呈负相关。作者推测,这两个描述的细胞群体之间的比率可能与认知下降有关。
来自年轻人、健康老年人以及AD患者的RNA测序的海马基因表达谱揭示AD中的基因表达差异与增殖减少和血管形成改变,神经保护功能降低以及细胞死亡增加有关。其中一个差异表达的基因是VEGFA。血管内皮生长因子(VEGF)A直接刺激NPC,对血管化和血管生成具有重要意义。在健康衰老过程中被上调,但在AD中没有上调。由于血管化对神经源性生态位至关重要,减少这一过程可能对神经发生产生负面影响。
根据这些发现,另一项研究报告了AD患者海马组织中基因的差异甲基化。许多差异甲基化的基因可能与神经分化有关,反映了海马神经发生的改变。即使与通常的AD相关途径(细胞凋亡,自噬,炎症,氧化应激以及线粒体或溶酶体功能障碍)相比,这种关联也很强,这表明AHN在AD中起着重要作用,即使与更常见的相关途径相比也是如此。
5AHN是与MDD相关的AD风险增加的潜在媒介
鉴于AHN可能在MDD和AD中均发生改变,因此AHN不仅可能与患有MDD的人相关,而且还可能介导MDD病史的患者AD风险增加。很少有研究探讨这种可能的相互作用,但对人脑组织的尸检分析表明,使用SSRIs治疗抑郁症与路易体痴呆患者DCX细胞的数量增加有关,表明神经源性活动增加。此外,接受这种治疗的患者表现出较少的认知下降。事实上,DCX水平的增加与更好的认知评分有关。这些发现支持了这样的假设,即抗抑郁药诱导的增强AHN可能既可以改善情绪,也可以潜在地防止神经变性和保存记忆。值得注意的是,与非抑郁组相比,抑郁患者在海马依赖的认知任务中表现更差,表明海马确实将情绪和记忆联系在一起。
最近的一项研究使用全基因组关联研究(GWASs)汇总统计AD患者和小鼠AD模型的MDD风险基因的mRNA表达分析以及107例汉族AD患者MDD风险基因全编码区的测序分析了几个MDD风险位点与AD的关联。一些基因可能与MDD和AD有关,其中一些基因在海马中高度表达。例如,SORCS3可能与海马的病理负担增加有关,因为它参与淀粉样前体蛋白(APP)的加工,可能影响AHN。MDD和AD之间的另一个重叠基因是与记忆和突触调节有关的MEF2C,敲除MEF2C基因与AHN相关的神经元分化和成熟受损有关。此外,在患有MCI的非抑郁者中,遗传MDD风险变异的多基因风险评分(PRSs)与海马灰质体积减少有关,并具有从MCI到AD的转换的预测性。对参与PRSs的基因进行海马特异性分析后,数据显示改变的基因参与了轴突引导、解剖结构形态等过程 发育、神经元投射和细胞发育等过程。这些研究加强了MDD与AD之间遗传或机制联系的假设,并表明AHN确实可能是MDD增加AD风险或导致AD早发的机制,可能是由于认知储备减少。然而,需要更多的研究来为这一假设提供更多的证据。
6AD与MDD神经源性降低的比较分析
AHN的过程涉及多个阶段,可以通过表达不同的标记物来区分,从放射状胶质样神经干细胞到瞬时扩增的神经祖细胞和神经母细胞,再到不成熟和成熟的有丝分裂后神经元(图2A)。利用人类死后脑组织的免疫细胞化学和免疫组织化学分析,最近的两项研究发现了AD的神经源性变化和MDD中AHN的下降(图2b)。值得注意的是,许多研究结果相辅相成。DCX细胞可能代表神经母细胞以及早期有丝分裂后神经元减少。标记神经干细胞和早期瞬时扩增神经祖细胞的数量的Nestin,以及标记早期有丝分裂后和更成熟的GNs的NeuN也减少了。此外,DG体积和GCL大小[52]减少,尽管体积的变化不能证明AHN的改变,并且可能起源于胶质细胞计数的变化、凋亡的改变和血管化的改变等。虽然这两项研究的结果表明,所呈现的标记减少,支持在神经精神疾病中AHN失调的假设,但他们都没有评估整个神经源性轨迹。此外,使用不同的标记使得很难在不同的研究中比较发现,特别是定量的发现。
NeuN细胞的减少并不一定意味着新生神经元的减少,细胞凋亡率的增加也会导致类似的结果。只有添加Nestin作为第二个标记才能更加明确,减少NeuN+ 细胞可能是Nestin NSCs/NPCs减少的结果。DCX与有丝分裂后细胞的第二种标记物(NeuN,PSA-NCAM,βIII-tubulin,CB或PROX1)进行共标记可提供更可靠的数据,以证明神经母细胞和早期有丝分裂后神经元的减少。虽然这提供了减少神经母细胞和早期有丝分裂细胞的证据,但它没有提供关于NSC池的信息。因此,上述研究都没有绘制出神经源性轨迹的完整图。定义不同的标记集来标记AHN的所有阶段以便创建在不同研究中具有可比性的发现可能是有用的。此外,对AHN的所有阶段进行分析,可以更好地了解神经发生可能在哪里受到干扰。
当观察MDD中AHN的变化时,不同的DG亚区显示MDD相关的变化主要集中在前和中DG。前区神经源性活性降低更显著与先前的研究一致,表明前部(小鼠腹侧)DG更多地参与情绪调节,而后部(小鼠背侧)DG与认知有更强的联系。在AD的背景下,对亚区域进行类似的区分将很有趣,以研究后部DG变化是否可能更加显著
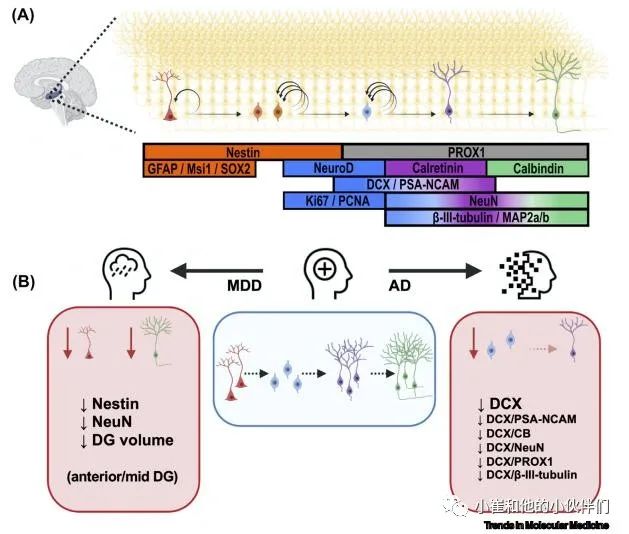
图2. MDD和AD中成年海马神经发生分期和免疫细胞化学分析
7总结与展望
在我们的老龄化人口中,抑郁症和痴呆症变得越来越突出,并对社会产生挑战。抑郁症作为痴呆可能危险因素以及MDD和AD重叠的作用还在争议。在这里,我们重点关注了人的研究,证明了AHN在MDD和AD中的作用,以及一些证据表明海马神经发生可能显示出这两种疾病之间的趋同联系。
虽然抗抑郁药的使用改善了路易体痴呆患者的认知,但这并不一定意味着同样的情况也适用于AD。我们建议进一步研究抑制或延缓认知功能下降和AD的治疗是否涉及AHN。对MDD或AD神经源性衰退的死后分析得到的发现是互补的,但很难比较。对抑郁症和痴呆症中的AHN进行更全面研究的一种方法是定义一组常用标记,这些标记可以标记人脑神经发生的所有不同阶段。这将使人们能够比较不同研究和疾病的结果,并能够更好地解释AHN的作用。此外,死后组织分析只描述了AHN的一个截面,而AHN是一个非常动态的过程。虽然最近的研究表明神经发生的减少,但它不能肯定地被证明,因为并不是所有阶段的AHN都在这些研究中被可视化。AHN是一个动态过程,开发一个直接评估AHN的实时模型有助于理解其在MDD和AD中的作用。人类海马神经发生的一些体外模型已经存在;例如用人诱导多能干细胞衍生的GNs。类似的模型可用于研究在MDD和AD中海马神经发生的作用。
遗传学可以进一步深入了解AD和MDD的重叠。多个GWAS研究了MDD或AD的遗传改变并确定了两种疾病之间的重叠。将这些数据与细胞检测相结合,可以进一步对AHN作为一种可能的汇聚机制的功能理解。
总之,AHN对于新记忆和认知功能的表现以及情绪调节至关重要。如果受到干扰,可能会对心理健康造成严重后果。AHN已被证明参与AD病理并在MDD中发挥作用。本文介绍的人体研究提供了一些证据,表明AHN参与了这两种疾病。即使目前的发现并不能证明AD和MDD之间存在直接联系,但它们表明AHN是一个可能的十字路口。从长远来看,这为潜在地预防AD和其他痴呆症的发作开辟了一条新途径。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#阿尔茨海#
48
#神经发生#
42
#阿尔茨#
41
#阿尔茨海默#
40