【佳作分享】美国Icahn医学院Marta Filizola小组JCIM期刊论文:深度学习生成模型助力新型镇痛药物的从头设计
2023-09-13 ComputArt计算有乐趣 ComputArt计算有乐趣 发表于上海
小组基于公开的化合物数据库和KOR的结构与功能信息,使用深度学习生成模型,从头设计新型Kappa型阿片受体拮抗剂,并通过化学合成与细胞实验验证其高亲合力与药效。
阿片类药物使用障碍(OUD)是一种由于阿片类药物的长期滥用导致的脑部功能紊乱、认知障碍和心理依赖的慢性疾病。OUD不仅严重影响患者的生活质量,还造成了全球范围内的公共卫生和社会问题。目前,该疾病的治疗着眼于新型κ-阿片受体(KOR)拮抗剂的开发。但是,由于已知的KOR拮抗剂分子有限,且大多数不具有理想的理化性质和生物活性,从头设计新型的KOR拮抗剂成为一种有效的药物发现策略。
美国Icahn医学院的Marta Filizola小组基于公开的化合物数据库和KOR的结构与功能信息,使用深度学习生成模型,从头设计新型Kappa型阿片受体(KOR)拮抗剂,并通过化学合成与细胞实验验证其高亲合力与药效。
近日,该项研究工作发表在美国化学会出版的计算化学核心期刊Journal of Chemical Information And Modeling(https://doi.org/10.1021/acs.jcim.3c00651)[1]。
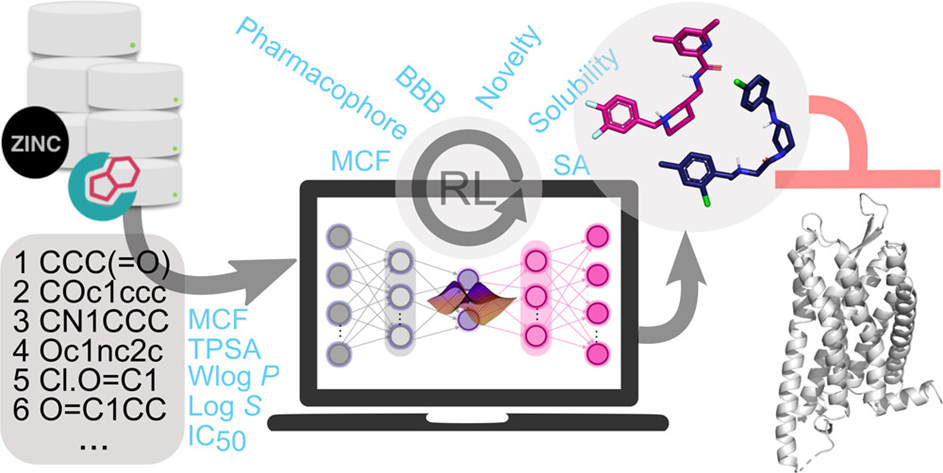
深度学习生成模型通过学习数据集的概率分布,创建不同于输入数据集的新样本。研究者们使用了一种改进的生成式张量强化学习(GENTRL)构架,它包含了GENTRL开放框架中的条件变分自编码器(cVAE),同时使用递归神经网络(RNN)编码器和卷积神经网络(CNN)解码器。该模型使用SMILES格式作为输入,包含两个数据集。数据集1为从ZINC 20数据库中筛选出的460万种化合物,使用分子集基准测试平台(MOSES)将数据集1分为预训练数据集(80%)、测试集(10%)和单元测试集(10%)。数据集2为从ChEMBL 30数据库获取的2056种KOR抑制剂的IC50值。
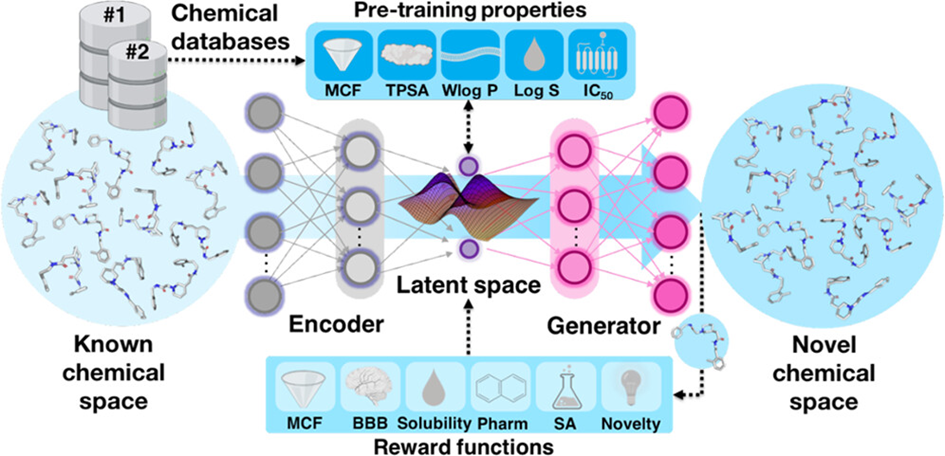
图-1:KOR拮抗剂从头设计的生成深度学习策略方案。以SMILES格式对数据集1进行预训练,并在数据集2上微调模型。通过cVAE将高维化学空间映射到低维潜在空间中,实现采样
该模型的预训练分为两步(图-1)。首先在数据集1上进行预训练,以分子的结构和物理化学信息作为特征,包括拓扑极性表面积(TPSA)、亲脂性、溶解度,基于药化性质过滤器(MCFs)的分类标志以及分子是否为KOR抑制剂的分类标志。该模型在20轮后达到最好效果。以从数据集1中学习到的分布、有效分子的唯一性、内部多样性和MCFs通过率作为评估模型质量的指标,在数据集2上进行微调,使用Adam优化算法进行300,000次更新。结果表明,该模型生成的分子中有99-100%是新分子。
使用强化算法在GENTRL的强化学习框架内进行9000次迭代,得到100万组有效SMILES分子。使用药效团相似性(USRCAT>0.25或IChem>0.4)、药化性质过滤器、血脑屏障通透性、溶解度(-5≤log S≤-1)、合成可及性(SAS<6)和新颖性(Tcmax<0.5)六个分量的乘积作为奖励函数对生成分子进行评估。其中,药效团相似性指标分别通过基于配体的USRCAT评分和基于口袋的IChem评分计算。将根据上述条件过滤后获得的2545个小分子与KOR蛋白进行分子对接,并与已知拮抗剂JDTic和KOR相互作用指纹(SIFts)进行比较,最终挑选出169个候选分子。
选择与已知药物-靶标相互作用相似度最高的5种化合物进行化学合成和细胞实验验证。作者发现其中FJRL-14和FJRL-20表现出与KOR的高亲合力,尽管采取与已知拮抗剂高度相似的结合模式,但是其化学结构具有显著新颖性(图-2)。这些结果验证了基于深度学习模型的从头设计方法的可行性和有效性。
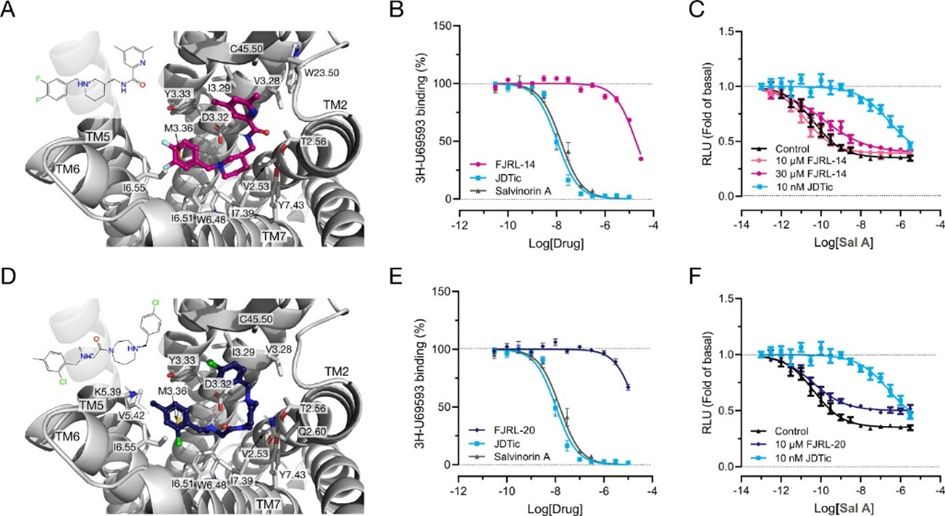
图-2:从头生成的KOR拮抗剂FJRL-14和FJRL-20的结合模式、竞争结合测试及细胞实验结果
研究人员使用改进的深度学习生成模型,并使用强化学习算法进行模型优化,通过设置结构相似性、结合亲和力等奖励函数,成功地在体外从头设计出有潜力的新型镇痛药物。该项研究表明,深度学习生成模型能够加速早期先导化合物的发现过程,并获得具有特定药理特征和体外活性的新化合物。改进后的算法能够探索新的化学空间,减少由于现有药物分子不足或相似度过高而带来的筛选和设计限制。
参考文献
【1】 Leslie Salas-Estrada, Davide Provasi, Xing Qiu, Husnu Ümit Kaniskan, Xi-Ping Huang, Jeffrey F. DiBerto, João Marcelo Lamim Ribeiro, Jian Jin, Bryan L. Bryan L. Roth, and Marta Filizola*. De Novo Design of κ-Opioid Receptor Antagonists Using a Generative Deep-Learning Framework, J. Chem. Inf. Model. 2023, 63(16), 5056-5065. https://doi.org/10.1021/acs.jcim.3c00651
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言