小小“泳道”,大展神通——浆细胞病导致C3肾小球病1例
2023-01-14 安崇文,喻小娟 北京大学第一医院 “检验医学”公众号 发表于上海
从最初诊断为肾病综合征,到发现单克隆免疫球蛋白血症、浆细胞病、C3肾小球病,再到最终确诊MGRS。
01
前 言
浆细胞病(即单克隆丙种球蛋白症)是指浆细胞或产生免疫球蛋白的淋巴样浆细胞和B淋巴细胞异常增生并伴有单克隆免疫球蛋白或其多肽链亚单位异常增多的一组血液系统疾病。包括多发性骨髓瘤、原发性轻链型淀粉样变、华氏巨球蛋白血症、轻链或/和重链沉积病等等[1]。
C3肾小球病是较为罕见的肾小球疾病之一,分为致密物沉积病和C3肾小球肾炎,肾脏组织病理的特点是免疫荧光以补体C3沉积为主,发病机制为获得性或遗传缺陷导致补体旁路途径调节异常[2]。
上述这两类疾病一个属于血液系统疾病,一个属于肾脏疾病,看似毫不相关,但实际上浆细胞病导致的单克隆免疫球蛋白血症有时也会引发C3肾小球病。请看下面这个案例。
02
案例经过
患者,男,76岁,主因双下肢水肿,伴乏力,就诊于我院肾内科门诊。通过问诊,该患者尿量无明显减少,约1000mL左右,有尿中泡沫增多,无尿颜色的改变,查体血压(145/76mmHg),轻度贫血貌,浅表淋巴结未触及明显肿大,双肺呼吸音清,未闻及明显干湿性啰音及胸膜摩擦音,心率76次/分,心律齐,各瓣膜听诊区未闻及杂音及心包摩擦音。腹软,无压痛、反跳痛及肌紧张,双下肢对称性凹陷性水肿;既往有高血压病史2年,最高达190/100mmHg,现服用硝苯地平控释片30mg bid,血压控制在150/85mmHg左右。无外伤及手术史,否认糖尿病史,否认药物、食物过敏史,否认家族遗传病史及类似疾病史。
患者首次门诊检查结果如下:
1.患者的血常规白细胞计数7.34×109/L,红细胞计数2.99×1012/L、血红蛋白浓度89 g/L、血细胞压积26.8 %,PLT 386×109/L,RET%:2.95%和RET#:88.21×109/L,CRP 8mg/L。

2.尿常规结果:尿蛋白4+,隐血2+,尿白细胞+,显微镜镜检:红细胞120-150/HP,白细胞60-80/HP,颗粒管型20-30/LP,红细胞形态变异信息为混合。
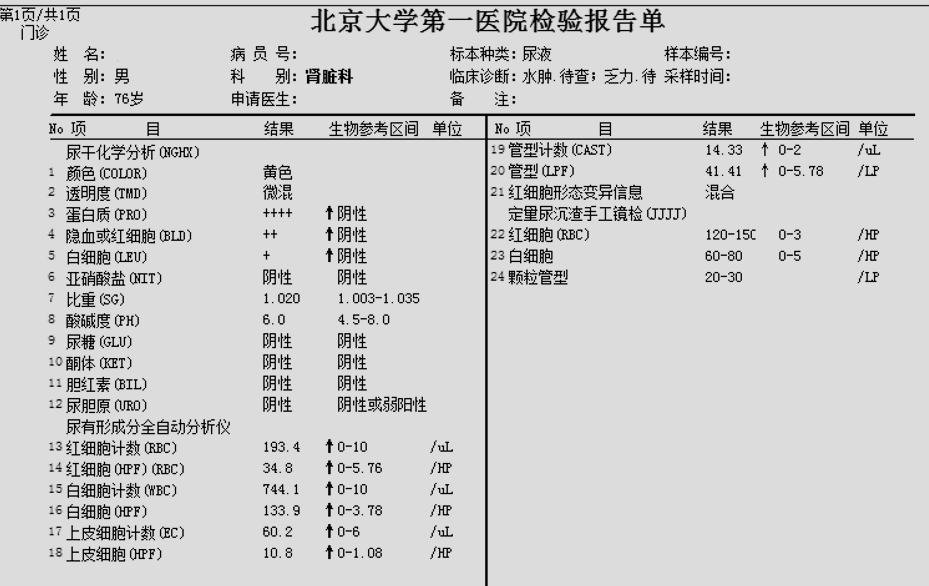
3.24小时尿蛋白定量为5.92g/24h。
4.尿微量白蛋白3360.00 mg/L, 尿转铁蛋白254.00 mg/L,尿α1-微球蛋白17.10 mg/L, 尿免疫球蛋白137.00 mg/L,尿NAG 12.50 U/L,ACR3062.10 mg/g。
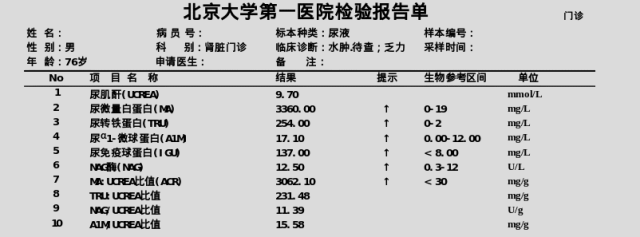
5.肝功能指标正常,TP 46.6 g/L、ALB 19.7 g/L,血肌酐157.89μmol/L,eGFR 36.1 mL/min/1.73m2,血尿素10.63 mmol/L,Ca 1.93 mmol/L、Na 133.67 mmol/L,总胆固醇5.23mmol/L。

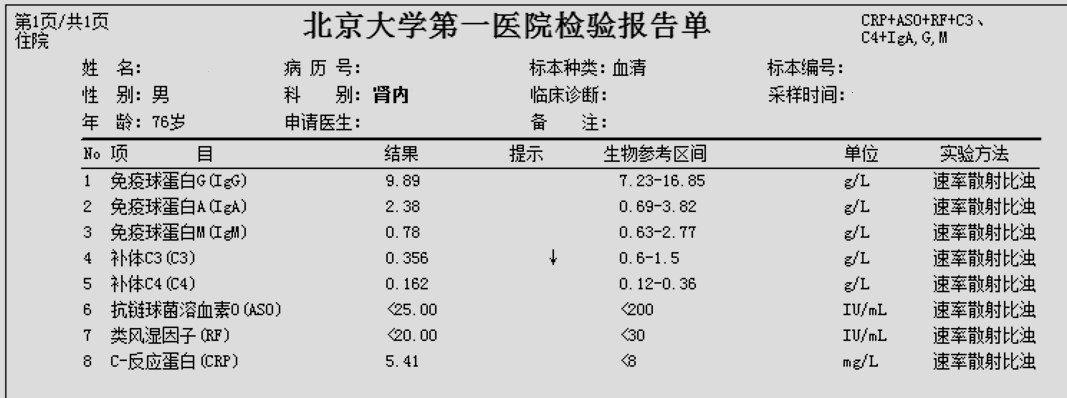
6.血清免疫球蛋白定量IgG、IgA、IgM浓度正常,补体C3为0.356 g/L、C4为0.162 g/L。抗链球菌溶血素O<25.00 IU/mL、类风湿因子<20.00 IU/mL。
患者入院后完善相关检查,结果如下:
7.冷球蛋白定性、IgE、补体C1q、ANA抗体、抗dsDNA抗体、抗肾小球基底膜抗体、抗磷脂酶A2受体抗体以及ANCA相关性抗体均未见异常,乙肝、丙肝、HIV等感染性指标均阴性;血清蛋白电泳和血清免疫固定电泳检测,如图1:M蛋白11.42%,(7.0g/L),血免疫固定电泳可见单克隆免疫球蛋白IgGλ型。

血清蛋白电泳和血清免疫固定电泳扫描图
8.骨髓细胞学:骨髓增生明显活跃,兰状细胞增多,M/E=1.33/1,粒系占48.5%,各阶段粒系细胞比例大致正常,部分中幼粒胞体大。红系占26.0%,有核红细胞形态大致正常,成熟红细胞大小不等。淋巴细胞12.5%,单核细胞6.0%,浆细胞2.5%(成熟型)。可见巨核细胞33个,血小板多见,浏览全片,偶见噬血细胞。外周血白细胞形态正常。
骨髓活检病理诊断:(骨髓)穿刺凝血、皮质骨及骨髓组织,骨髓增生稍活跃,三系可见,各阶段粒细胞均可见;散在小型造红岛,部分造红岛扩大;巨核细胞2-4个/HPF。各系细胞未见明显形态异常。间质内少许浆细胞浸润(CD138+,kappa个别+,lambda+,约占10%),未见淀粉样物沉积(刚果红染色阴性)。
骨髓流式细胞学:本次骨髓中CD38+细胞占2.2%,表达CD138,CD56,CD117,不表达CD19,CD20,CD5;CD38+细胞检出cLambda轻链限制性表达。结论:本次标本检出克隆性浆细胞占2.2%。诊断浆细胞病明确。需要肾脏病理进一步明确有无浆细胞病相关肾损害。
9.肾脏病理结果:
免疫荧光:5G,IgG-,IgA-,IgM-,C3+++,C1q?,FRA-,ALB-, IgG1-,IgG2-,IgG3-,IgG4-,κ-,λ-,HBsAg-,HBcAg-。系膜区、节段毛细血管壁团块状、颗粒样沉积。
石蜡荧光:κ-,λ-;免疫组化:IgG1 -,IgG2 -,IgG3 -,IgG4 -。
光镜所见:肾穿刺组织可见12个肾小球。肾小球系膜细胞和基质重度弥漫增生,结节分叶状改变,广泛系膜插入,局灶节段内皮细胞增生,基底膜弥漫增厚伴双轨征,内皮下、系膜区嗜复红蛋白沉积,其中2个小细胞纤维性新月体形成。肾小管上皮空泡及颗粒变性,灶状萎缩。肾间质灶状淋巴和单核细胞浸润伴纤维化,小动脉管壁增厚。符合:膜增生性肾小球肾炎,C3肾小球病可能性大,不除外MGRS肾损害,待电镜进一步检查。
电镜观察:肾小球系膜细胞和基质中至重度增生、广泛插入,上皮下、基底膜内、内皮下及系膜区电子致密物沉积,基底膜内疏松层节段增宽,上皮足突广泛融合。肾小管上皮空泡变性,部分萎缩;肾间质淋巴单核细胞浸润伴胶原纤维增生。电镜诊断:符合C3肾小球病。
10.H因子抗体阳性、C3肾炎因子阳性、H因子浓度310.5 ug/mL。抗H因子抗体为单克隆免疫球蛋白IgGλ型,结果如图。
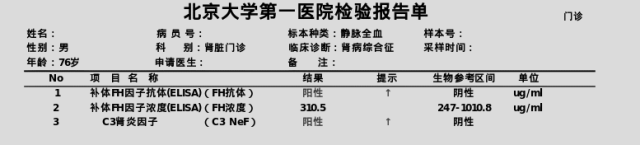

抗H因子抗体免疫固定电泳扫描图
03
检验案例分析
患者首次门诊实验室检查结果,血常规中白细胞计数正常,红细胞计数、血红蛋白浓度、血细胞压积三项均减低,Hb 89 g/L??,达到了中度贫血的水平,MCV、MCH、MCHC、RDW均正常,为正常细胞正色素性贫血。
尿液检查提示大量蛋白尿、红细胞尿、颗粒管型尿,红细胞形态变异信息为混合,提示可能存在肾小球肾炎。24小时尿蛋白定量为5.92g/24h???,达到了一个大量蛋白尿的水平。肾损伤标记物检查结果,主要以肾小球性蛋白为主,出现了大分子蛋白(尿免疫球蛋白明显升高),表现为非选择性蛋白尿,ACR3062.10 mg/g,为A3期(严重升高)。
患者肝功能指标正常,TP、ALB明显降低,为低白蛋白血症,(当ALB<28g/L,会出现组织水肿);血肌酐157.89μmol/L?轻度升高,血尿素10.63mmol/L?升高,eGFR 36.1 mL/min/1.73m2??,为G3b期,提示肾小球滤过功能中至重度下降;Ca 1.93mmol/L?、Na 133.67mmol/L?降低,可能是肾脏疾病引起了电解质代谢紊乱有关,总胆固醇5.23mmol/L?偏高。补体C3??明显下降。C3浓度降低可常见于多种肾脏疾病。
患者血清蛋白电泳和免疫固定电泳检出单克隆免疫球蛋白(M蛋白),为IgGλ型,诊断M蛋白血症明确。患者的M蛋白是属于B淋巴细胞来源还是浆细胞来源?是多发性骨髓瘤?原发轻链淀粉样变?还是单克隆免疫球蛋白沉积病?等等一些M蛋白相关疾病导致的?它是否导致了肾脏损伤?需要组织活检病理协助诊断。
根据肾脏活检病理结果,临床要求追加C3肾病相关补体蛋白检测,患者H因子抗体阳性、C3肾炎因子阳性、H因子浓度正常。
根据临床需求协助诊断MGRS,需要对血浆置换液中的抗H因子抗体提取物做个性质判断,即克隆属性。经过协商,我们考虑抗H因子抗体本身亦属于免疫球蛋白,是可以通过免疫固定电泳检测来鉴定其单克隆或多克隆属性的。最后我们对患者血浆置换液提取物的抗H因子抗体进行免疫固定电泳检测,结果抗H因子抗体为单克隆免疫球蛋白IgGλ型。
04
临床案例分析
结合患者首次门诊实验室检查结果及患者的临床表现,【患者双下肢水肿、低白蛋白血症ALB 19.7g/L(<30 g/L)、大量蛋白尿(>3.5g/d)、总胆固醇偏高】,初步诊断为肾病综合征无疑。患者中度贫血(正常细胞正色素性贫血),低补体C3血症,为了进一步诊治,患者收入我院肾内科病房。
患者目前肾病综合征明确,为排查继发因素导致的肾脏损伤,入院后完善了相关检查,其中为了排查副蛋白相关引起的肾脏损害,我们给患者做了M蛋白筛查试验,血免疫固定电泳可见单克隆免疫球蛋白IgGλ型,诊断单克隆免疫球蛋白血症明确。那单克隆免疫球蛋白血症是否是导致患者肾脏损伤的原因呢?
为进一步鉴别是否是副蛋白血症导致的肾脏损害,需要骨髓穿刺活检及肾活检协助诊断。
患者骨髓穿刺活检结果不支持患者为浆细胞肿瘤,且扁骨平片未见明显溶骨性改变;肾脏病理无单克隆免疫球蛋白沉积,那患者的M蛋白血症是意义未明的单克隆免疫球蛋白血症(MGUS)吗?
肾脏病理提示C3肾小球病,该病主要以补体旁路过度激活,补体C3在肾小球沉积为主要特征,临床表现无特异性,C3肾炎因子(C3NeF)、抗H因子抗体是其中最重要的两个致病机制。
化验结果提示患者血中存在致病因子:抗H因子抗体及C3肾炎因子。患者目前C3肾小球病诊断明确,结合患者同时有浆细胞病、抗H因子抗体阳性及C3NeF阳性,考虑到既往文献报道浆细胞病产生的副蛋白可以通过发挥H因子抗体功能致病[3],该患者也很可能是MGRS(具有肾脏意义的单克隆免疫球蛋白血症),可通过进一步确定H因子抗体克隆性协助诊断。
向检验科相关人员进行求助,通过免疫固定电泳技术进行协助诊断,结果为抗H因子抗体为单克隆免疫球蛋白IgGλ型。
至此,患者的病因方面基本明确,患者为浆细胞病引起了单克隆免疫球蛋白血症(IgGλ),该单克隆IgGλ具备了抗补体H因子抗体的功能,抑制了H因子活性,导致补体旁路途径异常活化,从而引起C3肾小球病,最终MGRS诊断明确。到此为止,通过层层迷雾,患者的诊断基本清晰,可谓是拨开云雾见青天,终于见到庐山真面目了,患者最终诊断:
(1)具有肾脏意义的单克隆免疫球蛋白血症(MGRS)
(2)肾病综合征
(3)C3肾小球病
(4)肾性贫血
(5)高血压病
05
知识拓展
具有肾脏意义的单克隆免疫球蛋白血症(MGRS):是2012年由国际肾脏与单克隆免疫球蛋白病研究组(IKMG)提出的概念[4],之后又重新进行了更新,是一组能产生肾毒性的单克隆免疫球蛋白的B淋巴细胞和浆细胞增殖性疾病(如SMM、SWM以及单克隆B细胞增多症——一种和MGUS等同的CLL系的克隆性疾病、低级别的CLL和低级别的B细胞来源的非霍奇金淋巴瘤,如边缘区淋巴瘤、套细胞淋巴瘤、粘膜相关淋巴组织淋巴瘤等),当上述疾病出现单克隆免疫球蛋白相关肾脏损害时,均归于MGRS。诊断主要靠肾脏组织病理,目前认为主要是M蛋白的直接沉积或M蛋白的间接效应导致肾脏损害。
C3肾小球病:是2010年正式提出的疾病概念[5],诊断依靠肾脏组织病理,其特征为肾脏组织免疫荧光下可见明显C3沉积,极少或无其它免疫球蛋白的沉积,主要包括致密物沉积病和C3肾小球肾炎,遗传和自身抗体参与的补体旁路调节异常是C3肾小球病的主要发病机制[6]。其中一部分C3肾小球病是与单克隆免疫球蛋白相关的[3]。
我们知道单克隆免疫球蛋白可以间接导致我们肾脏损伤,其主要是单克隆免疫球蛋白可以干扰补体调节功能,其一:部分单克隆免疫球蛋白可能发挥抗C3转化酶抗体功能,稳定补体旁路途径C3转化酶,进而激活补体旁路途径,导致旁路途径的补体成分(主要是C3)沉积于肾小球,诱发C3肾病。其二:浆细胞病也可能产生抗补体调节蛋白的M蛋白,从而导致补体旁路途径异常活化。
06
案例总结
通过上述这个案例,我们看到了患者经过一步步的排查,从最初诊断为肾病综合征,到发现单克隆免疫球蛋白血症、浆细胞病、C3肾小球病,再到最终确诊MGRS。检验指标起到了非常重要的作用,尤其是免疫固定电泳检测,虽然不能像组织活检病理可以明确诊断,但在发现单克隆免疫球蛋白血症、浆细胞疾病等上发挥着很重要的作用,特别是对M蛋白的筛查、鉴定和分型来说最为重要。
本案例中通过对血浆提取物(抗H因子抗体纯化物)进行免疫固定电泳检测,判断出H因子抗体的克隆性为单克隆性质,与血中的M蛋白相同,由此判断出C3肾小球病是由单克隆免疫球蛋白间接相关导致的,最终协助诊断为MGRS。
这就提示我们单克隆免疫球蛋白除了直接沉积引起肾脏损伤外,还可通过间接干扰补体旁路系统引起肾脏损伤。临床中如果怀疑副蛋白相关引起的肾脏损伤,首先要进行血清蛋白电泳、血、尿免疫固定电泳检测,筛查是否存在单克隆免疫球蛋白血症。
07
专家点评
点评专家:北京大学第一医院检验科 主任技师 闫存玲
通过这个较罕见的单克隆免疫球蛋白相关C3肾小球病这个案例,从开始的筛查、鉴别诊断、排除诊断、明确诊断等过程中来看,实验室检测的指标以及检测手段非常重要,对于检验人员除了要提高自身检测技术的能力,给临床出具准确的检验报告,帮助临床解决问题,还要主动学习相关临床医学知识,不断提升自己的知识储备和工作能力,遇到疑难检测结果要积极与临床沟通交流,通过沟通交流,学习对疾病的诊断、治疗等相关知识,提升对疑难结果分析诊断的能力。
参考文献
[1]Landgren O, Kyle RA, Pfeiffer RM, et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study. Blood. 2009 May 28;113(22):5412-5417.
[2]丁云飞,于峰.补体检测在C3肾小球病诊治中的价值[J].中华检验医学杂志,2020,43(9):860-864.
[3]张丽华,程震,徐峰,等.单克隆免疫球蛋白病相关C3肾炎的临床病理分析[J].肾脏病与透析肾移植杂志,2015(6):507-511.
[4]张晓凤,程小红,毛加荣,等.有肾脏意义的单克隆免疫球蛋白沉积病新进展[J].中国中西医结合肾病杂志,2020,21(6):547-549.
[5]Fakhouri F, Frémeaux-Bacchi V, No?l LH, et al. C3 glomerulopathy: a new classification. Nat Rev Nephrol. 2010 Aug;6(8):494-499.
[6]Smith RJH, Appel GB, Blom AM, et al. C3 glomerulopathy - understanding a rare complement-driven renal disease. Nat Rev Nephrol. 2019 Mar;15(3):129-143.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







