Circulation 赵扬/周斌研究组报道基于细胞重编程原理诱导心肌再生的优效方法
2023-11-28 论道心血管 论道心血管 发表于上海
该研究基于细胞重编程原理,利用新的重编程因子,在心肌梗死损伤区域诱导肌成纤维细胞向心肌细胞命运高效转化,缓解了小鼠心肌梗死症状,改善了心脏功能。
近年来,由于冠脉动脉粥样硬化、不良生活习惯等因素诱发的心血管疾病成为对人类健康最严重的威胁之一。人类和成年哺乳动物的心脏受损后几乎没有再生能力。如发生急性心梗,大量心肌细胞因缺血缺氧死亡而无法再生,取而代之的是分泌大量胶原的肌成纤维细胞,进一步导致心脏纤维化和心力衰竭。近十几年,细胞重编程技术的发展为解决心肌再生的难题带来了新希望:在体原位诱导肌成纤维细胞向心肌细胞命运转化,有望在实现心肌再生的同时缓解心脏纤维化,是一举两得的心肌再生新途径。
2023年11月21日,北京大学未来技术学院分子医学研究所、生命科学联合中心赵扬团队和中科院分子细胞科学卓越创新中心周斌研究员合作在心血管领域知名学术期刊Circulation上发表了题为“An improved factor combination for in vivo reprogramming of cardiac myofibroblast to cardiomyocyte-like cell with dual recombinase tracing”的研究论文1。该研究基于细胞重编程原理,利用新的重编程因子,在心肌梗死损伤区域诱导肌成纤维细胞向心肌细胞命运高效转化,缓解了小鼠心肌梗死症状,改善了心脏功能。尤其重要的是,这一研究创新性地利用双重组酶谱系示踪技术对重编程过程进行了严格的观测和分析。

已有研究使用Gata4、Mef2c和Tbx5 (GMT)因子组合实现在体的心脏成纤维细胞向心肌细胞的转化2。然而,肌成纤维细胞作为介导心脏纤维化的主要细胞类型,在心梗损伤区域数量多且危害大,能否将此类细胞高效地诱导成为心肌细胞,是决定心梗治疗效果的关键因素之一。赵扬团队前期研究表明,仅依靠传统的重编程因子Gata4、Mef2c和Tbx5 (GMT)很难高效地将心梗后的肌成纤维细胞诱导转化为心肌细胞3。
为了解决这一问题,研究者首先建立了一套基于双重组酶的严格谱系示踪系统Tnni3-Dre;IR1;Postn-MerCreMer,该系统可严格追踪心梗区肌成纤维细胞的命运,并有效排除内源心肌细胞泄漏表达Cre造成假阳性标记的干扰。该系统通过肌成纤维细胞特异表达的基因Ponstn驱动MerCreMer重组酶的表达,在心梗后将肌成纤维细胞标记为ZsGreen+,并利用心肌细胞特异表达的基因Tnni3驱动Dre重组酶的表达,自心肌发育时期开始就将所有内源心肌细胞充分标记为tdTomato+,与此同时破坏ZsGreen的表达元件,排除了ZsGreen在心肌中的泄漏表达,实现了对两类细胞命运的严格区分(图1A, B)。因此,此系统可有效区分内源心肌细胞(tdTomato+ ZsGreen- cTnI+)和诱导产生的心肌细胞(tdTomato- ZsGreen+ cTnI+)(图1C, F)。周斌研究组曾用类似的系统证实成年小鼠心肌受损后非心肌细胞并不会向心肌细胞的自发转变,从而明确了哺乳动物成体心脏中新生心肌细胞主要来源于本身增殖,而非“成体心脏干细胞”的分化,是一种比传统示踪技术更严格和更精准的细胞谱系追踪系统4。
在前期研究中,赵扬团队针对分离培养的肌成纤维细胞开展了重编程因子的优化,发现在GMT基础上加入Myocd和Sall4两个转录因子(GMTMS)可大幅提升心肌细胞的诱导效率3;此外,该团队也利用小分子筛选发现了能够大幅提升心肌细胞诱导效率和质量的小分子组合:ALK5抑制剂SB431542加上泛JAK抑制剂Ruxolitinib (SR)5。在双重组酶谱系示踪系统的帮助下,研究者在小鼠心梗模型中发现将GMTMS与SR联用可高效地诱导肌成纤维细胞向心肌细胞命运转化。谱系示踪结果显示,相比仅提供GMT+溶剂的对照组,提供GMTMS和SR的组合可观察到再生心肌细胞数量提高了14倍(图1D, E, F),GMTMS+SR诱导得到的再生心肌细胞也展现出了较为成熟的肌节结构(图1E)。此外,使用标记所有非心肌细胞的Tnni3-Dre;IR1;R26-iCre系统的谱系示踪也得到了类似结论,相比仅提供GMT+溶剂的对照组,提供GMTMS+SR得到的心肌样细胞数量也有大幅提升(图1G, H)。
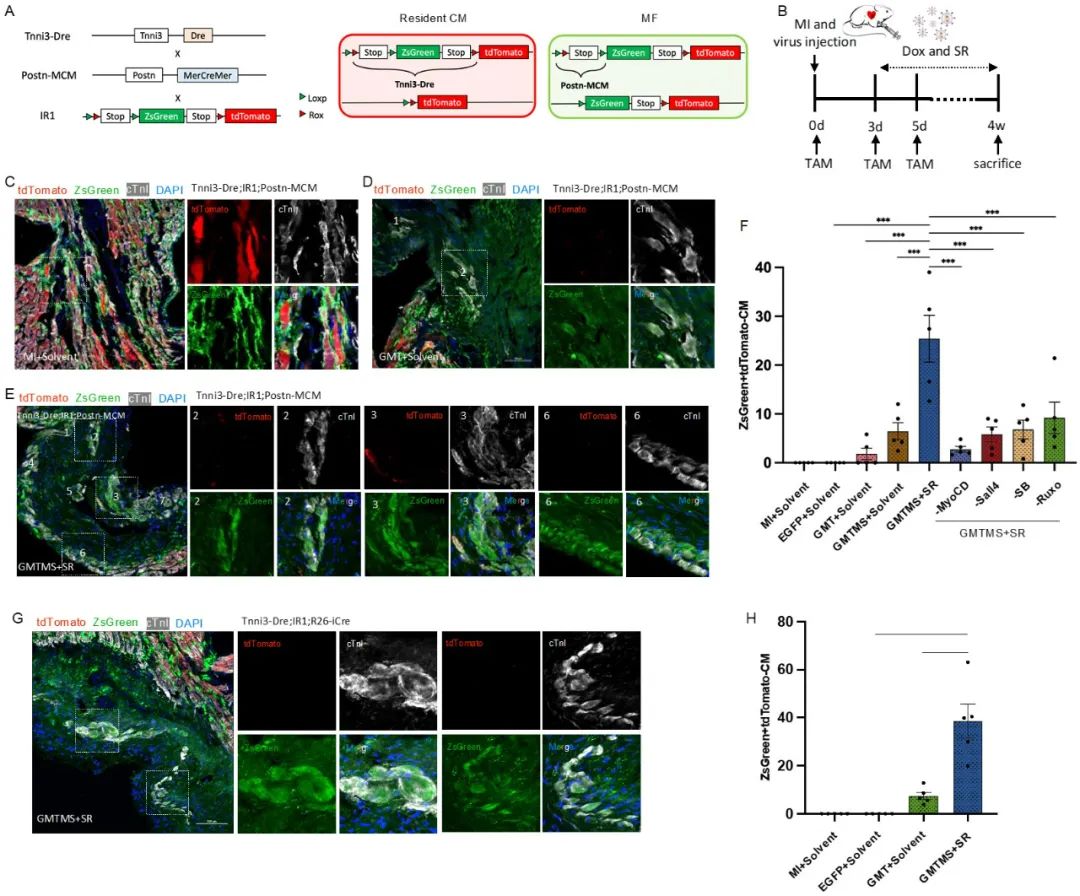
图1. 利用双重组酶系统证实GMTMS+SR可高效诱导MF-CM重编程
研究者通过心动超声实验证实,新的重编程因子组合GMTMS+SR可以显著改善小鼠心梗后的心脏功能。研究者分别在心梗第0天、第1周、第2周、第4周和第6周进行心动超声测试。结果表明,在心梗后相比起EGFP与GMT+溶剂组,GMTMS+SR组左心室射血分数(LVEF)和左心室收缩率(LVFS)有明显提升(图2A, B),提示心脏供血功能的显著改善。

图2. GMTMS+SR可显著提升小鼠心梗后的心脏功能
综上,该研究提出了一个可高效诱导心梗原位肌成纤维细胞向心肌细胞命运转化的重编程组合GMTMS+SR,并通过严格的谱系示踪进行了验证,其心动超声功能实验也提示了细胞重编程方法治疗急性心梗的可行性和临床应用潜力。本研究后续仍需进一步优化心脏原位重编程因子体系,减少需要使用的重编程因子数量,并针对心梗区肌成纤维细胞开发更具有临床可用性的基因递送手段。期待通过这些优化进一步提升原位重编程方法的临床应用前景,造福更多的心梗患者。
北京大学未来技术学院2018级博士生吴靖东是该研究的第一作者。北京大学未来技术学院、生命科学联合中心赵扬研究员和中科院分子细胞科学卓越创新中心周斌研究员是该研究的共同通讯作者。本工作的资金支持来自:国家重点研发计划“发育编程及其代谢调节”重点专项课题“调控哺乳动物心脏和肝脏再生的新策略”(2018YFA0800504)、国家自然科学基金委优青项目(31922020)、北京大学-清华大学生命科学联合中心和南京景瑞康分子医药科技有限公司和南京昕瑞再生医药科技有限公司。Nikon-A1R共聚焦显微镜相关工作在北京大学生命科学学院公共仪器中心完成。
参考文献:
1. Wu, J. et al. An improved factor combination for in vivo reprogramming of cardiac myofibroblast to cardiomyocyte-like cell with dual recombinase tracing. Circulation. 2023;148:00–00.
2. Qian, L. et al. In vivo reprogramming of murine cardiac fibroblasts into induced cardiomyocytes. Nature. 2012; Vol485; 597.
3. Zhao, H. et al. Sall4 and Myocd Empower Direct Cardiac Reprogramming From Adult Cardiac Fibroblasts After Injury. Front Cell Dev Biol. 2021; 9, 608367.
4. Li, Y., He, L. et al. Genetic Lineage Tracing of Nonmyocyte Population by Dual Recombinases. Circulation. 2018;138:793–805.
5. Tao, Y. et al. Robust Small Molecule-Aided Cardiac Reprogramming Systems Selective to Cardiac Fibroblasts. iScience. 2023, in Press (bioRxiv.2023.09.20.558597; doi: https://doi.org/10.1101/2023.09.20.558597).
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.122.062810
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#心肌再生# #细胞重编程# #冠脉动脉粥样硬化#
33