罕见病例|胰腺内副脾误诊2例报告
2024-05-15 临床肝胆病杂志 临床肝胆病杂志 发表于上海
本文报道了2例分别被误诊为胰腺神经内分泌肿瘤和胰腺实性假乳头状瘤的IPAS患者,并分析误诊原因,总结诊疗经验,以期提升临床对IPAS明确鉴别诊断的认识。
1病例资料
病例1:患者女性,58岁,以“体检发现胰腺尾部占位3天”于2019年3月4日入本院,患者2年来体质量下降5 kg,增强CT检查示:胰腺尾部动脉期以及门静脉期显著强化结节,动脉期CT值为198 HU,考虑神经内分泌肿瘤(图1)。超声胃镜示:胰腺尾部低回声病灶(0.6 cm×0.8 cm),为富血供结节。患者癌胚抗原、糖类抗原(CA)19-9、CA125等肿瘤标志物指标正常,既往无糖耐量异常病史,口服葡萄糖耐量试验结果正常。术前诊断为胰腺神经内分泌肿瘤(pNET),患者在全麻下行腹腔镜下胰腺体尾切除术,术后标本可见胰腺内副脾(IPAS)组织,切面红褐色、质韧(图2);术后病理示:胰腺体尾部副脾组织,胰腺组织切缘未见癌(图3)。
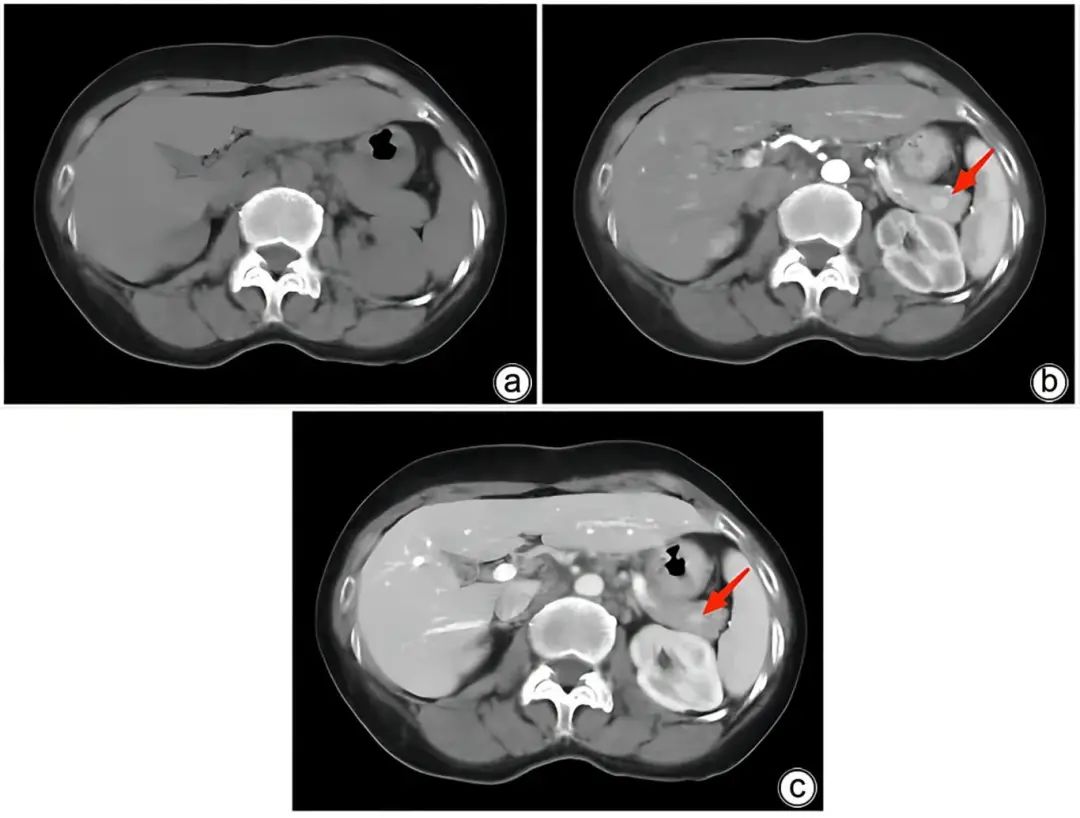
注:a,平扫期;b,动脉期;c,静脉期。胰腺尾部可见大小为0.8 cm×0.7 cm的结节样异常强化影,平扫期显示不清,动脉期明显强化,静脉期呈稍高强化,且动脉期和静脉期强化程度均高于胰腺组织(红色箭头)。
图1 病例1患者术前CT扫描结果
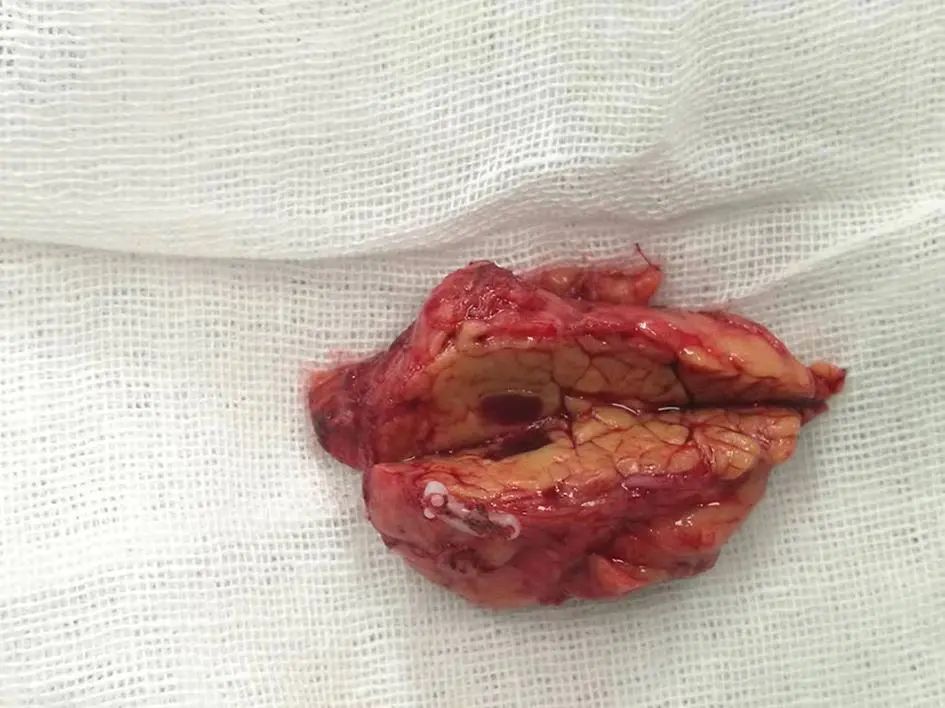
图2 病例1患者术后标本
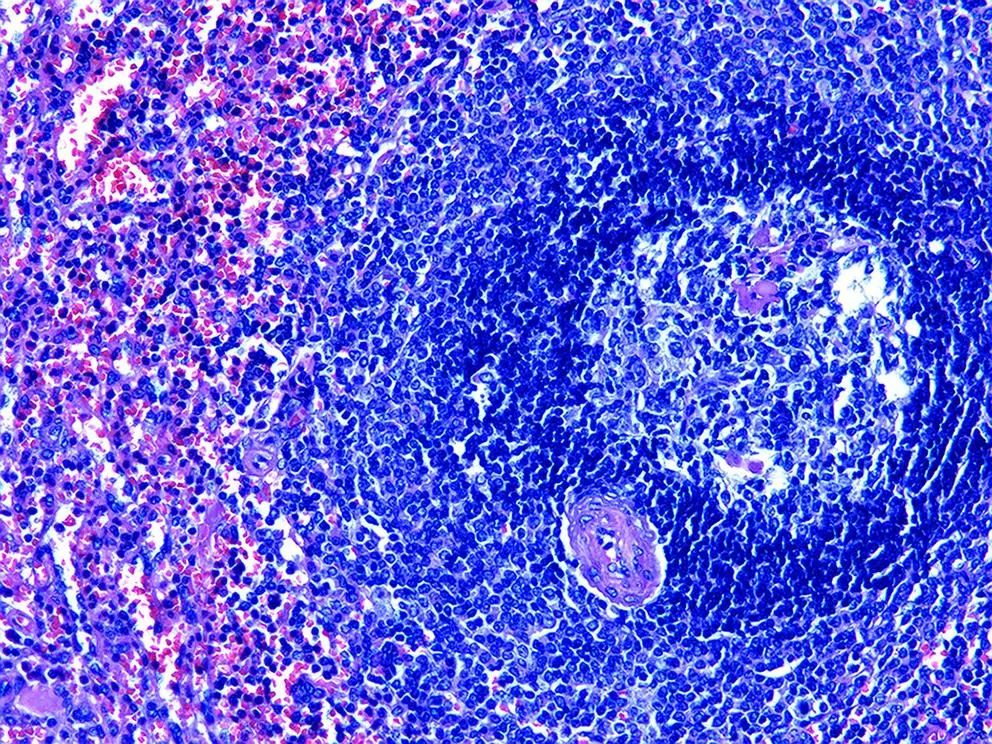
图3 病例1患者术后病理结果(HE染色,×100)
病例1误诊原因分析:(1)CT影像学表现是主要原因之一。胰腺尾部动脉早期和门静脉期均呈显著强化结节,边缘规则,未见腹膜后和周围肿大淋巴结,这些影像学特点与pNET的特点相符。其中,非功能性pNET患者的症状隐蔽,激素水平正常,缺乏特异性肿瘤标志物,因其血供丰富且内部可有变性坏死,当病灶较大时,增强CT可见不均匀强化,但当pNET病灶较小也可表现为均匀强化,此时较难与IPAS区分;(2)该患者虽行超声胃镜检查,但患者家属拒绝行穿刺,遂未操作;(3)未能将病灶强化程度与脾脏强化程度相比,对IPAS的诊断缺乏经验。
病例2:患者男性,60岁,因“间断性腹痛10余天”于2022年9月15日入本院。既往病史:30年前因外伤行脾切除。CT平扫+增强检查示:胰腺钩突部占位,考虑恶性肿瘤可能(图4);胰尾部见类圆形低密度影,较大直径为3 cm,边缘见钙化,增强扫描轻度不均匀强化,实性假乳头状瘤待排除(图5)。术前诊断:胰头钩突肿瘤;胰尾部占位,考虑胰腺实性假乳头状瘤;脾切除术后。肿瘤标志物:CA19-9 1 537.07 U/mL,CA125 125.68 U/mL。术中行胰十二指肠联合胰尾部分切除术;术后病理示:钩突部胰腺导管腺癌(中低分化);胰体尾副脾组织(图6),胰腺组织切缘未见癌。
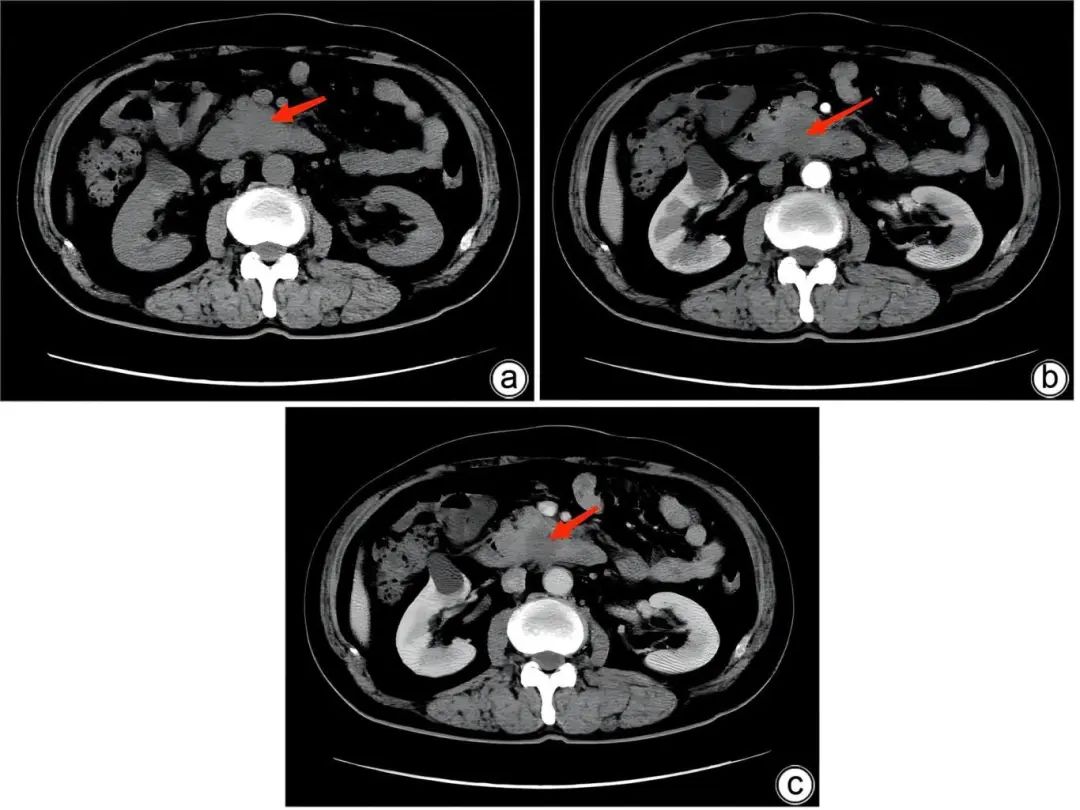
注:a,平扫期;b,动脉期;c,静脉期。胰腺钩突部不规稍低密度影,大小为2.7 cm×3.1 cm,增强扫描呈弱强化,边缘不规则,紧贴肠系膜上静脉,与十二指肠水平段分界不清(红色箭头)。
图4 病例2患者术前胰腺钩突部占位CT扫描
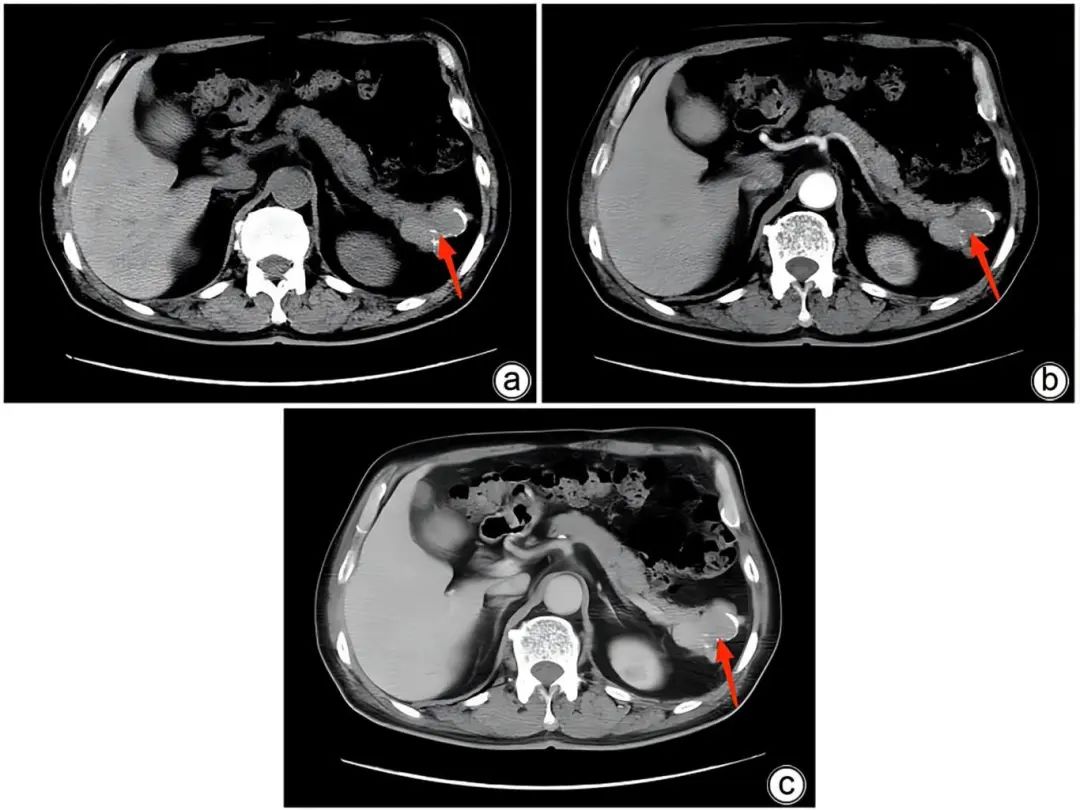
注:a,平扫期;b,动脉期;c,静脉期。平扫期可见胰尾部直径3 cm的类圆形稍低密度影,动脉期和静脉期扫描轻度不均匀强化,边缘可见钙化(红色箭头)。
图5 病例2患者术前胰腺尾部占位CT扫描
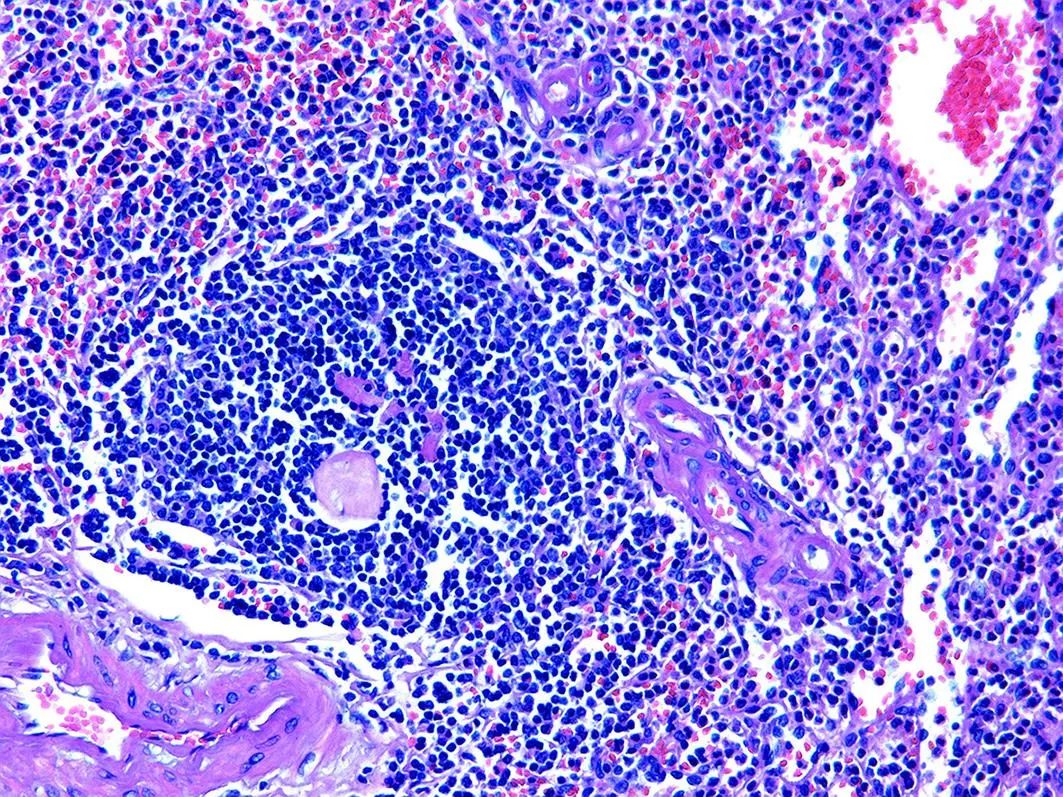
图6 病例2患者术后病理结果(HE染色,×100)
病例2误诊原因分析:(1)该患者有脾切除病史,术前影像学检查提示脾脏缺如,主观上忽视了副脾存在的可能,客观上影像学检查时缺少副脾组织与正常脾脏组织的影像学特点比较。(2)该患者CT特征为胰尾部见类圆形稍低密度影,增强扫描示轻度不均匀强化,边缘可见钙化,可能为胰腺实性假乳头状瘤,或者其他低度恶性肿瘤。而脾脏组织较少发生钙化,该患者胰尾部分占位的钙化表现进一步干扰了临床判断。而胰腺实性假乳头状瘤实性部分和囊壁常呈轻、中度强化,病灶内可见钙化灶,往往位于病灶实性部分、分隔处或其周边包膜。该患者的影像学表现与胰腺实性假乳头状瘤极为相似,对明确鉴别诊断造成严重影响。
2讨论
副脾与胚胎阶段脾脏的胚芽形成密切相关,正常情况下,在胚胎发育第5周,来自间充质细胞的胃背系膜分化为脾脏,但如果脾脏胚芽未完全融合,或者分离出单个细胞,则发育形成副脾。80%的副脾发生在脾门附近,17%发生在胰腺尾部,还可见于胃壁、大网膜、脾结肠韧带、睾丸、肾上腺等部位。副脾的发生率约为10%,其中完全包裹在胰腺内的副脾发生率仅为2%,即IPAS。IPAS最常被误诊为pNET,pNET分为功能性pNET和非功能性pNET,功能性pNET易通过患者激素水平及其他临床症状与IPAS鉴别诊断,而IPAS最易被误诊为非功能性pNET。pNET在所有胰腺肿瘤中占比不超过2%,非功能性pNET仅占全部pNET的15%~41%,其中大多数为恶性,肿瘤根治性切除是实现患者长期生存最重要的手段,因此对肿瘤最大径>2 cm的非功能性pNET必须手术切除,此外,除了肿瘤最大径<1 cm或手术风险较大者,其余≤2 cm的非功能性pNET也均应行手术切除。但IPAS无需外科干预,故对二者的明确鉴别诊断具有重要的临床意义。
IPAS无明显特异性临床表现,其诊断主要依靠影像学检查。在CT平扫中,IPAS表现的密度与脾脏相似,增强扫描强化程度高于胰腺组织,与脾脏一致,动脉期表现为“花斑样”不均匀强化,门静脉期为均匀强化,但当IPAS直径较小时,动脉期也表现为均匀强化。MRI对IPAS的诊断也有重要价值,IPAS的T1WI信号低于胰腺,T1WI可显示肿块的位置、边缘、形态,T2WI信号表现为与脾脏等信号,MRI强化特点与CT强化类似。由于IPAS的白髓与红髓比例较高,有时在T2加权像上IPAS的信号强度略高于脾脏。此外,弥散加权成像对IPAS的诊断也有积极意义,尤其在鉴别IPAS与胰腺实体肿瘤方面。比IPAS更罕见的是IPAS伴上皮样囊肿(ECIPAS)。ECIPAS直径通常为2~4 cm;病理学镜下通常表现为囊肿内衬复层鳞状上皮,囊外可见脾脏组织;CT和MRI检查的主要着眼点为识别囊肿周围的脾脏组织,ECIPAS的CT表现为实性部分强化,强化程度与脾脏类似,囊性部分CT平扫呈低密度,增强后不强化。明确的术前影像学诊断和术中冰冻病理切片对于避免过度治疗至关重要。
此外,由于副脾和脾脏具有相同的生理功能,因此具有脾脏功能显示作用的放射性核素扫描在鉴别IPAS和pNET也有重要价值。脾脏组织利用网状内皮细胞可拦截并破坏衰老的红细胞,99mTc标记的热变性红细胞(99mTc-HDRBC)可以在脾脏和IPAS处浓聚,并在核素检查中显影。然而,当脾脏包裹胰尾或覆盖IPAS时,IPAS处的显影被正常脾脏组织掩盖,易造成误诊。非功能性pNET因其含有生长抑素受体,故可通过68Ga生长抑素类似物(68Ga-SSA)核素扫描进行鉴别,其在诊断pNET方面比MRI更敏感,但假阳性率较高,只有当68Ga-SSA图像中摄取显著高于脾脏才具有诊断价值,可能与脾脏组织中淋巴细胞同样含有生长抑素受体有关。常规超声内镜(EUS)对IPAS的诊断价值有限,但可利用Levovist或Sonazid作为静脉造影剂的对比增强EUS来提高诊断IPAS的能力。Makino等研究发现,以Sonazoid作为造影剂的增强EUS对IPAS中存在的丰富血管和网状内皮细胞系统较为敏感。此外,IPAS与pNET在EUS定性定量弹性成像下表现也有差异,IPAS由于病灶质地松软呈现绿色为主的图像,pNET则由于病灶质地较硬呈现质地均匀的蓝色图像。进一步将弹性成像结果量化为弹性应变率比值可以提高诊断效率。
除了影像学检查以外,EUS引导下细针穿刺(EUS-FNA)检查是鉴别IPAS的高特异性手段。Tatsas等研究发现,脾窦薄层血管的内皮细胞中的CD8经免疫细胞化学染色可检出,只要取得脾窦的内皮细胞即可诊断为副脾。但由于肿块较小、位置较深等不利因素,往往无法准确取得病理标本,且细针穿刺可能导致胰漏、出血等不良事件。当影像学检查无法确诊且胰腺内肿块较大时,EUS-FNA仍值得考虑。近年来,基于探针的激光共聚焦显微内镜检查(CLE)在诊断胰腺占位肿块的应用成为研究热点,CLE可以通过获取放大1 000倍后的黏膜图像来识别细胞和亚细胞的微结构,并进行活体组织学诊断(光学虚拟活检)。CLE既可以避免EUS-FNA的副损伤,又可与EUS-FNA联合应用提高胰腺肿块的诊断准确度。
避免副脾的误诊,首先需要临床医师对IPAS具备充分的认识,对位于胰腺尾部、直径1~3 cm、边界清、质地均匀的富血管病灶,应考虑IPAS的可能性。其次,在鉴别诊断过程中需要综合利用CT、MRI、PET-CT等影像学检查,尤其是99mTc-HDRBC等敏感性较高的检查。必要时可采用EUS-FNA检查,但要提高操作技巧,避免发生不良事件。确诊IPAS的患者无需手术治疗,随访观察即可。总之,临床上应进一步提升对IPAS的认识与鉴别,避免IPAS患者被误诊并接受非必要手术,增加医疗负担。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240223

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#胰腺# #误诊# #脾疾病#
9