酮类物质治疗阿尔茨海默病
2016-07-11 佚名 生物谷
尽管几十年来努力开发一种预防或治愈阿尔茨海默病(Alzheimer's disease, AD)--折磨着老年人群的最为常见的痴呆症---的药物,但是当前还没有治疗这种破坏性疾病的方法。越来越多的研究提示着这样的一种特效疗法可能已经存在,但不是以药丸的形式,而只是简单的饮食变化。而且越来越多的研究报道改善代谢健康的干预性方法能够缓解症状和降低与AD相关联的脑部病变。一种流行的理论是AD有多种病
越来越多的研究提示着这样的一种特效疗法可能已经存在,但不是以药丸的形式,而只是简单的饮食变化。而且越来越多的研究报道改善代谢健康的干预性方法能够缓解症状和降低与AD相关联的脑部病变。
一种流行的理论是AD有多种病因,但是它们的共同之处可能涉及代谢功能障碍。确实,较差的代谢健康的标志物,如糖尿病、炎症和高胆固醇水平是AD的主要风险因素。
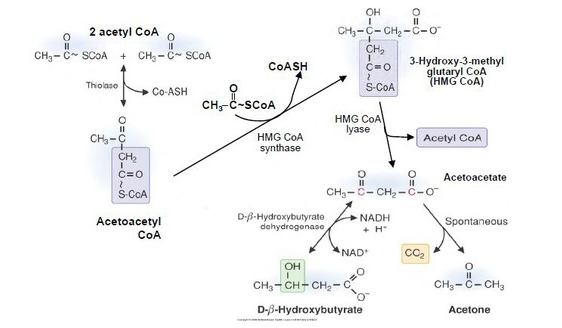
正与我们的肌肉一样,大脑需要能量正常运转。但是不同于肌肉细胞的是,当葡萄糖短缺时,比如在进食期间或者进行低碳水化合物饮食时,大脑中的神经元拥有一种独特的能力:代谢作为替换能量来源的酮类物质。
早在二十世纪二十年代,科学家们已发现促进酮生成(ketogenesis)的高脂肪饮食可控制癫痫症,而且酮生成仍然是治疗这种疾病的最为有效的方法之一。这就提高了酮类物质也对起源自异常神经代谢的其他疾病(如AD)提供神经保护作用的可能性。从那时起,就有研究证实酮类物质事实上确实改变脑部代谢,降低神经病变和缓解行为症状。
酮类物质缓解AD症状
在过去的10年里,几项研究已支持酮生成在认知损伤患者中的临床治疗价值。在2004年的一项研究中,20名AD或轻度认知损伤(Mild Cognitive Impairment, MCI)患者接受安慰剂或中链甘油三酯---一类在椰子油和棕榈油中发现的饱和脂肪,能够促进酮类物质产生---治疗。接受中链甘油三酯治疗90分钟后增加酮类物质水平,而且这些较高的酮类物质水平对应着更好的记忆改善。在这些初步的短期发现5年后,针对152名轻度AD患者的一项更大的更长期的研究开展了。在45天后,相比于接受安慰剂治疗的患者而言,接受一种生酮化合物(ketogenic compound)治疗的那些患者表现出认知改善。然而,这两项研究都提示着酮生成给大脑带来的益处可能依赖于遗传因素。
在前面的那项项研究中,中链甘油三酯仅在缺乏ApoE4等位基因---AD的一种遗传风险因素---的参与者体内发挥改善认知功能的作用。类似地,在后面的那项研究中,在缺乏ApoE4等位基因的那些患者体内认知改善更为强烈和更为持久—可持续90天。
一项新的发表在PLoS ONE期刊上的研究证实小鼠对饮食产生的不同反应依赖于它的遗传因素:高脂肪饮食仅仅降低缺乏ApoE4基因的小鼠大脑中的ApoE水平。
这些大有希望的关于生酮化合物的早期发现为饮食干预可能类似地有益于大脑健康提供希望。2012年的一项研究测试了记忆是否能够仅仅通过选择一种低碳水化合物饮食而得以改善,而不需要使用在之前的研究中所使用的补充剂。在23名MCI患者当中,相比于那些接受高碳水化合物饮食的患者,在6周内进行低碳水化合物饮食的患者表现出记忆改善。这些记忆改善与酮类物质水平相关联,但不与消耗的卡路里(能量单位)、胰岛素水平或体重相关联,这就表明增加的酮生成很可能是低碳水化合物饮食导致的认知改善的原因。
其他潜在的治疗方法在早期AD中表现出类似的短期治疗效果,但是当在较为晚期的AD病例的长期治疗中都失败了。
尽管酮生成还没有在正式的临床试验中接受过严格地测试,但是最近的一项病例研究提供有说服力的证据证实酮类物质可能事实上在临床病例中也能维持疗效。
一名63岁的晚期AD男性患者开始吃椰子油和中链甘油三酯,其中已知这两者都能够提高酮类物质水平。在仅仅2.5个月后,他在一种在国内外广泛使用的简易精神状态测试(Mini Mental State Exam)中的得分从最低的12增加至20(最高为30)。
在两年后,他的认知能力和日常生活功能都得到改善,而且他的核磁共振成像(MRI)结果表明没有发生进一步的脑萎缩。在这名患者的饮食治疗方案中加入一种酮酯补充剂后,他在他的情绪、自我满足和记忆方面表现出更加进一步的改善。
显著的是,他携带ApoE4基因。因此,酮生成似乎对携带ApoE4基因的患者而言是高度有益处的,即便早前的研究表明对那些缺乏这种风险因素的患者而言,它是更加有益的。
酮类物质如何保护大脑
科学家们寻求AD模式动物来更好地理解酮生成如何可能保护人类大脑免受神经退化。在AD模式小鼠中,相比于那些进行标准饮食的小鼠而言,水平增加的有毒性的β-淀粉样蛋白在接受高脂肪/低碳水化合物饮食的小鼠大脑中下降了。
最近的一项研究有助揭示酮类物质的代谢益处、较低的β-淀粉样蛋白和改善的认知功能之间的关联。这项研究在AD模式小鼠体内和经过β-淀粉样蛋白处理的神经元中测试了酮类物质的影响。尽管β-淀粉样蛋白增加氧化反应,破坏一种线粒体酶复合物的功能,但是酮类物质还是能够逆转这些影响,从而证实了它们的神经元代谢益处。
再者,酮类物质降低β-淀粉样蛋白水平,阻断β-淀粉样蛋白诱导的细胞膜中的孔形成,这就表明酮类物质能够抵抗β-淀粉样蛋白相关联的神经元损伤。
最后,在受到β-淀粉样蛋白的破坏后,酮类物质恢复了正常的突触可塑性和记忆力表现。
利用酮生成治疗疾病
如果酮生成被证实能够有效地治疗AD,但是还需进一步的研究来确定合适的给药方法,这是因为高脂肪饮食、中链甘油三酯或酮生成化合物可能在疗效上存在差异。进行严格饮食或服用补充剂的患者依从性可能也会带来潜在的挑战。鉴定出最小有效剂量将有助于为一种治疗需要在多大严格程度上开展制定指导方针。
尽管仍然存在一些问题,对酮生成治疗潜力的强有力证据支持为在我们针对AD的战斗中一种强大的武器可能已经存在而且这种治疗试剂可能与一勺椰子油一样可口---提供希望。
参考文献:
【1】Ketones to combat Alzheimer's disease
【2】Study of the ketogenic agent AC-1202 in mild to moderate Alzheimer's disease: a randomized, double-blind, placebo-controlled, multicenter trial
Nutrition & Metabolism, doi:10.1186/1743-7075-6-31
【3】Ketones block amyloid entry and improve cognition in an Alzheimer's model
Neurobiology of Aging, doi:10.1016/j.neurobiolaging.2015.11.018
【4】Dietary ketosis enhances memory in mild cognitive impairment
Neurobiology of Aging, doi:10.1016/j.neurobiolaging.2010.10.006
【5】High-Fat Diet Changes Hippocampal Apolipoprotein E (ApoE) in a Genotype- and Carbohydrate-Dependent Manner in Mice
PLoS ONE, doi:10.1371/journal.pone.0148099
【6】A new way to produce hyperketonemia: Use of ketone ester in a case of Alzheimer's disease
Alzheimer's & Dementia, doi:10.1016/j.jalz.2014.01.006
【7】Effects of β-hydroxybutyrate on cognition in memory-impaired adults
Neurobiology of Aging, doi:10.1016/S0197-4580(03)00087-3
【8】A ketogenic diet reduces amyloid beta 40 and 42 in a mouse model of Alzheimer's disease
Nutrition & Metabolism, doi:10.1186/1743-7075-2-28
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#阿尔茨海#
31
#阿尔茨#
25
好文值得点赞!继续关注学习。
38
#阿尔茨海默#
39