ATVB 北京大学徐涛/姚伟娟团队揭示雄激素剥夺治疗相关动脉粥样硬化进展的机制
2024-01-13 论道心血管 论道心血管 发表于陕西省
该研究揭示了FSH通过诱导内皮炎症以及单核内皮细胞粘附,促进雄激素剥夺治疗相关的动脉粥样硬化形成。
前列腺癌目前仍是发达国家男性所有恶性肿瘤中发病率位居第一的癌种1。在国内,初诊即为局部进展或转移性前列腺癌的患者比例较高,这类患者也常常丧失了最佳的手术时机2。临床上通常需要通过内分泌治疗(去势治疗)来控制病情进展3。传统的手术去势因为创伤大、术后患者的心理负担过重已被逐渐摒弃。近年来药物去势已成为临床主流4,其中促性腺激素释放激素(Gonadotropin-releasing hormone, GnRH)激动剂(亮丙瑞林、戈舍瑞林等)以及GnRH拮抗剂(地加瑞克)便是其中的代表。然而近年来越来越多的研究证实GnRH激动剂相比拮抗剂能够增加前列腺癌患者的心血管死亡风险5,6,且这一比例已逐渐接近肿瘤本身引起的死亡7,8,其中的原因尚不清楚。
尽管上述两种药物均可以使体内睾酮达到去势水平,但两者的作用方式不尽相同,因此也诱发体内相关激素水平发生相应的变化,其中变化较为明显的激素即为卵泡刺激素(Follicle stimulating hormone, FSH)。GnRH激动剂由于存在“点火效应”,用药初期患者体内FSH水平明显升高;而GnRH拮抗剂则通过直接阻断下丘脑-垂体-性腺轴,导致FSH水平迅速下降9。
动脉粥样硬化作为早期的血管病变,参与绝大多数心血管不良事件的发生和发展。前列腺癌患者由于使用GnRH激动剂导致体内FSH水平一过性升高,而这是否能成为引发动脉粥样硬化和心血管不良事件的始动因素,便成为研究人员重点研究的内容。
2024年1月11日,北京大学人民医院徐涛课题组和北京大学基础医学院生理学系姚伟娟课题组合作在Arteriosclerosis, Thrombosis, and Vascular Biology杂志在线发表题为“FSH is responsible for androgen deprivation therapy-associated atherosclerosis in mice by exaggerating endothelial inflammation and monocyte adhesion”的研究论文,揭示了FSH通过诱导内皮炎症以及单核内皮细胞粘附,促进雄激素剥夺治疗相关的动脉粥样硬化形成。

传统研究认为,雄激素对心血管具有一定的保护作用,抑制动脉粥样硬化进展。首先,为明确去势状态下究竟低雄激素水平和FSH高水平究竟哪一个因素参与动脉粥样硬化过程,研究人员利用雄性ApoE-/-小鼠构建了手术去势(Castration, CAS)小鼠模型,通过人为注射激素改变小鼠体内睾酮(Testosterone, T)和FSH水平,初步证实FSH水平的长期升高(而非睾酮降低)与手术去势相关的动脉粥样硬化斑块形成有直接相关性,同时发现FSH水平长期升高的小鼠体内炎症因子如VCAM-1、MCP-1等表达水平明显升高。
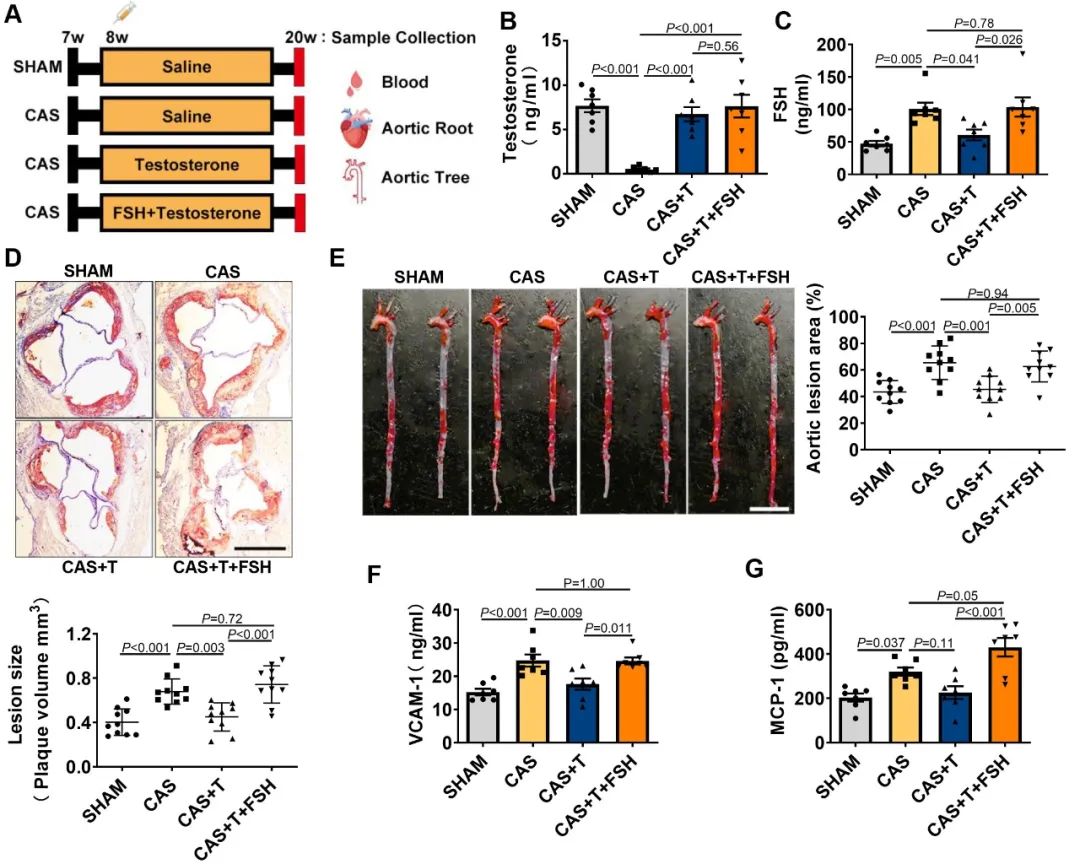
接下来,为了观察药物去势相关的FSH水平一过性升高对动脉粥样硬化发生发展的影响,研究人员在ApoE-/-小鼠中分别注射GnRH激动剂亮丙瑞林(leuprolide, Leu)、GnRH拮抗剂地加瑞克(Degarelix, Deg)以模拟不同的药物去势。结果发现,相比于GnRH拮抗剂,GnRH激动剂使小鼠的动脉粥样硬化斑块负荷更重,且斑块变得更不稳定。血脂分析和脂质组学结果显示,与对照组相比,GnRH激动剂并没有引起小鼠体内脂质水平的改变,而GnRH拮抗剂则引起了小鼠HDL水平升高以及磷脂表达谱的显著改变。这提示,GnRH激动剂相关的动脉粥样硬化可能与FSH一过性升高有关。
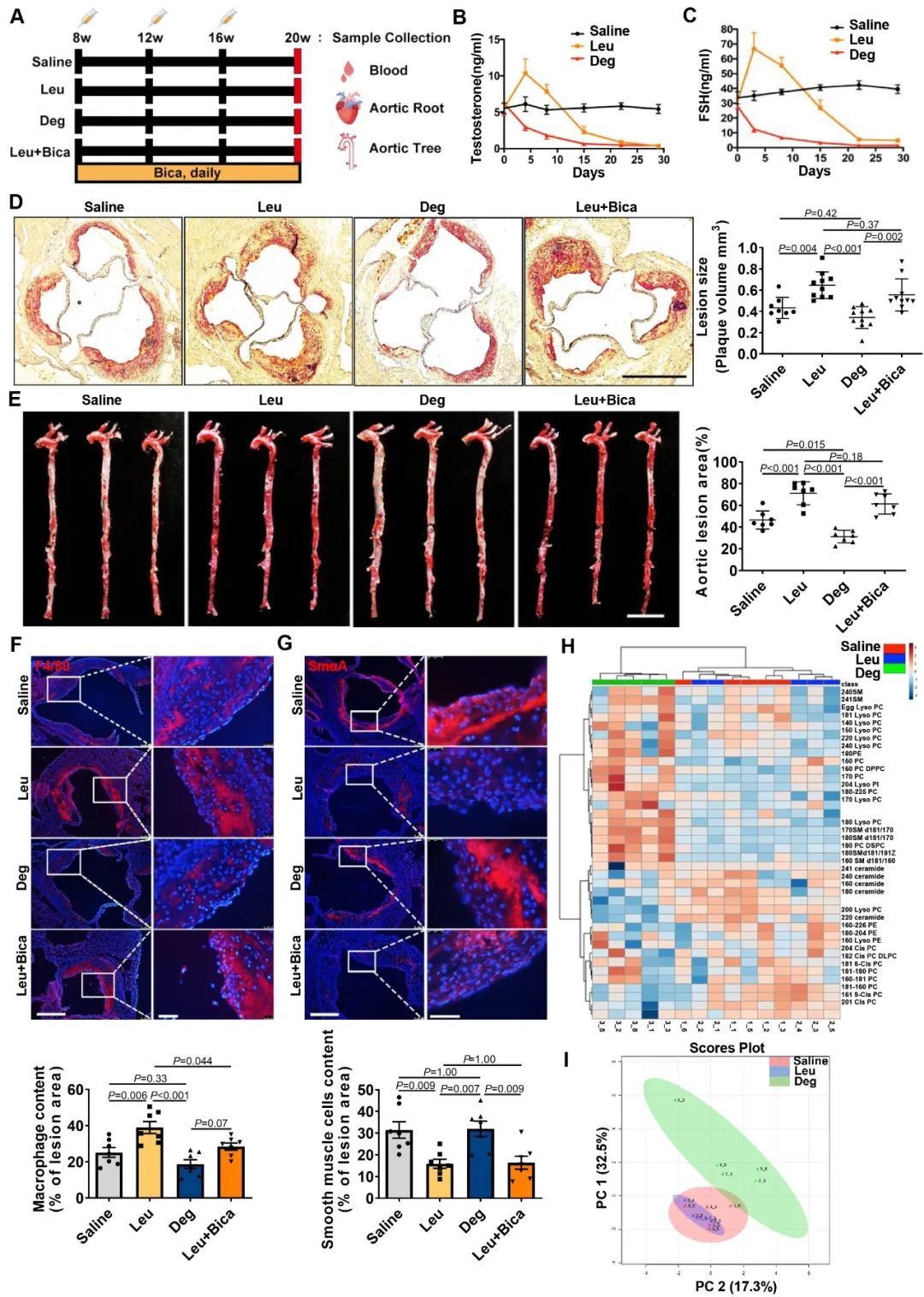
为了证明短期FSH水平升高的确参与了GnRH激动剂相关的动脉粥样硬化的发生,研究人员在GnRH激动剂药物去势的同时通过腹腔注射FSHβ特异性抗体以阻断FSH发挥作用,结果发现FSHβ抗体的处理引起了动脉粥样硬化斑块体积的明显下降;而在GnRH拮抗剂药物去势的同时短暂注射FSH之后,发现动脉粥样硬化斑块的数量明显增多。以上结果证明了FSH确实参与了雄激素剥夺治疗相关的动脉粥样硬化的发生和发展。
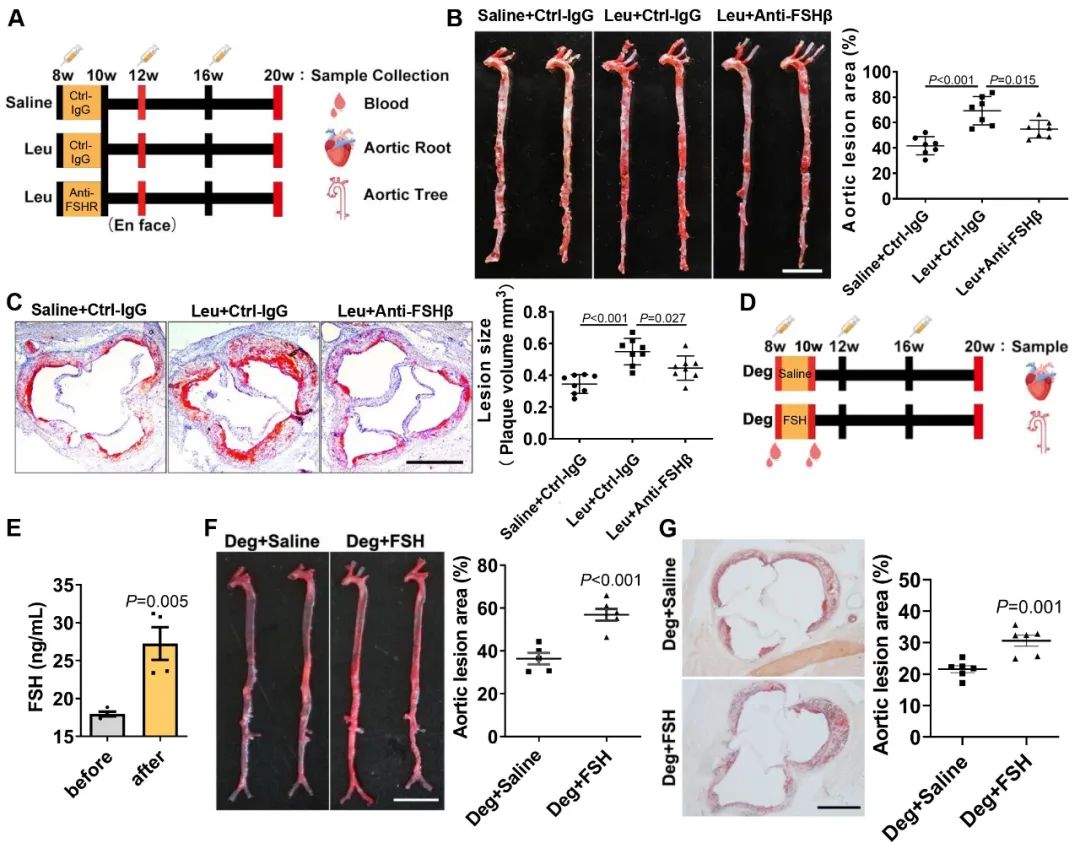
为了进一步探索FSH诱导动脉粥样硬化的具体分子机制,研究人员回归到细胞实验。结合前期动物实验以及初步细胞功能筛选实验发现,FSH主要发挥作用的细胞亚群为血管内皮细胞以及单核巨噬细胞。在内皮细胞中FSH通过协同肿瘤坏死因子α (TNF-α)这一促炎因子,显著诱导血管内皮粘附分子VCAM-1、E-selectin等的表达。重要的是,对内皮细胞进行短期FSH处理后仍能加强TNF-α诱导的内皮细胞粘附分子表达。
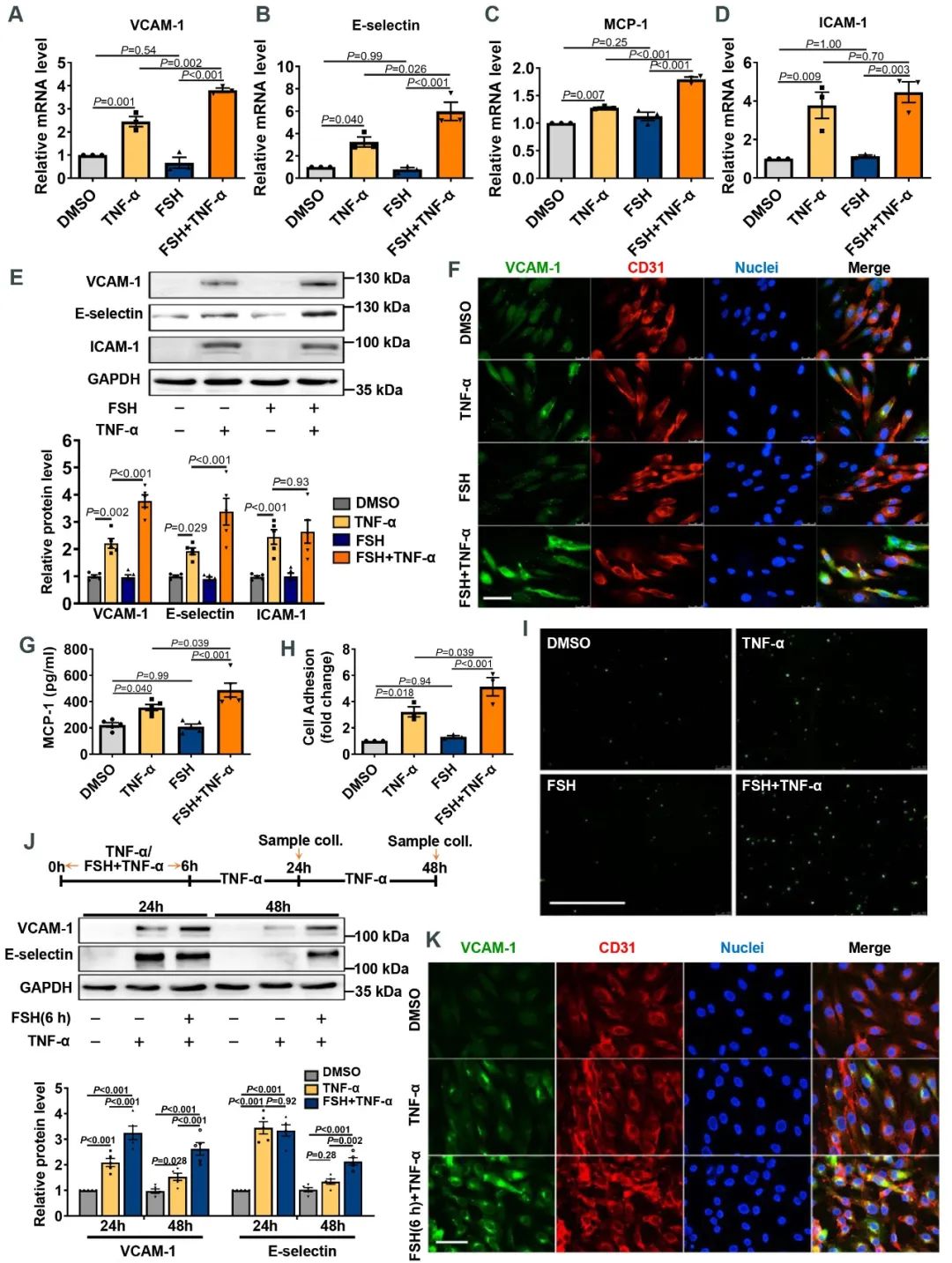
在单核细胞中,FSH处理引起了粘附相关分子CD29、L-selectin表达的明显升高,单核与内皮细胞的粘附显著增加,这一结果在动物实验中也得到了进一步验证。
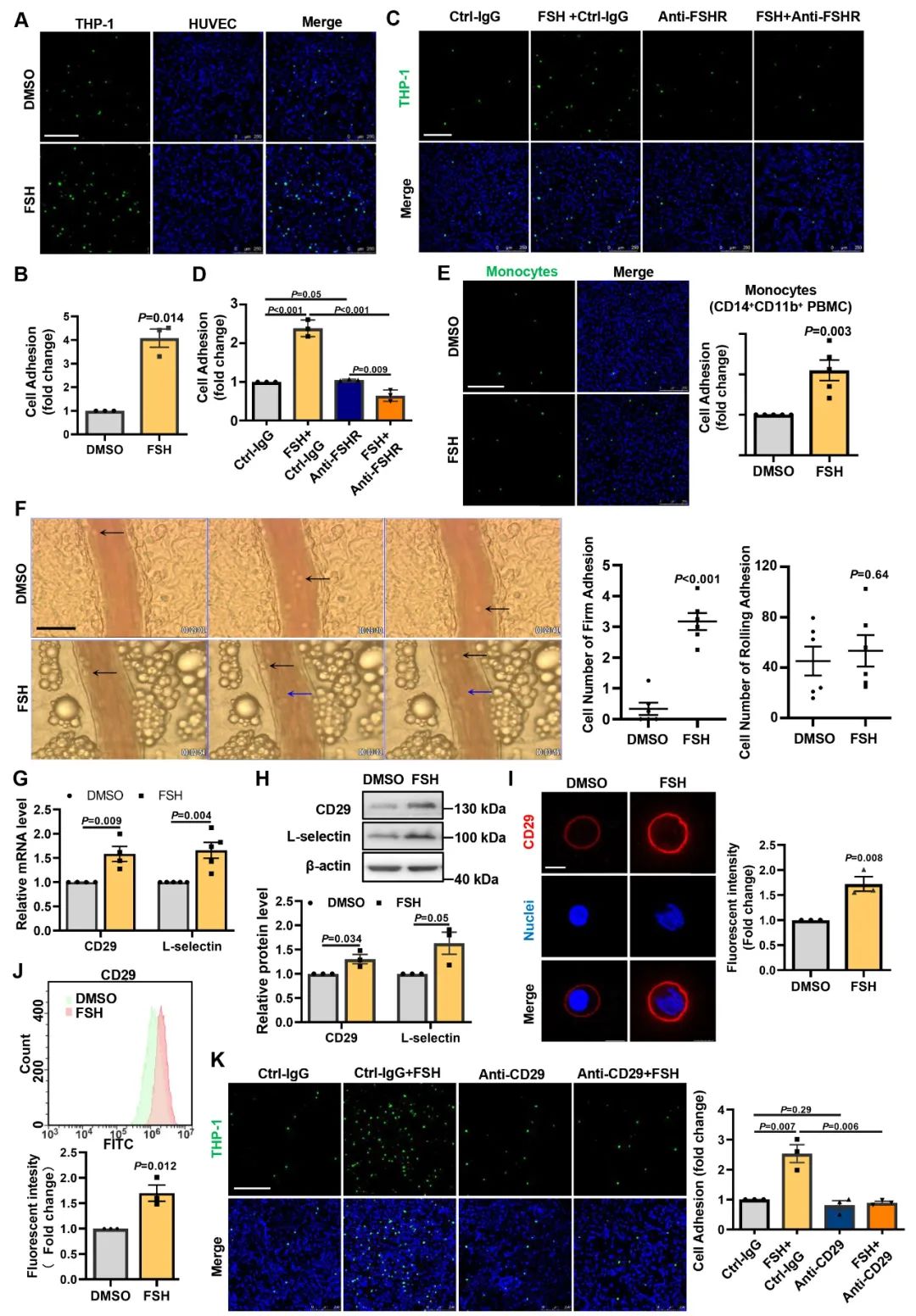
接下来,研究人员进一步挖掘FSH诱导内皮炎症及单核细胞粘附的具体分子机制。首先通过文献复习初步筛选出FSHR常见的下游信号通路,进而通过小分子抑制剂、敲减实验进一步筛选出cAMP/PKA/CREB以及PI3K/AKT/GSK-3β两条信号通路参与了FSH协同TNF-a诱导的内皮炎症,而c-Jun、GATA-6作为关键转录因子结合于VCAM-1启动子区域,促进VCAM-1表达。
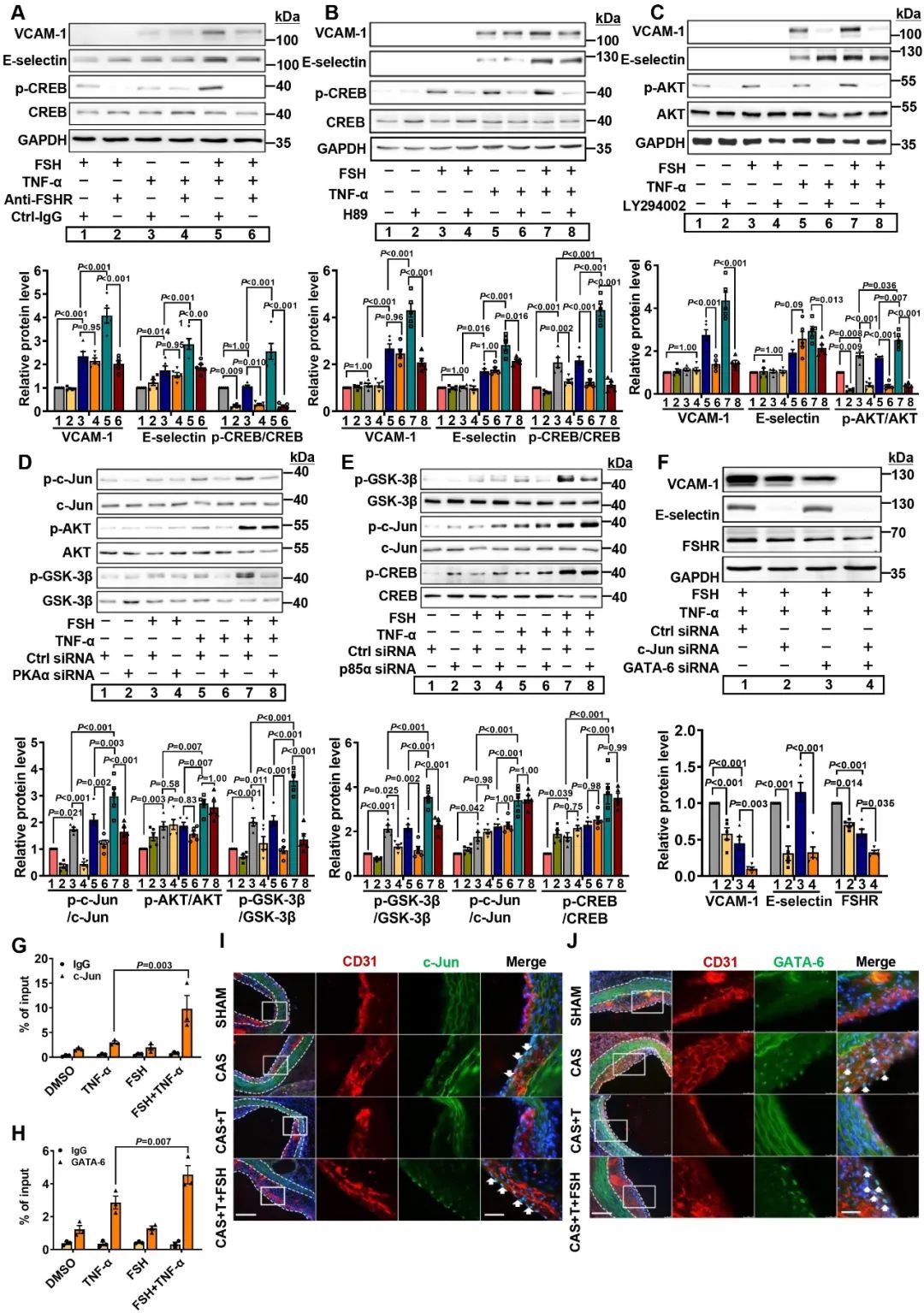
在单核细胞中,PI3K/AKT/GSK-3β通路同样参与其中,而SP1作为关键转录因子结合于CD29启动子区域,促进CD29表达,诱导单核细胞与内皮粘附这一过程。
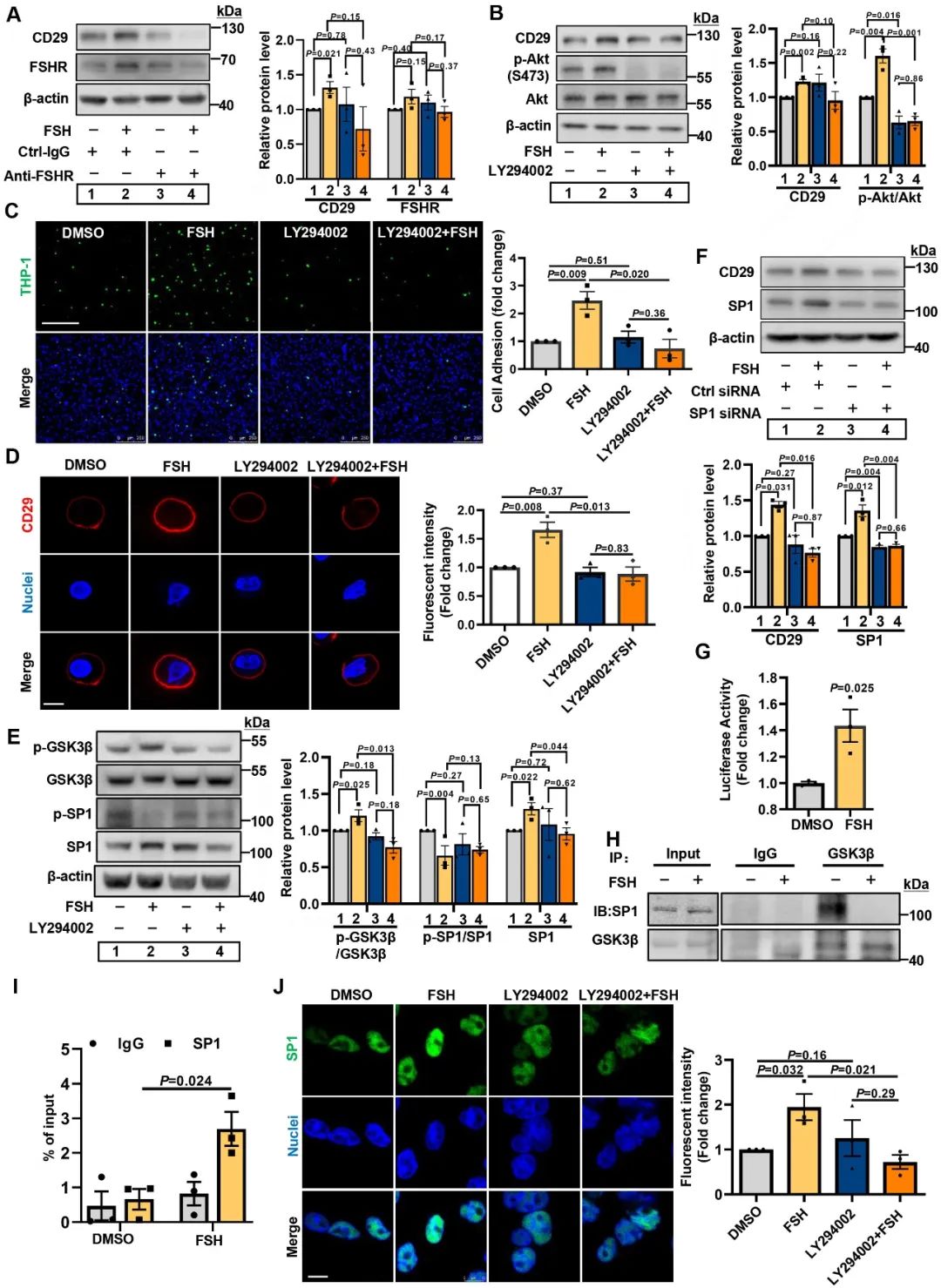
为了明确FSHR能否成为抑制动脉粥样硬化的潜在治疗靶点,研究人员构建了ApoE-/-小鼠颈总动脉部分结扎及特异性敲减内皮细胞FSHR的腺病毒孵育模型。在证实颈总动脉内皮细胞FSHR被敲减后,研究人员使用GnRH激动剂行药物去势处理,结果发现无论是颈总动脉内斑块数量、亦或内膜厚度都有不同程度的减轻,进一步检测发现颈动脉内皮转录因子c-Jun、GATA-6表达明显下调,最终导致VCAM-1水平下降。这也证实抑制FSHR信号通路可以缓解内皮炎症,从而减缓雄激素剥夺治疗相关的动脉粥样硬化进展。
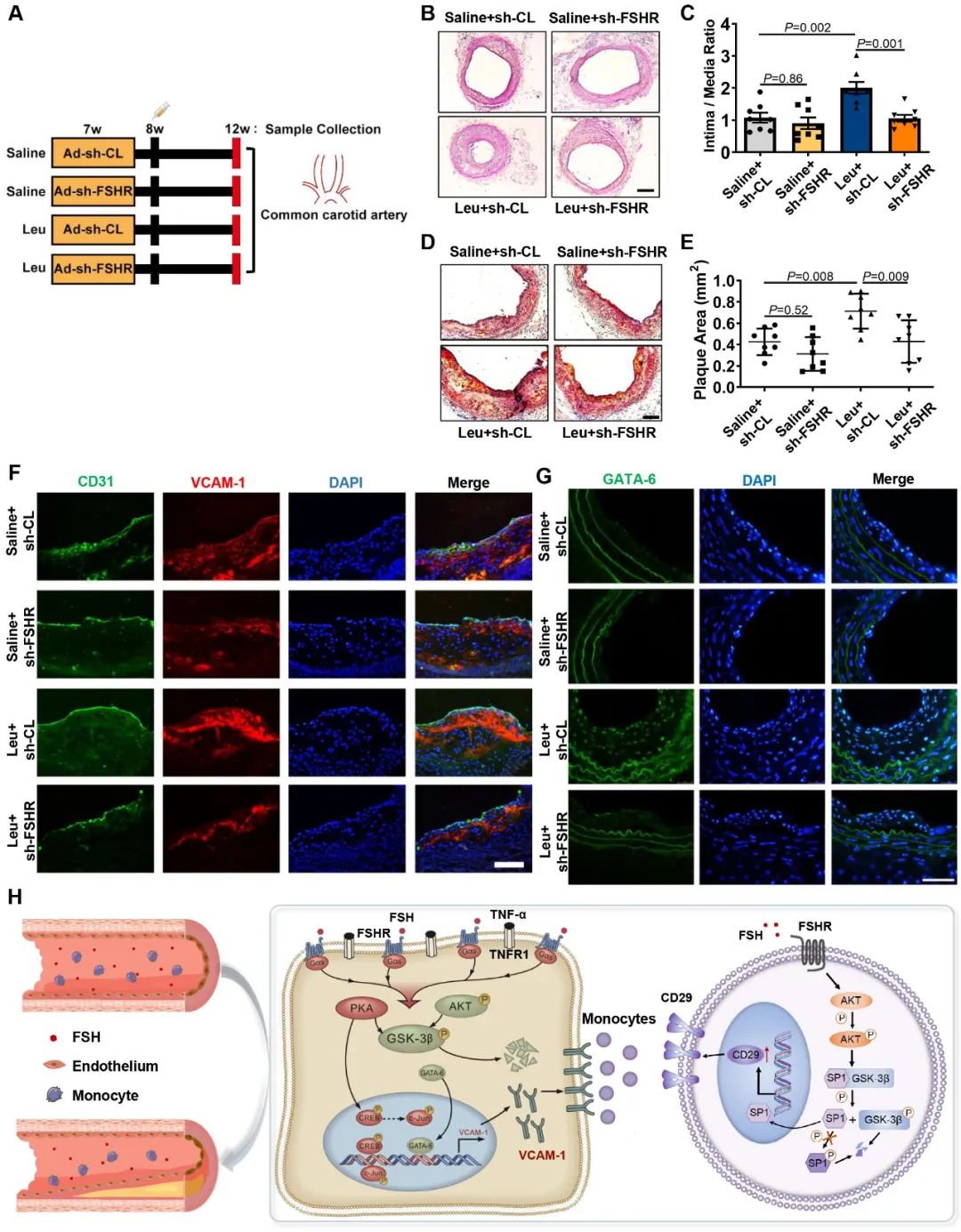
上述研究结果提示前列腺癌患者使用GnRH激动剂过程中之所以发生更高比例的心血管不良事件,很可能是由于体内FSH激素水平变化所引起。未来或许需要在一定程度上调整前列腺癌患者的内分泌治疗模式,譬如使用GnRH拮抗剂,或者在使用GnRH激动剂的同时加用FSH/FSHR阻断剂或心血管保护药物等,在最大程度上提高前列腺癌患者的总生存。
北京大学人民医院泌尿外科博士生王强(现为电子科技大学附属肿瘤医院泌尿外科主治医师)、韩敬丽博士(现为北京大学人民医院血液病研究所博士后)和北京大学基础医学院生理与病理生理学系硕士生梁振辉为论文的共同第一作者。北京大学人民医院泌尿外科徐涛教授和北京大学基础医学院生理与病理生理学系姚伟娟副教授为共同通讯作者。研究获得了国家自然科学基金(No. 82071777, 32171143, 31570938, 31771280, 11732001, 32325030)、北京大学医-X交叉种子基金的资助和支持。该研究还得到了北京大学基础医学院生理与病理生理学系周菁教授的指导。
参考文献:
1. Siegel RL, Miller KD, Wagle NS, Jemal A. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):17-48.
2. 叶定伟,朱耀中国前列腺癌的流行病学概述和启示中华外科杂志,2015, 53 (4 ) : 249-252.
3. Desai K, McManus JM, Sharifi N. Hormonal Therapy for Prostate Cancer. Endocr Rev. 2021;42(3):354-373.
4. Chen DY, See LC, Liu JR, et al. Risk of Cardiovascular Ischemic Events After Surgical Castration and Gonadotropin-Releasing Hormone Agonist Therapy for Prostate Cancer: A Nationwide Cohort Study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2017:JCO2016714204.
5. Hu JR, Duncan MS, Morgans AK, et al. Cardiovascular Effects of Androgen Deprivation Therapy in Prostate Cancer: Contemporary Meta-Analyses. Arterioscler Thromb Vasc Biol. 2020;40(3):e55-e64.
6. Albertsen PC, Klotz L, Tombal B, Grady J, Olesen TK, Nilsson J. Cardiovascular morbidity associated with gonadotropin releasing hormone agonists and an antagonist. Eur Urol. 2014;65(3):565-573.
7. Weiner AB, Li EV, Desai AS, Press DJ, Schaeffer EM. Cause of death during prostate cancer survivorship: A contemporary, US population-based analysis. Cancer.2021;127(16):2895-2904.
8. Ye Y, Zheng Y, Miao Q, Ruan H, Zhang X. Causes of Death Among Prostate Cancer Patients Aged 40 Years and Older in the United States. Frontiers in oncology.2022;12:914875.
9. Rosario DJ, Davey P, Green J, et al. The role of gonadotrophin-releasing hormone antagonists in the treatment of patients with advanced hormone-dependent prostate cancer in the UK. World Journal of Urology. 2016;34(12):1601-1609.
原文链接:
https://www.ahajournals.org/doi/10.1161/ATVBAHA.123.319426
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#动脉粥样硬化# #雄激素剥夺#
18