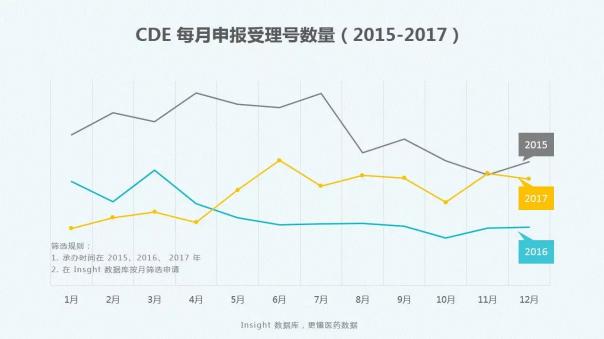
2017全年CDE药品审评报告
Insight数据库2017年终报告梳理了2017年CDE药品申报和审评的数据情况,让大数据来为你指路。
Insight数据库 - 药品审评,CDE,2017 - 2018-01-12
2019年6月CDE药品审评情况报告
摘要· 6月CDE共承办药品注册申请628件· 恒瑞医药提交马来酸吡咯替尼新适应症临床申请· 正大天晴首家提交甲磺酸仑伐替尼胶囊仿制申请· 9个品种通过仿制药一致性评价· 69个受理号获临床试验默示许可总体承办情况:药品注册申请628个据MED中国药品审评数据库2.0统计,2019年6月CDE共承办药品注册申请628个。
米内网 - CDE,药品审评 - 2019-07-04
国外上市急需药品可以直接在CDE申请上市,免做临床
8月8日,药品审评中心(CDE)发布了《关于征求境外已上市临床急需新药名单意见的通知》,其对近年来美国、欧盟或日本批准上市新药进行了梳理,遴选出了Alectinib Hydrochloride 等48个境外已上市临床急需新药名单
生物探索整理自CDE - 急需药品,药品管理,CDE,境外 - 2018-08-09
药品评审中心(CDE)已受理Pamiparib治疗卵巢癌的新药申请
生物技术公司百济神州今日宣布,中国药品监督管理局(NMPA)的药品评审中心(CDE)已接受百济神州PARP1和PARP2研究性抑制剂Pamiparib的新药申请(NDA)。
MedSci原创 - 卵巢癌,PARP1,Pamiparib - 2020-07-18
CDE与山东省药监局达成战略合作 共同提升药品审评能力
为加快推进药品审评审批制度改革,促进国家总局及省局技术审评优势互补,共同推进药品技术审评能力建设,5月26日,国家食品药品监督管理总局药审中心与山东省食品药品监督管理局签署战略合作协议。
医药魔方 - 药品审评,CFDA,山东 - 2017-06-23
CDE公布第二批临床急需境外新药名单,共30个药品,其中14个罕见病药
今日(3月28日),CDE发布《关于第二批临床急需境外新药的公示》,共计30个药品,其中14个罕见病药,包括治疗法布雷病、乙型血友病、肺动脉高压、多发性硬化、肌萎缩侧索硬化和防治严重危及生命疾病的药物遗传性血管性水肿等等罕见病的重磅急需药
医谷 - 临床急需境外新药名单 - 2019-03-28
直播:从CDE新政看临床未满足需求
高博士, MedSci研究员/资深讲师, 拥有丰富的生物医药科研从业经历,对科研创新发现、基金申请与写作、研究设计等具有丰富的经验,对基金政策有较深的理解,培训和指导过大量年青专家
MedSci原创 - 2021-08-18
CDE发布征求CAR-T指导原则意见
嵌合抗原受体T细胞治疗产品具有新颖性、复杂性和技术特异性的特点,随着此类产品的研发进展和陆续申报上市,为促进企业及早发现此类产品的风险,提供有效地风险最小措施,确保上市后安全性风险可控,有必要对申报上
CDE - 2021-09-19
CDE新增14条常见一般性技术问题解答:化学药品仿制药能否直接申报上市许可申请?
CDE官网更新了“常见一般性技术问题解答”,新增了14条,目前常见一般性技术问题解答共计114条,以下为此次新增的解答。
医谷网 - 化学药品,上市许可,问题解答 - 2020-12-05
新增15个品种拟被CDE纳入优先审评程序
8月19日至22日,CDE网站拟优先审评公示栏新增15个品种。注射用复方维生素(13)为仿制药上市;小儿钠钾镁钙葡萄糖注射液、小儿等渗电解质注射液为儿童药;曲美替尼片、达拉非尼胶囊、HSK3486乳状注射液、西妥昔单抗注射液、帕博利珠单抗注射液为具有明显治疗优势药品
新浪医药新闻 - 优先审评,治疗优势 - 2019-08-25
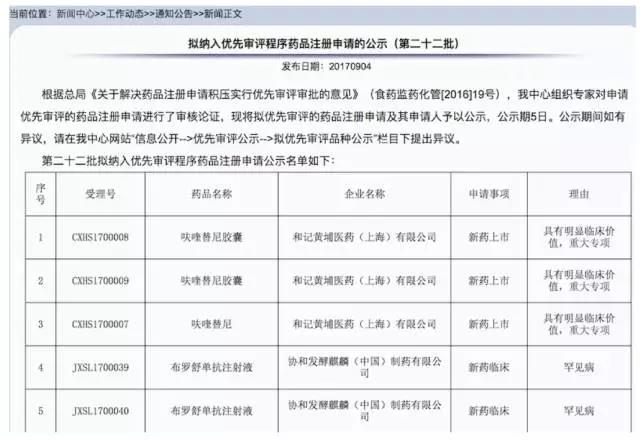
【喜讯】肠癌新药呋喹替尼进入CDE优先审评程序
9月4日,国家食品药品监督管理局药品评审中心(CDE)在官网上发布公告,包括我国原创小分子靶向药物呋喹替尼在内的多个药品进入优先审批程序。
肿瘤资讯 - 呋喹替尼,靶向药物,药品注册 - 2017-09-07
2014年3月CDE受理药品简介
2014年3月,CDE共受理药品申请745件,较2月份增长近40%。其中,新药申请212件,仿制申请193件,进口申请68件,均较2月份有不同程度的增加。图2014年3月CDE受理药品申请类型分布 注册分类为1类的新药申报均为新药临床申请,共有16件,涉及7个品种,均为化学药品,其中有6个品种为1.1类,1个品种为1.6类。
中国医药工业信息中心 - CDE,药品 - 2014-05-13
中国CDE不良反应(ADR)因果关系判断法
不良反应 - 2024-02-04
为您找到相关结果约500个