生物类似药领域的里程碑:罗氏赫赛汀安维汀生物类似药获批
肿瘤药咨询委员会一致赞成,批准贝伐单抗和曲妥单抗的生物类似药。 这个专家评审结果,将是生物类似药领域的里程碑。
健点子ihealth - 罗氏,生物类似药,FDA - 2017-07-14
Enbrel生物类似药Erelzi获FDA批准上市
8月30日,FDA宣布批准诺华旗下Sandoz开发的Enbrel(etanercept)生物类似药上市,商品名Erelzi(etanercept-szzs),用于治疗多种炎症疾病,成为FDA批准的第三个生物类似药Enbrel(恩利,通用名:Etanercept,依那西普)是Amgen的一款超级重磅产品,该药是全球最畅销的抗炎药,2014年全球销售额高达90亿美元。 目前,Enbrel在美国已
生物药之家 - Enbrel,生物类似药,FDA - 2016-08-31
中欧美生物类似药可及性对比
中欧美等国家地区看,欧盟是生物类似药时代的先行者!2006年04月11日,EMA便批准首款生物类似药,即生长激素Omnitrope (somatropin),截止目前,EMA已批准53款生物类似药获批,2款生物类似药上市申请被驳回,其中包括19款单抗,
CPhI制药在线 - 生物类似药 - 2020-01-10
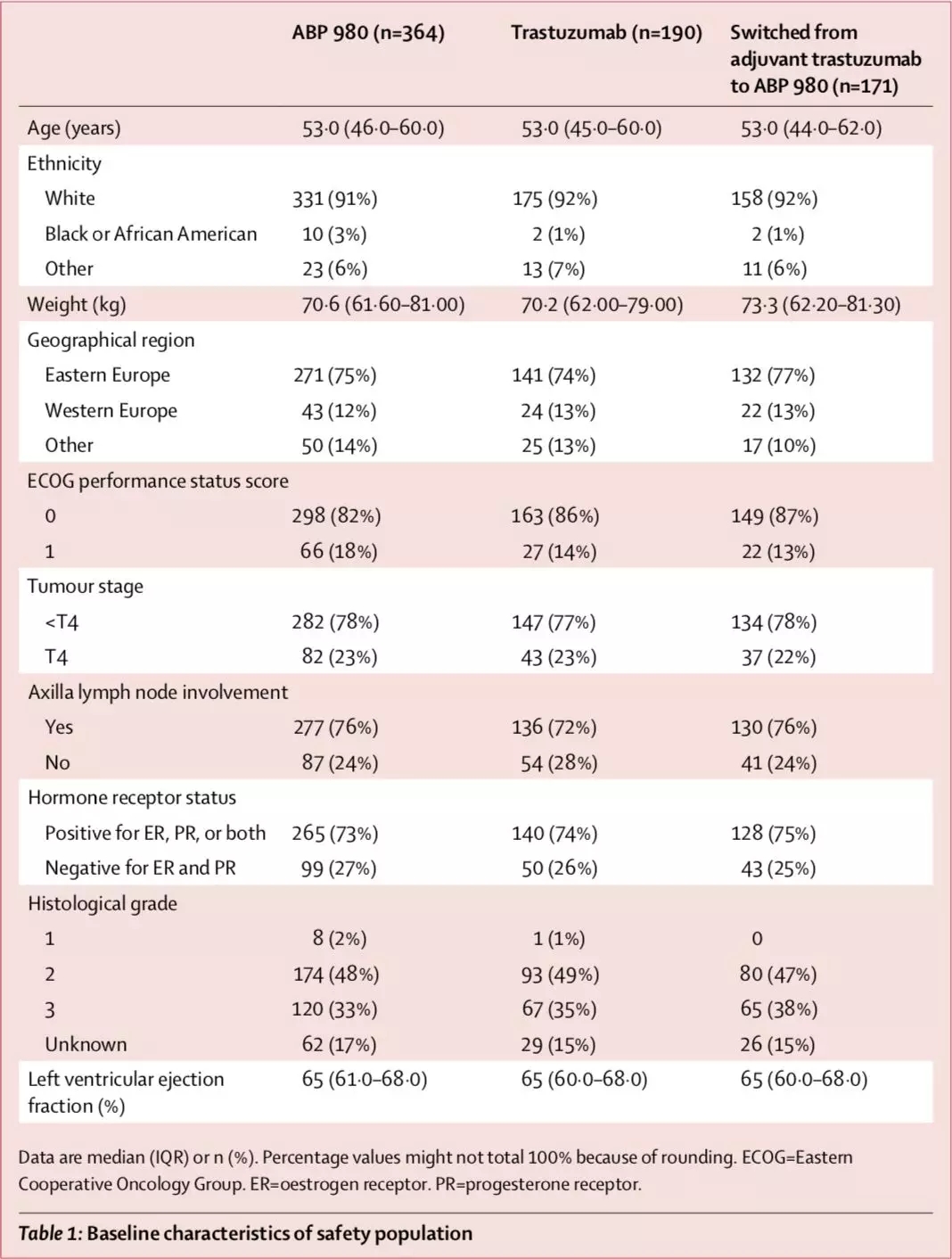
Lancet Oncol:生物类似药的曲折前行—LILAC研究
生物类似药的研发和上市也存在严格的标准,需要证明类似药与参照药的疗效是等效的。在乳腺癌的治疗中,已有多项3期研究证实了几种生物类似药与曲妥珠单抗参照药的临床相似性,但尚未有研究评估从曲妥珠单抗转换到生物类似药后的疗效如何。
肿瘤资讯 - 生物类似药,LILAC,乳腺癌,曲妥珠单抗 - 2018-06-15
共话生物类似药的复杂性及监管策略
近年来,生物药快速发展并在治疗肿瘤等疾病方面显示出明显的临床优势。随着原研生物药专利到期、生物药需求增加及生物技术的不断发展,以原研生物药质量、安全性和有效性为基础的生物类似药的研发,有助于提高生物药的可及性和降低价格,满足患者用药需求。为了确保向患者处方最安全、最有效的治疗药物,包括医生和患者在内的所有主要参与者均需了解生物类似药的复杂性,并做出符合患者最大利益的决策。就生物类似药的复杂性及监管
肿瘤资讯 - 生物类似药,监管策略,治疗 - 2019-11-05
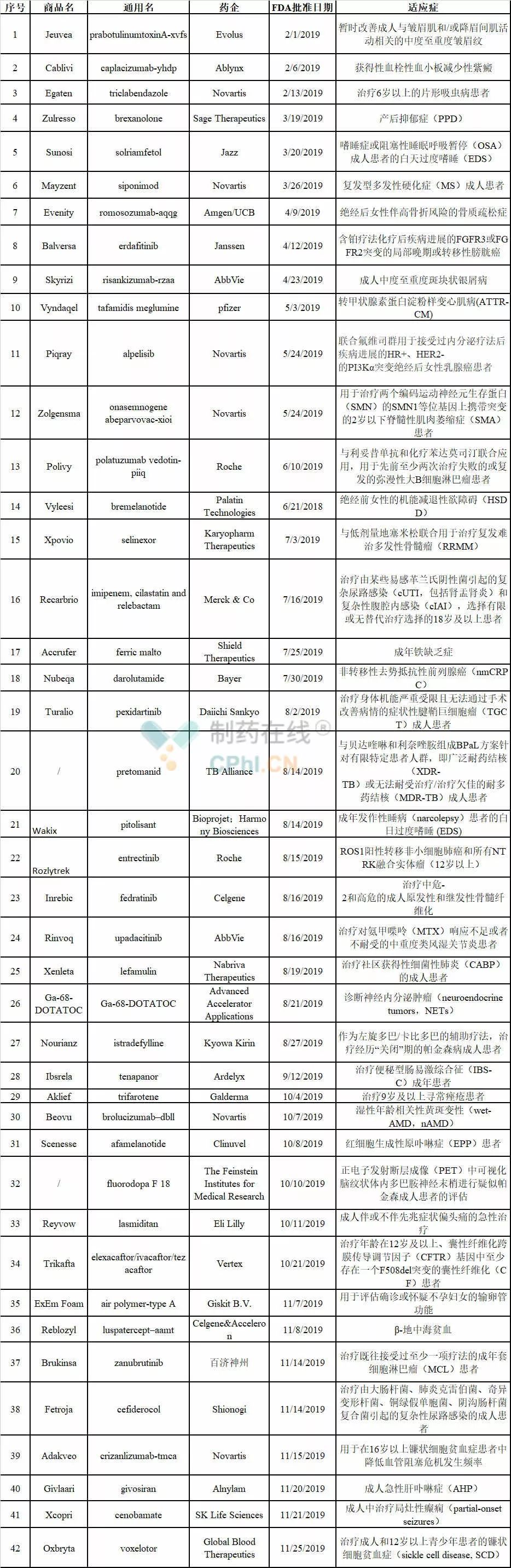
FDA 2019:批准45款新药,9款生物类似药
美国FDA的药物评估与研究中心(CDER)已经批准42款新药,9款生物类似药,3款在路上,而生物制品评估与研究中心(CBER)也批准了诺华公司的基因疗法Zolgensma和首款登革热疫苗。
MedSci - FDA,新药 - 2019-12-24
野百合也有春 56个生物类似药绽放
随着美国FDA在生物类似药方面的一系列法规出台,美国乃至全球的生物仿制药市场进入了迅速发展的时期。在3月伦敦举行的欧洲生物类似药物会议上,昆泰艾美仕战略伙伴部门副总裁Per Troein博士展示了研发和市场的最新数据。
健点子ihealth - 生物类似药,FDA,EMA,研发管线 - 2017-04-19
首个国产生物类似药利妥昔单抗获批上市
2月22日,国家药品监督管理局批准上海复宏汉霖生物制药有限公司研制的利妥昔单抗注射液(商品名:汉利康)上市注册申请。该药是国内获批的首个生物类似药,主要用于非霍奇金淋巴瘤的治疗。生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。生物类似药上市有助于提高生物药的可及性和降低价格,可以更好地满足公众对生物治疗产品的需求。为促进我国生物制药产业的健康、有序发展,国家
国家药品监督管理局 - 利妥昔,单抗,肿瘤药物 - 2019-02-25
信达生物贝伐珠单抗生物类似药——达攸同上市
抗肿瘤药物达攸同®获得中国国家药品监督管理局(NMPA)的批准,适应症为晚期非鳞非小细胞肺癌和转移性结直肠癌。
MedSci原创 - 达攸同 - 2020-06-20
国内首个贝伐珠单抗生物类似药获批上市
该药是国内获批的首个贝伐珠单抗生物类似药,主要用于晚期、转移性或复发性非小细胞肺癌、转移性结直肠癌患者的治疗。
国家药监局网站 - 贝伐珠单,生物类似药,上市 - 2019-12-09
首个国产生物类似药利妥昔单抗获批上市!
2月22日,上海复宏汉霖生物制药有限公司研制的利妥昔单抗注射液(商品名:汉利康;产品代号:HLX01)获得国家药品监督管理局批准,成为了国内获批的首个生物类似药。该药获批了原研利妥昔单抗在中国的所有适应证[1],包括:1)复发或耐药的滤泡性中央型淋巴瘤;2)先前未经治疗的CD20阳性III-IV期滤泡性非霍奇金淋巴瘤;3)CD20阳性弥漫大B细胞淋巴瘤(DLBCL
医学界肿瘤频道 - 利妥昔单抗 - 2019-02-26
未来10年 生物类似药将为美国医疗节省1500亿美元
近日,美国非盈利性的研究和咨询服务机构Rand Corporation发布了一项研究报告,指出美国生物类似药物的应用在未来10年可以为美国生物药支出减少240-1500亿美元,大约可以削减生物药支出的3%
新浪医药新闻 - 生物类似药,美国医疗,阿达木单抗,仿制药 - 2017-10-26
首个在欧盟报产的国产单抗生物类似药获得受理
近日,复宏汉霖宣布,公司联合Accord共同推动其自主开发的单抗生物类似药注射用曲妥珠单抗HLX02,向欧洲药品管理局(EMA)递交上市申请于近日正式获得受理,用于三个癌症适应症的治疗,包括HER2阳性的早期乳腺癌
医谷综合报道 - 复宏汉霖,生物类似药,曲妥珠单抗 - 2019-06-24
全球生物制剂拐点:重磅生物药如何应对生物类似药的竞争
摘要:面对生物类似药的激烈竞争,如何成为生物制剂市场的胜者?本文中探讨了欧美成熟市场的原研生物制药企业是如何备战的,以确保在这一关键市场上取得成功,对于中国正快速崛起的生物制剂市场具有相当的借鉴意义。这两款药皆为强生的重磅炸弹药Remica
生物谷 - 生物药 - 2014-10-08
为您找到相关结果约500个