单组目标值(OPC)临床试验的统计学考虑
作者:中国临床试验生物统计学组(CCTS) 李卫,赵耐青(执笔) 来源:中国卫生统计 2017年6月 第34卷第3期 随机对照临床试验(randomized controlled trial,RCT)是临床研究的金标准,药物/医疗器械临床研究中,尤其是提供关键证据的临床研究中一般均采用RCT。在极少数的医疗器械临床试验中,如采用随机对照试验,会存在伦理学风险,致使临
中国卫生统计 - 单组目标值 - 2019-01-29
药审中心:临床试验缺失数据的统计学考量
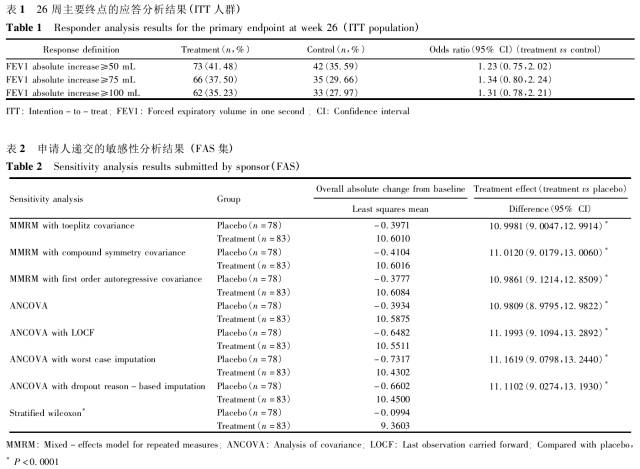
缺失数据是临床试验中常见的重要问题,可能引起试验结果难于解释,甚至影响整个试验的推断和结论,但目前在国内临床研究中尚未引起足够的重视。实际应用中,申请人对待缺失数据的处理存在盲口应用统计学方法的现象,给新药安全有效性的评价和确证带来诸多困难。本文针对三个实际案例进行深入地阐述和分析,探讨对缺失数据的预防、估训一量的选择、缺失数据的统训一分析方法以及敏感性分析等,以期有助于申请人在临床试验中加强
中国临床药理学杂志 - 临床试验,缺失数据 - 2016-06-18
免于进行临床试验的体外诊断试剂临床评价资料基本要求发布
为进一步做好体外诊断试剂注册管理,规范免于进行临床试验的体外诊断试剂临床评价工作,根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号),8日国家食品药品监督管理总局发布了《免于进行临床试验的体外诊断试剂临床评价资料基本要求
新浪医药新闻 - 体外诊断试剂,免于进行临床试验 - 2017-11-09
总局明确豁免临床试验IVD试剂临床评价资料要求
继10月30日,国家食品药品监管总局发布第三批免于进行临床试验的医疗器械目录(以下简称“目录”),对37种第二类医疗器械、11种第三类医疗器械和116种体外诊断(IVD)试剂豁免进行临床试验后,日前,总局又发布《免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)》(以下简称《基本要求》),并于发布之日起施行。《基本要求》配合目录使用,用于指导注册申请人进行体外诊断试剂临床评价工作。这是总局
中国医药报 - 临床试验,IVD试剂 - 2017-11-10
CDME:《2019新型冠状病毒核酸检测试剂注册技术审评要点》发布
为应对新型冠状病毒感染的肺炎疫情,按照“统一指挥、早期介入、随到随审、科学审批”的原则和确保产品安全、有效、质量可控的要求,我中心制定了《2019新型冠状病毒核酸检测试剂注册技术审评要点》,现予以发布。
CDME - 新型冠状病毒,核酸检测试剂,注册 - 2020-02-12
CFDA 发布胎儿染色体非整倍体检测试剂盒注册技术审查指导原则
本指导原则旨在指导注册申请人对胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(高通量测序法)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。本指导原则是针对该类试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。本指导原则是对申请人和审查人员的指
CFDA - CFDA,胎儿染色体,试剂盒 - 2017-04-07
重磅!疫苗“一致性评价”来了
今日(12月24日),为进一步规范和提高疫苗临床研发水平,加强疫苗质量安全监管,国家药监局印发《预防用疫苗临床可比性研究技术指导原则》(以下简称指导原则)。
医谷 - 疫苗,一致性评价 - 2019-12-24
总局发布医疗器械临床试验设计指导原则
1月8日,食品药品监管总局发布通告称,为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强医疗器械产品注册工作的管理,进一步提高注册审查质量,鼓励医疗器械研发创新,国家食品药品监督管理总局组织制定了医疗器械临床试验设计指导原则(见附件),现予发布。
新浪医药新闻 - 医疗器械,CFDA,指导原则 - 2018-01-09
ICH E9临床试验的统计学指导原则解析
ICH E9 Statistical principles for clinical trials (临床试验的统计学指导原则)可谓生物统计师的bible,目的在于协调欧洲、日本和美国在进行药品上市申请的临床试验时所应用的统计学方法的指导原则虽说中国是协调三方之外的国家,SFDA还为此另外制定了自己的《化学药物和生物制品临床试验的生物统计学技术指导原则》,但其内容基本还是照抄翻译了ICH E9的
MedSci原创 - ICH,E9,临床试验,统计 - 2012-05-28
多中心临床试验中中心校正的统计学实现(SPSS)
多中心临床试验可以在较短的时间内招募到足够多的病例数,同时,来自多中心的病例比来自单中心的病例更具有代表性,可以使所得结论的应用面更广泛。但由于各中心的试验条件不完全相同,所得结论也不尽相同。因此, 在评价疗效时, 必须考虑中心间效应的差别。当中心间差距较大时,如果直接合并各中心资料,可能会对总的结论有一定影响。这里涉及到两个问题,其一是评价中心效应是否存在,其二是如何扣除中心效应的影响对疗效进行
MedSci原创 - 中心校正,SPSS - 2013-11-19
医疗器械临床试验85个常见问题解答
01、关于临床试验用医疗器械注册检验报告一年有效期问题答:《医疗器械临床试验质量管理规范》第七条规定:“质量检验结果包括自检报告和具有资质的检验机构出具的一年内的产品注册检验合格报告”。对于其中检验机构的一年内的产品注册检验合格报告,在多中心开展临床试验的情形,是以检验报告出具时间至临床试验牵头单位伦理审查通过时间计算一年有效期;在非多中心开展临床试验的情形,是以检验报告出具时间至每家临床试验
MedSci原创 - 医疗器械,问题 - 2019-01-29
我国临床试验生物统计学指导原则与国际ICH E9比较研究
Harmonised Tripartite Guideline Statistical Principles ClinicalTrails E9》(以下简称“ICH E9”)是在人用药品注册技术要求国际协调会议的赞助下制定,目的从统计学原理和方法出发,向申办者和专家提供建议,以便有助于为申请新药入市而作的临床 试验的分析和结论得到公认。现主要用于欧盟日本及美国管理当局的
中国卫生统计 - 生物统计,ICH,E9 - 2014-08-09
生物统计学家:临床研究的幕后高手
【编者按】临床研究往往少不了统计学,其在肿瘤临床研究中的地位更是举足轻重。而在现实中,生物统计学家却是一个熟悉而又陌生的名字。熟悉是因为统计的“必要性”,陌生往往是因为统计的“高深莫测”。本文作者Daniel Sargent教授和Qian Shi教授作为梅奥肿瘤研究中心的“掌门人”,将跟大家“揭露”生物统计学家在肿瘤临床试验中所扮演的角色。 日前,Chinese Clinical O
CJCR - 临床研究,统计 - 2014-06-08
证实原理试验(PPTs)和验证有效性试验(ETs)的临床试验
证实原理试验(PPTs)和验证有效性试验(ETs) 本次介绍PPTs试验和ETS试验详细内容。PPTs和ETs两大临床研究 类型相对应的两个阶段的临床试验,以支持开展更加灵活、快速和集中的临床研究。采用生物终点、调整后的临床终点、早期使用随机试验、引进适时递进性研究设 计(适用的情况下)等更加符合免疫治疗特点的设计和评价指标,在预
MedSci原创 - 临床研究,设计 - 2013-05-30
为您找到相关结果约500个