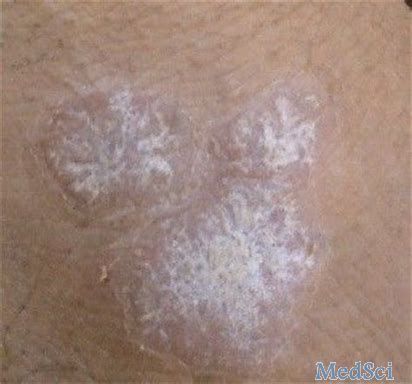
澳大利亚TGA批准ILUMYA(tildrakizumab)用于治疗中重度斑块状银屑病
Sun制药公司22日宣布,澳大利亚治疗用品管理局(TGA)已经批准其ILUMYATM(tildrakizumab)用于治疗患有中度至重度斑块状银屑病的成人。
MedSci原创 - tildrakizumab,澳大利亚,银屑病 - 2018-09-23
FDA重新审查可待因治疗18岁以下儿童咳嗽的安全性
由于可待因可能会引发呼吸减缓和呼吸困难等严重不良事件,美国食品和药物管理局(FDA)正在调查使用含可待因药物治疗18岁以下儿童咳嗽和感冒的安全性。FDA在7月1日的安全通讯上表示,儿童,尤其是存在呼吸问题的,可能更容易出现这些严重的不良事件。FDA曾对2岁以下儿童非处方咳嗽和感冒用药的使用发出过警告。“我们正在评估所有可用的信息,并将召开咨询委员会与外部专家讨论这些安全问题。当我们的审查完成时,我
MedSci原创 - 儿童,可待因,安全性 - 2015-07-03
欧盟受理辉瑞口服JAK抑制剂Xeljanz治疗类风湿性关节炎的上市申请
美国制药巨头辉瑞(Pfizer)近日宣布,欧洲药品管理局(EMA)已受理口服JAK抑制剂Xeljanz(tofacitinib,5mg片剂,每日2次)的上市申请(MAA),此次申请寻求批准Xeljanz
生物谷 - 辉瑞,口服JAK抑制剂,Xeljanz,Tofacitinib,类风湿性关节炎 - 2016-03-26
欧洲CHMP对SYMKEVI(tezacaftor / ivacaftor)持积极态度
Vertex制药公司近日宣布,欧洲药品管理局(EMA)人用医疗产品(CHMP)委员会对SYMKEVI®(tezacaftor / ivacaftor)采取积极意见
MedSci原创 - tezacaftor,ivacaftor,CHMP - 2018-07-28
欧洲CHMP持正面意见:KALYDECO(ivacaftor)治疗囊性纤维化婴儿
Vertex制药公司近日宣布,欧洲药品管理局(EMA)的人用药品委员会(CHMP)对KALYDECO®(ivacaftor)持肯定态度。
MedSci原创 - Kalydeco,ivacaftor,CHMP - 2019-10-20
CHMP建议批准Actelion肺动脉高压药物Opsumit
Actelion公司10月25日宣布,实验性药物Opsumit(macitentan,10mg)获得了欧洲药品管理局(EMA)人用医药产品委员会(CHMP)的积极意见。
生物谷 - 新药,FDA - 2013-10-28
盘点 | 2019年3月全球获批新药情况
一、FDA获批上市药品动态监测 根据火石创造数据库数据显示,截至2019 年 3月FDA共批准94个药品上市,其中NDA药品为10个,BLA药品为1个,ANDA药品为83个。NDA和BLA药品在FDA获批情况见表1。 1.jpg 表1 FDA批准的NDA和BLA药品 在上述批准的10种NDA品种中,西尼莫德、BREXANOLONE和SOLRIAMFETOL为新分子实体(N
火石创造 - 新药 - 2019-04-10
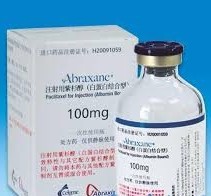
CHMP建议批准Celgene抗癌药Abraxane用于胰腺癌治疗
美国生物制药公司新基(Celgene)11月22日宣布,抗癌药物Abraxane(紫杉醇[paclitaxel]蛋白质结合颗粒注射悬液,白蛋白结合)获得了欧洲药品管理局(EMA)人用医药产品委员会
生物谷 - 新药,FDA - 2013-11-26
金斯瑞子公司传奇再次公布CAR-T临床数据,总缓解率达97%,研究者期待用于更前线治疗
香港上市公司金斯瑞生物旗下子公司传奇生物(纳斯达克:LEGN)公布了西达基奥仑赛(cilta-cel)的CARTITUDE-1研究(NCT03548207)的最新数据。CARTITUDE-1是一项关于
医谷网 - 复发,CAR-T临床数据,前线治疗 - 2020-12-06
基石药业将艾伏尼布片在大中华地区和新加坡的独家权益出售给施维雅
择捷美®联合氟尿嘧啶类和铂类化疗药物用于一线治疗不可切除的局部晚期、复发或转移性ESCC的新适应症上市申请已获NMPA批准
网络 - 2023-12-21
2021年3月19日全球新冠肺炎(COVID-19)疫情简报,确诊超1亿2232万,全球疫苗接种超4亿剂
Worldometers世界实时统计数据显示,截至北京时间2021年3月19日7时01分,全球累计确诊新冠肺炎(COVID-19)病例超过12232万例,新增517,203例,达到122,329,17
MedSci整理 - 新冠肺炎 - 2021-03-19
FDA暂停阿瑞雅德旗下白血病药物Iclusig的销售
美国食品药品管理局(FDA)要求阿瑞雅德(Ariad) 公司暂停其白血病药物Iclusig的销售,因为FDA继续调查这款药物危及生命的副作用报告。这次暂停销售之前,FDA于10月11日已针对这款药物的血栓及血管严重变窄风险发布了一项警告。阿瑞雅德也被迫于上周停止了这款药物在新确诊的慢性粒细胞白血病(CML)患者身上进行的EPIC临床试验,并在一份声明中表示正在停止药物的配送,同时该公司继续协商更新
丁香园 - 阿瑞雅德,白血病药物Iclusig - 2013-11-04
FDA授予礼来单抗药物olaratumab治疗晚期软组织肉瘤的优先审查资格
美国医药巨头礼来(Eli Lilly)抗癌管线近日在美国监管方面传来喜讯,FDA已授予单抗药物olaratumab治疗晚期软组织肉瘤(STS)的生物制品许可申请(BLA)优先审查资格。olaratumab是一种人血小板衍生生长因子受体α(platelet-derived growth factor recepter α,PDGFRα)拮抗剂,联合阿霉素(doxorubicin)用于不适合放疗或
生物谷 - 礼来,olaratumab,软组织肉瘤,PDGFRα拮抗剂,单抗 - 2016-05-07
癌症疫苗研发:成功率居倒数 谁碰谁死
最近,各大医药网报道在所有的疫苗研究中,癌症疫苗的研发成功率仅1.6%,居所有疫苗的倒数第一。 FDA目前批准了3个针对癌症的疫苗,分别是Cervarix、Gardasil、Sipuleucel-T,前两个都是人乳头瘤病毒(HPV)疫苗,不能说是真正的癌症疫苗。Sipuleucel-T确实是按疫苗原理来设计的,但由于临床试验方案的缺陷,无法判断该药是否真的按疫苗机制来抗癌的。以下是几个代表性癌
生物谷 - 癌症疫苗 - 2014-04-22
为您找到相关结果约500个