8款药品注册申请拟纳入优先审评
2019年3月29日,药审中心公示的拟优先审评的药品品种新增“盐酸安非他酮缓释片”等,公示期间如有异议,可在药审中心网站“信息公开-->优先审评公示-->拟优先审评品种公示”栏目下提出异议。
中国药审 - 药品,优先审评 - 2019-04-01
CSCO2022 CDE专场|2022年中国抗肿瘤新药审评情况报告
在2022年11月6日上午开启的CDE专场中,国家药品监督管理局药品审评中心副主任杨志敏针对2022年中国抗肿瘤新药审评情况展开精彩报告。
网络 - CDE,2022年中国抗肿瘤新药审评情况报告 - 2022-11-08
CSCO2022 CDE专场|抗肿瘤药物临床研发中最佳给药策略审评考量
CDE仝昕审评员发表了题为“抗肿瘤药物临床研发中最佳给药策略审评考量”的报告,她表示新药上市前应个性化、多维度、综合各种数据制定最佳给药策略。
网络 - CSCO,抗肿瘤药物,CDE - 2022-11-08
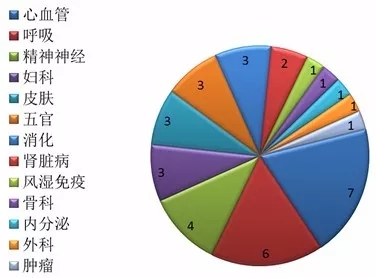
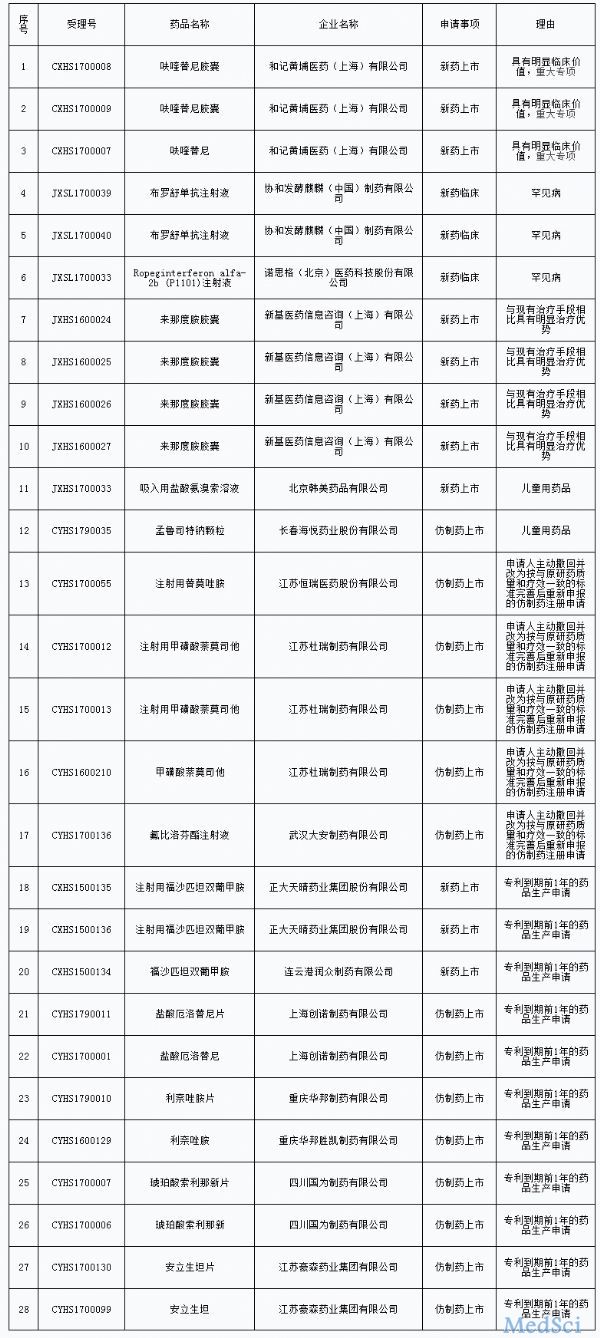
最新优先审评名单出炉,再添28个药品
今日(9月4日),国家食品药品监督管理总局药品审评中心(简称“CDE”)发布《拟纳入优先审评程序药品注册申请的公示(第二十二批)》,将拟优先审评的药品注册申请及其申请人予以公示,根据公示名单,此次入选的28个药品,13个药品为仿制药上市,3个药品为新药临床,其余12个为新药上市,具体名单如下:
医谷 - 药品,评审,药品注册申请 - 2017-09-04
百时美施贵宝血液病创新药Luspatercept上市申请获CDE优先审评
2021年2月4日,百时美施贵宝中国宣布,其红细胞成熟剂Luspatercept(英文商品名Reblozyl;自拟中文通用名:注射用罗特西普;自拟中文商品名:利布洛泽)的上市申请已获CDE正式受理。
MedSci - 血液病,luspatercept - 2021-02-04
第27批拟被纳入优先审评药品名单出炉 26药品入选
CDE官网公示了第二十七批拟纳入优先审评程序药品注册申请名单,其中,12药品为新药上市,9药品为新药临床,其余5药品为仿制药上市申请。
CDE官网 - 优先审评,CDE,药品注册 - 2018-03-29
FDA“创新行动计划”促进药品研发与审评
FDA新任局长Scott Gottlieb 博士于2017年7月7日在FDA的官方博客-FDA Voice上发表了题为“ How FDA Plans to Help Consumers Capitalize on Advances in Science”的文章,旨在推行“创新行动计划”,使公众尽快获益于安全有效的新药和新的医疗技术。
CDE网站;凡默谷 - FDA,药品研发,药品评审 - 2017-09-08
中国药品审评审批制度改革提速,药品申请积压现象缓解
日前,原国家食品药品监管总局(现国家市场监管总局)发布了《2017年度药品审评报告》(以下简称《报告》)。报告显示,在鼓励药物创新、提高药品质量方面,我国药品审评审批制度改革发挥了重要作用。2015年,国务院发布《关于改革药品医疗器械审评审批制度的意见》,提出了12项改革任务;2017年,中办、国办发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出鼓励药品创新36条意见。
东方网 - 中国药品,审批,药品 - 2018-04-08
药监局重磅发布:2018年度药品审评报告
7月1日,国家药品监督管理局药品审评中心官网发布了2018年度药品审评报告。2018年,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家局)坚强领导下,继续贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44
药监局 - 药监局 - 2019-07-03
我国药品审评审批制度改革再提速
日前,原国家食品药品监管总局(现国家市场监管总局)发布了《2017年度药品审评报告》(以下简称《报告》)。报告显示,在鼓励药物创新、提高药品质量方面,我国药品审评审批制度改革发挥了重要作用。
光明日报 - 药品审评审批,制度改革,中国 - 2018-04-08
关于药品注册审评若干问题的讨论
作者:杏林中人 本文来自蒲公英 一、效率低下原因探析 目前国内药品审批现状受到社会各界的广泛诟病,各个层面都不满意。主要问题是审评效率太低,不少企业资料报上去以后,在漫长的排队等待过程中,从充满期望,到失望,到绝望。我们经常批评国内企业不注重研发投入,实际上药品审批的低效率,在很大程度上遏制了企业投入研发的热情。
蒲公英微信 - 药品,注册 - 2014-11-30
国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)(征求意见稿)
为落实《药品注册管理办法》(国家市场监督管理总局令第27号)相关要求,我中心组织起草了《国家药品监督管理局药品审评过程中审评计时中止与恢复管理规范(试行)》,现在中心网站予以公示,以广泛听
CDE - 药品审评 - 2021-11-19
为您找到相关结果约500个