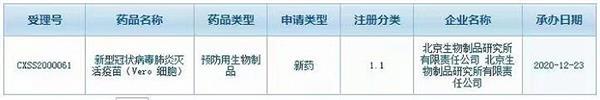
国药集团新冠疫苗国内上市申请获受理,有望在元旦前后上市
昨天,国家药监局药审中心( CDE )显示,国药集团北京生物制品研究所的新型冠状病毒肺炎灭活疫苗(Vero 细胞)上市申请已获CDE受理。据估计在元旦前后,CDE将会批准疫苗有条件上市。大家在元旦以后
网络 - 新冠疫苗 - 2020-12-24
患者钢板断裂告医院,医院却因“最佳手术方案”被判担责
案情简介原告1天前发生车祸受伤,因左下肢疼痛到当地医院就诊,行“骨骼牵引术” ,为求进一步诊疗到甲医院就诊,以“股骨中段粉碎性骨折”收入院。初步诊断为左股骨中段开放性粉碎性骨折,行切开复位固定术+取髂骨及人工骨混合植骨融合术。术后诊断为左股骨中段开放性粉碎性骨折并骨缺损。次年1月12日,原告以左股骨骨折术后5月,左下肢摔伤3天入住乙医院,行“左股骨内固定装置取出术、左股骨再次骨折内固定术、植骨
医法汇 - 医学人文 - 2019-10-10
药物临床试验适应性设计指导原则(试行)
为规范和统一国内对适应性设计的认识,促进适应性设计的应用和理解以提高研发效率,药审中心组织制定了《药物临床试验适应性设计指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术
NMPA - 临床试验 - 2021-02-09
药物临床试验富集策略与设计指导原则(试行)
为了促进临床试验各相关方正确地认识富集策略与设计的原理与方法,并指导其规范应用以达到提高临床试验效率的目的,药审中心组织制定了《药物临床试验富集策略与设计指导原则(试行)》(见附件)。根据《国家药监局
NMPA - 临床试验 - 2021-02-09
群体药代动力学研究技术指导原则
为鼓励和引导群体药代动力学相关研究的规范开展,提供可参考的技术标准,药审中心组织制定了《群体药代动力学研究技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的
NMPA - 药代动力学 - 2021-02-09
中药新药用于糖尿病肾脏疾病临床研究技术指导原则(2020年)
在国家药品监督管理局的部署下,药审中心组织制定了《中药新药用于糖尿病肾脏疾病临床研究技术指导原则》。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9
NMPA - 糖尿病肾病 - 2021-02-09
药物相互作用研究技术指导原则(试行)
为进一步鼓励和引导申请人高效规范地开展药物相互作用研究工作,药审中心组织制定了《药物相互作用研究技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综
NMPA - 药物相互作用 - 2021-02-09
化学药物中亚硝胺类杂质研究技术指导原则(试行)
为了保证药品的安全和质量可控,实现有效的风险控制,在国家药品监督管理局的部署下,药审中心组织制定了《化学药物中亚硝胺类杂质研究技术指导原则(试行)》(见附件),根据《国家药监局综合司关于印发药品技术指
CDE - 化学药物 - 2021-06-27
托珠单抗注射液生物类似药临床试验指导原则
为鼓励生物类似药研发,进一步规范和指导托珠单抗生物类似药的临床试验设计和终点选择,提供可参考的技术规范,在国家药品监督管理局的部署下,药审中心组织制定了《托珠单抗注射液生物类似药临床试验指导原则》(见
国家药品监督管理局药品审评中心 - 托珠单抗,指导原则 - 2021-05-13
新型冠状病毒中和抗体类药物申报临床药学研究与技术资料要求指导原则(试行)
为积极应对新冠肺炎疫情,加快新型冠状病毒中和抗体类药物的研发,在国家药品监督管理局的部署下,药审中心组织制定了《新型冠状病毒中和抗体类药物申报临床药学研究与技术资料要求指导原则(试行)》(见附件)。根
CDE - 指导原则 - 2020-10-03
新型冠状病毒预防用疫苗临床研究技术指导原则(试行)
为指导我国新冠疫苗的临床研发,提供可参考的技术标准,在国家药品监督管理局的部署下,药审中心组织制定了《新型冠状病毒预防用疫苗研发技术指导原则(试行)》(附件1)《新型冠状病毒预防用mRNA疫苗药学研究
CDE - 新冠疫苗 - 2020-10-02
生物制品变更受理审查指南(试行)
根据《国家药监局关于实施〈药品注册管理办法〉有关事宜的公告》(2020年第46号),为推进相关配套规范性文件、技术指导原则起草制定工作,在国家药品监督管理局的部署下,药审中心组织制定了《生物制品变更受
CDE - 生物制品 - 2021-06-27
药物临床试验亚组分析指导原则(试行)
为进一步探索药物临床试验中不同特征患者的疗效和安全性差异,评估不同亚组可能的获益-风险,为申办方提供药物临床试验中亚组分析的设计、实施和评价的指导性建议,药审中心组织制定了《药物临床试验亚组分析指导原
NMPA - 临床试验 - 2021-02-09
真实世界研究支持儿童药物研发与审评的技术指导原则(试行)
考虑到我国儿童药物研发及药品注册中的实际需要,帮助企业更好地理解《真实世界证据支持药物研发与审评的指导原则(试行)》在儿童药物研发中的应用,在国家药品监督管理局的部署下,药审中心组织制定了《真实世界研
CDE - 指导原则 - 2020-10-03
为您找到相关结果约500个