新型抗肿瘤药物临床应用指导原则(2019版)
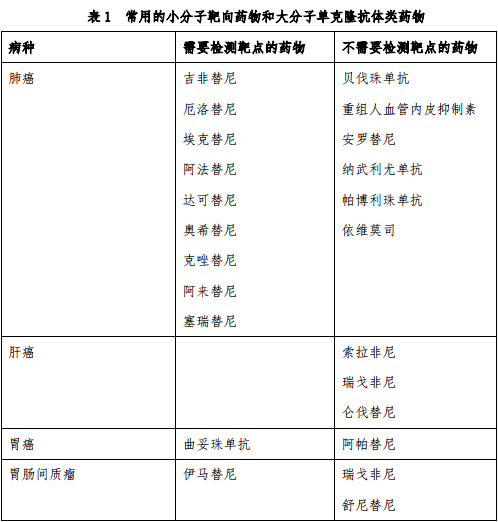
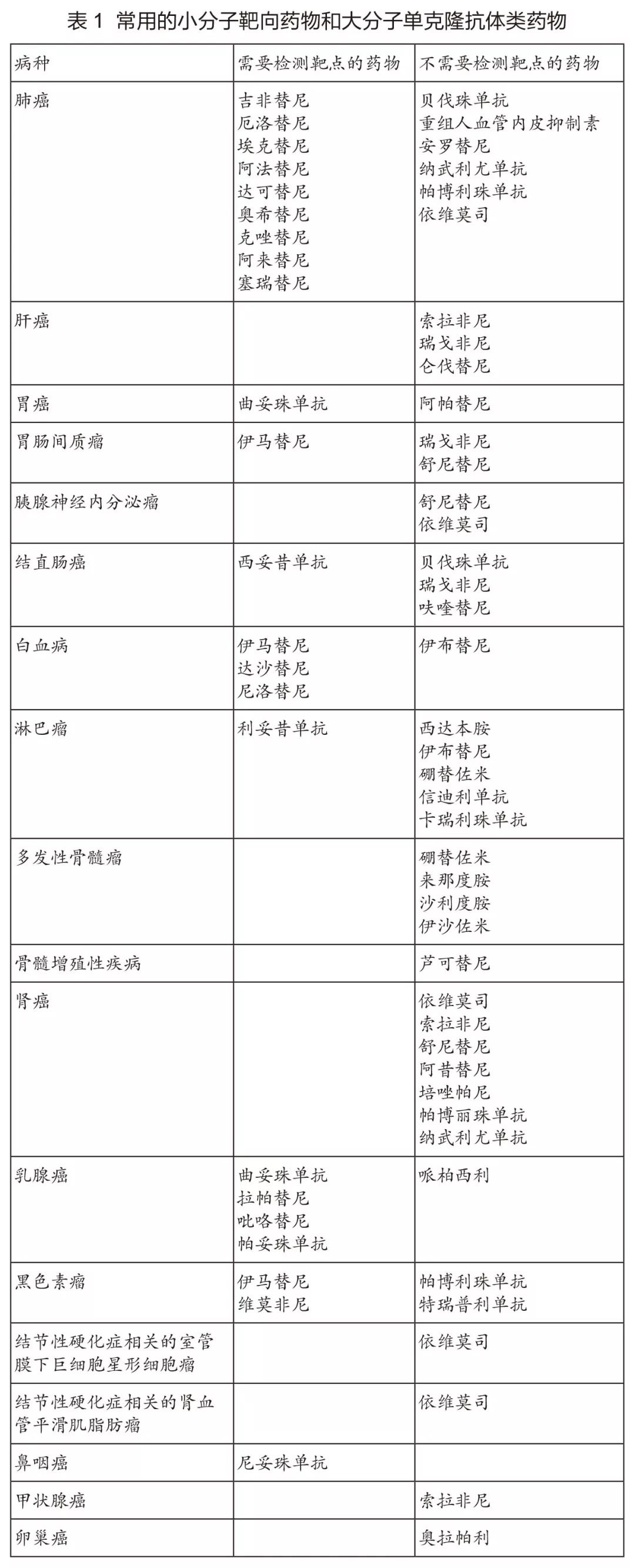
本指导原则涉及的新型抗肿瘤药物是指小分子靶向药物和大分子单克隆抗体类药物。基本原则为:病理组织学确诊后方可使用,靶点检测后方可使用。目前,根据是否需要做靶点检测,可以将常用的小分子靶向药物和大分子单克
MedSci原创 - 抗肿瘤药物 - 2020-03-16
新型抗肿瘤药物临床应用指导原则 (2018年版)
为规范新型抗肿瘤药物临床应用,提高肿瘤合理用药水平,保障医疗质量和医疗安全,维护肿瘤患者健康权益,特制定新型抗肿瘤药物临床应用指导原则。本指导原则涉及的新型抗肿瘤药物是指小分子靶向药物和大分子单克隆抗体类药物。
中华人民共和国国家卫生健康委员会官网 - 新型抗肿瘤药物,临床应用 - 2018-09-28
新型抗肿瘤药物临床应用指导原则(2019年版)
第一部分 新型抗肿瘤药物临床应用指导原则 为规范新型抗肿瘤药物临床应用,提高肿瘤合理用药水平,保障医疗质量和医疗安全,维护肿瘤患者健康权益,特制定新型抗肿瘤药物临床应用指导原则。本指导原则涉及的新型抗肿瘤药物是指小分子靶向药物和大分子单克隆抗体类药物。 抗肿瘤药物临床应用的基本原则 抗肿瘤药物的应用涉及临床多个学科,合理应用抗肿瘤药物是
网络 - 肿瘤 - 2019-12-21
42种新型抗肿瘤药物临床应用指导原则进入“普法期”
近年来,抗癌新药在我国上市的脚步日益加快,且随着17种抗癌药纳入国家医保等惠民新政落地,患者对药物的可及性也越来越高。规范新抗癌药的应用,纳入国家监管部门的视野。
文汇报 - 新型抗肿瘤药物,临床应用 - 2019-04-16
新型抗肿瘤药物临床应用指导原则(2020年版),覆盖9大癌肿、83种药物
为进一步规范新型抗肿瘤药物临床应用,提高肿瘤合理用药水平,保障医疗质量和医疗安全,维护肿瘤患者健康权益,2020年12月29日,国家卫生健康委发布了《新型抗肿瘤药物临床应用指导原则(2020年版)》。
网络 - 肿瘤 - 2021-01-05
《生物标志物在抗肿瘤药物临床研发中应用的技术指导原则》发布
为合理应用生物标志物指导抗肿瘤药物的临床研发提供可参考的技术规范,在国家药品监督管理局的部署下,药审中心组织制定了《生物标志物在抗肿瘤药物临床研发中应用的技术指导原则》(见附件)。根据《国家药监局综合
MedSci原创 - 生物标志物 - 2021-12-08
指南推荐:生物标志物在抗肿瘤药物临床研发中应用的技术指导原则
生物标志物不仅在临床实践中广泛运用,在抗肿瘤药物研发中的价值也日益凸显,已逐步成为抗肿瘤药物研发过程中极为重要的,甚至是必不可少的一种研发工具。目前已有多个基于生物标志物筛选患者人群的抗肿瘤药物获批上
CDE - 肿瘤,生物标志物,肿瘤药物 - 2021-12-09
《以临床价值为导向的抗肿瘤药物临床研发指导原则》正式稿发布
国家药监局药审中心关于发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》的通告(2021年第46号)
MedSci原创 - 指导原则 - 2021-11-19
抗肿瘤药物临床试验技术指导原则(第二稿)
二○○七年三月 一、概述: 肿瘤疾病是严重威胁人类生命的一类疾病,尽管现有治疗手段取得了一定疗效,但多数肿瘤患者生存时间有限,缺乏有效的可以治愈的药物为达到延长生存的目标,患者往往愿意承担比其他药物更大的安全性风险,这使得对肿瘤药物的风险效益权衡不同于其他药物,也使得肿瘤药物的临床研究完全遵循一
MedSci原创 - 肿瘤,试验 - 2013-04-17
关于公开征求《抗肿瘤药联合治疗临床试验技术指导原则》意见的通知
目前抗肿瘤药物联合开发十分活跃。合理的联合治疗可以为肿瘤患者带来更好的治疗选择,但是不恰当的联合开发将增加受试者的风险、降低临床研发效率,浪费时间、财力和医疗资源,反而阻碍了真正有效的联合治疗药物开发
CDE - 临床试验,指导原则 - 2020-07-17
已上市抗肿瘤药物增加新适应症技术指导原则
一、概述本指导原则的目的是指导申请人如何规划已上市抗肿瘤化学药物和生物制品增加新适应症的申请。本指导原则对抗肿瘤药物增加新适应症所需要的临床研究的要求进行讨论和说明。需明确的是,本指导原则中所指的增加的适应症应为肿瘤领域的新适应症,而且该适应症应为国内外均未批准的新适应症。已经上市的抗肿瘤药物增加非肿瘤领域新适应症的申请,不包含在本指导原则范围之内。二、背景对申请人而言,已上市的抗肿瘤药物递交
MedSci原创 - 肿瘤,新适应症,指导原则 - 2018-12-04
为您找到相关结果约500个