远程医疗:值得开发的试验田
想象一下,你可以在任何时间给医生发短信咨询医疗问题,并迅速得到一个详尽的答复,不用在网上胡乱搜索,也不用为了一点头疼脑热就去医院排长队看病。这对病人来说,简直太棒了;但对医生而言,可能是噩梦的开始。
人民文摘 - 远程医疗,Health,Tap - 2015-03-13
医疗器械临床试验设计指导原则发布
近日,国家食品药品监管总局公布《医疗器械临床试验设计指导原则》(以下简称《指导原则》),明确了医疗器械临床试验设计的基本类型和特点、受试对象、评价指标等方面的技术指导原则。
中国医药报 - 医疗器械,临床试验,设计原则 - 2018-01-20
医疗器械临床试验审批项目立卷审查要求
国家药品监督管理局组织对现行的《医疗器械临床试验审批项目立卷审查要求》文件进行了全面修订。
国家药品监督管理局官网 - 临床试验,医疗器械 - 2023-06-22
医疗器械临床试验质量管理规范2022
为深化医疗器械审评审批制度改革,加强医疗器械临床试验管理,根据《医疗器械监督管理条例》(国务院令第739号)及《医疗器械注册与备案管理办法》。
国家药品监督管理局官网 - 医疗器械 - 2023-12-17
总局发布医疗器械临床试验设计指导原则
1月8日,食品药品监管总局发布通告称,为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强医疗器械产品注册工作的管理,进一步提高注册审查质量,鼓励医疗器械研发创新,国家食品药品监督管理总局组织制定了医疗器械临床试验设计指导原则(见附件),现予发布。
新浪医药新闻 - 医疗器械,CFDA,指导原则 - 2018-01-09
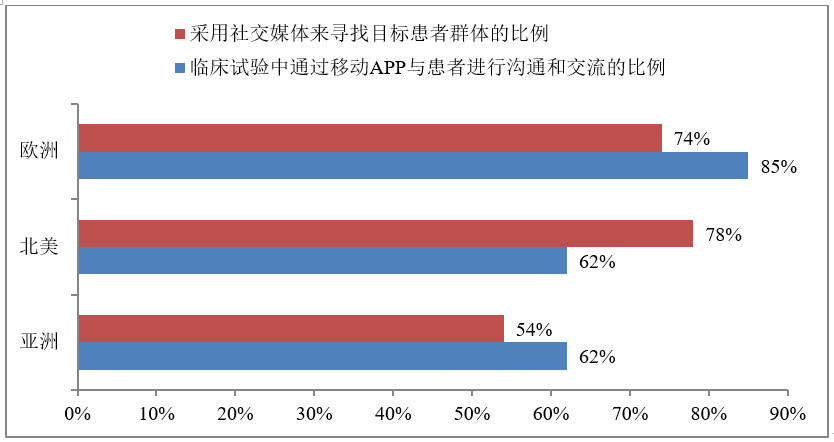
医疗行业的新趋势:人工智能+虚拟医疗+临床试验+消费者体验
随着全球人口平均预期寿命的增加和人口结构老化,预计2035年全球医护人员缺口将达1290万,生命医学与医疗(Healthcare)行业规模也将从2015年的9.7万亿美元增至2040年的18.28万亿
同济校友资本 - 医疗行业,虚拟医疗 - 2020-06-03
《医疗器械临床试验质量管理规范》今日实行
为加强医疗器械临床试验监督管理,维护医疗器械临床试验过程中受试者权益,保证医疗器械临床试验过程规范,国家食品药品监督管理总局、国家卫生计生委联合发布的《医疗器械临床试验质量管理规范》今起施行。规范提出,在受试者参与临床试验前,研究者应当充分向受试者或者无民事行为能力人、限制民事行为能力人的监护人说明临床试验的详细情况,包括已知的、可以预见的风险和可能发生的不良事件等。申办者对发生与试验相关
CFDA - 体外诊断,医疗器械,临床试验 - 2016-06-05
医疗器械临床试验数据递交要求注册审查指导原则
本文为国家药品监督管理局医疗器械技术审评中心发布的《医疗器械临床试验数据递交要求注册审查指导原则》。
国家药品监督管理局医疗器械技术审评中心 - 医疗器械 - 2024-04-19
和美医疗声明未参与“基因编辑婴儿”试验,贺建奎同步做两个基因试验
卷入“基因编辑婴儿”事件的深圳和美妇儿科医院今天下午发表正式声明称,该院从未参与贺建奎及其研究团队在网上所提及的“基因编辑婴儿”事件中的任何实验环节,并称网传的伦理审查申请书上的签名有伪造嫌疑,该医院将申请公安机关介入调查。
健康点healthpoint - 基因编辑,实验 - 2018-11-28
FDA医疗器械临床试验设计指导原则解析
FDA发布了一则关于医疗器械关键性临床试验设计考量的指导原则,该指导原则旨在向参与以支持医疗器械上市前申报为目的的临床试验设计人员和FDA申报审评人员提供指导。可供医疗器械行业、临床试验实施人,机构评审委员会及FDA员工使用。FDA 在支持特定医疗器械类型相关研究方面已有明确的要求,在举证责任如何满足监管要求方面也已有一般要求,但尚未试图阐述适用于医疗器械上市前申报的各种临床 试验设计,或对委
MedSci原创 - 医疗器械,临床试验,FDA - 2013-12-20
Lancet:临床研究试验报告在医疗公关下扭曲
When doctors are deciding which drug to prescribe a patient, the idea behind evidence-based medicine is that they inform their thinking by consulting scientific literature. To a great extent, th
MedSci原创 - 临床研究,试验报告 - 2013-12-21
《医疗器械拓展性临床试验管理规定(试行)》解读
为满足公众临床需要,支持并规范医疗器械拓展性临床试验的开展和安全性数据的收集,国家药品监督管理局会同国家卫生健康委员会发布了《医疗器械拓展性临床试验管理规定(试行)》。现就有关问题解读如下:
动脉新器械 - 医疗器械,拓展性临床试验 - 2020-03-29
为您找到相关结果约500个