Nature Neuroscience:从单细胞基因组学深入理解阿尔兹海默病
2023-03-02 brainnew神内神外 brainnew神内神外 发表于安徽省
单细胞分析有助于对 AD 大脑中受到扰动的各种细胞过程进行细致入微的描述,这些不同的分子程序有助于解释健康衰老和认知能力下降之间的差异,并突出显示与 AD 相关的细胞类型特异性分子程序。
阿尔茨海默病 (AD) 是一种与年龄相关的疾病,病理学上定义为脑实质中淀粉样斑块和神经原纤维缠结的沉积。单细胞分析表明,阿尔茨海默氏痴呆涉及几乎所有主要脑细胞类型的复杂相互作用。近期在Nature Neuroscience上发表的综述《Insights into Alzheimer’s disease from single-cell genomic approaches》强调了AD 中细胞类型特异性的分子扰动,以及讨论了来自单细胞的基因组信息如何扩展现有的AD 发病机制范例并强调治疗干预的新机会。
背景
单细胞基因组学已经明确了小鼠和人类大脑中主要细胞类型的复杂分子调控。从具有不同 AD 病理阶段的个体的单个细胞中分析遗传信息揭示了 AD 中详细的细胞类型特异性分子程序(图 1)。我们需要牢记与从单细胞解释基因组研究相关的挑战,例如从存档的脑组织中分析单核而不是单细胞的普遍必要性,主要细胞类型的分子干扰会集中在共同的信号通路上,例如作为脂质处理、免疫反应和代谢重编程(图 2)。进一步明确和操纵核心信号节点可能会为治疗干预带来新的机会。
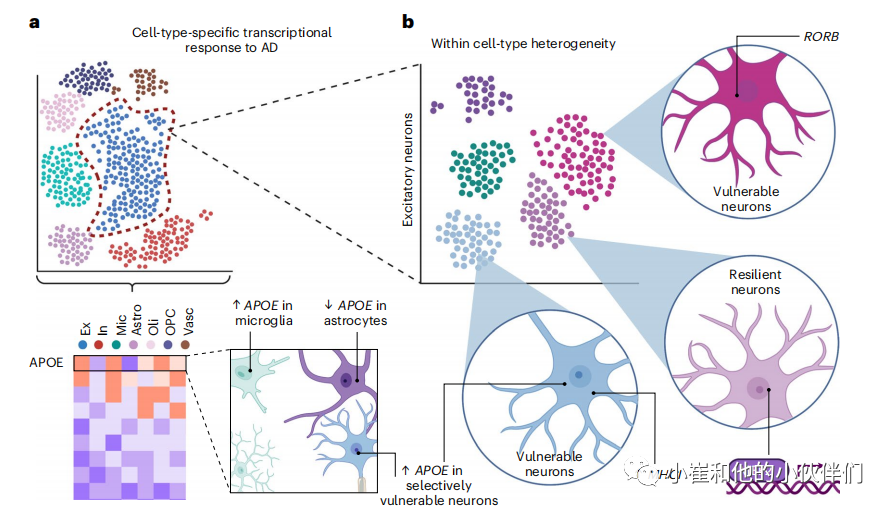
图1 AD研究中单细胞方法的中心优势概述
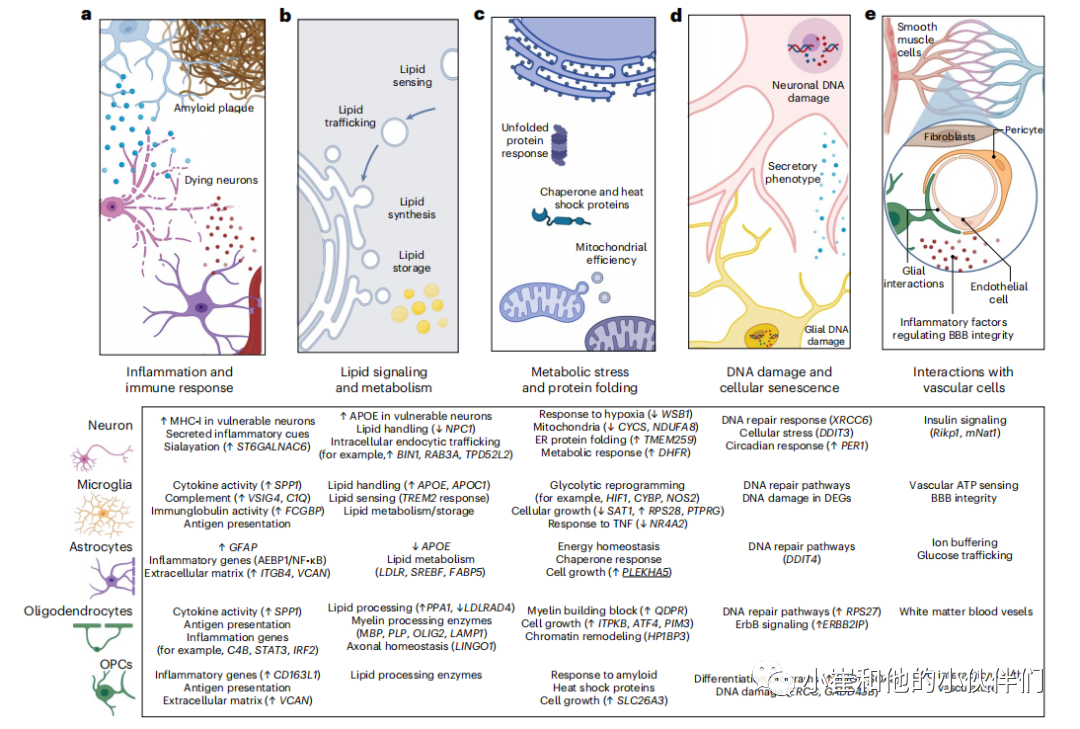
图2 单细胞基因组学揭示AD中共享细胞通路受到干扰
兴奋性神经元
已经证实突触改变和神经元丢失在 AD大发病中起重要作用,单细胞分析进一步揭示了调节神经元功能障碍的分子程序(图 3)。一些单核 RNA 测序 (snRNA-seq) 研究表明:AD患者的兴奋性神经元改变了调节神经递质释放、突触囊泡循环和谷氨酸代谢的基因。组织学发现AD中突触后末端丢失,几个差异表达的基因与突触后支架分子、谷氨酸受体运输和钙调蛋白信号转导有关。重要的是,原位杂交证实了其中一些发现,例如兴奋性神经元数量减少和 NTNG1 (一种参与调控神经突生长的基因)下调。抑制性突触在成人大脑中具有高度可塑性,被认为能够灵活调节稳定的兴奋性连接的作用,但其在AD中数量也减少了。这些发现部分反映在对抑制性突触至关重要的基因表达改变中,例如调节一些整合素基因。有髓鞘轴突的完整性对于远程投射至关重要,并且与神经元-少突胶质细胞相互作用相关的基因在AD神经元中被调节,如LINGO1的上调。是髓鞘形成的负调控因子。这些转录变化表明,AD中突触元件不仅在结构上丢失,而且控制它们完整性的分子机制也失调了。
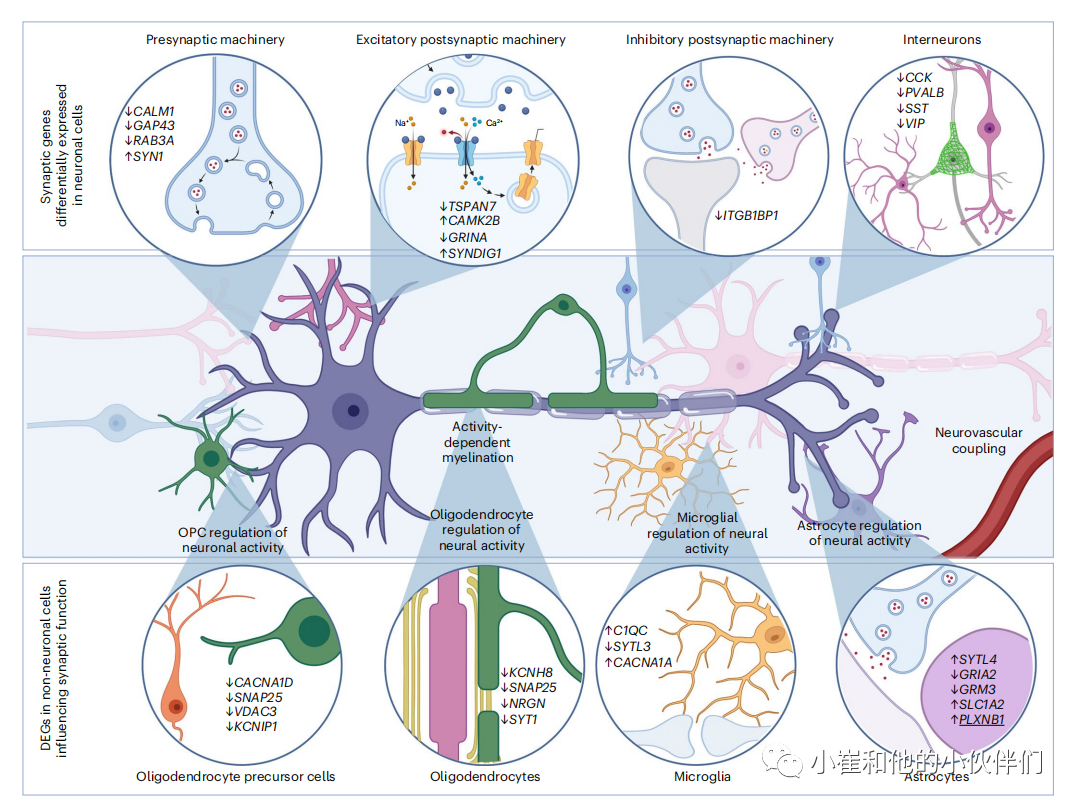
图3 单细胞基因组学揭示在AD中感受和调控神经活动的特异细胞类型扰动
一些研究强调了AD 神经元如何调节应激相关基因,特别是与分子伴侣介导的蛋白质折叠相关的基因(例如,DNAJA1)。AD神经元中改变的基因也与线粒体转位酶、葡萄糖传感和糖酵解有关(例如,SLC2A3,它编码在突触末端富集的葡萄糖转运蛋白)。突触线粒体对于持续的突触功效至关重要,转录谱提供了对 AD 神经元中被破坏的代谢程序的深入。
定义选择性易受功能障碍影响的神经元的遗传特征可能会揭示控制 AD 退化的分子逻辑。Tau 聚集体在一些神经元内形成神经原纤维缠结,这是 AD 的典型病理学标志,与神经元丢失密切相关。基于具有神经原纤维缠结的神经元的荧光激活细胞分选 (FACS) 显示,与AD个体的非缠结神经元相比,突触基因在缠结神经元中失调。一项单独的 snRNA-seq 研究表明,BAG3 是蛋白毒性诱导信号传导的主要调节因子,可调节 tau 稳态 。减少初级皮层神经元中的 BAG3 导致 tau 积累,BAG3 过表达减弱 tau 病理学,表明与 tau 代谢相关的选择性脆弱性可能部分受 BAG3 控制。同样,转录因子 RORB 被认为标记一种调节与突触蛋白和神经递质受体相关基因的缠结神经元群。因此,RORB 可能是选择性脆弱神经元的标记物。相反,一些神经元可能优先对 AD 有弹性:一部分个体具有广泛的淀粉样蛋白和 tau 病理学但不表现出痴呆症,因此提供了一个易于处理的机会来询问对认知衰退的弹性的分子基础。与具有高病理和低认知的年龄匹配个体相比,具有高 AD 病理和正常认知的个体的兴奋性神经元中 MEF2C 被上调。在小鼠中损害Mef2a/c 会导致神经元过度兴奋,而在 Tau 中具有 p.Pro301Ser 突变的小鼠中 Mef2a/c 过度表达可挽救 tau 病变引起的过度兴奋。这些发现表明与神经元放电相关的特性可以解释个体神经元对退化的易感性或恢复力。
全基因组关联研究 (GWAS) 的风险变异进一步突出了 AD 的不同风险。载脂蛋白 E 基因 (APOE) 的 ɛ4 等位基因被认为是散发性迟发性 AD 最有效的遗传风险因素。虽然 APOE 主要由星形胶质细胞和小胶质细胞表达,但单个神经元中 APOE 的可变表达表明一些神经元表达相对较高水平的 APOE。APOE 水平升高与细胞应激和死亡有关,表明神经元 APOE 和 MHC-I 信号可能是导致 AD 神经退行性变易感性差异的重要因素。载脂蛋白对脂质转运至关重要,在 AD 神经元中调节的其他脂质相关基因包括那些与胆固醇转运相关的基因(例如,NPC1),它编码一种溶酶体胆固醇转运蛋白,其功能丧失与神经元死亡有关和脂质信号(例如,LAMTOR5,与内体/溶酶体转运有关)。这些发现突出了复杂的脂质相关信号网络,这些信号网络在 AD 神经元中被破坏了。
神经元DNA损伤
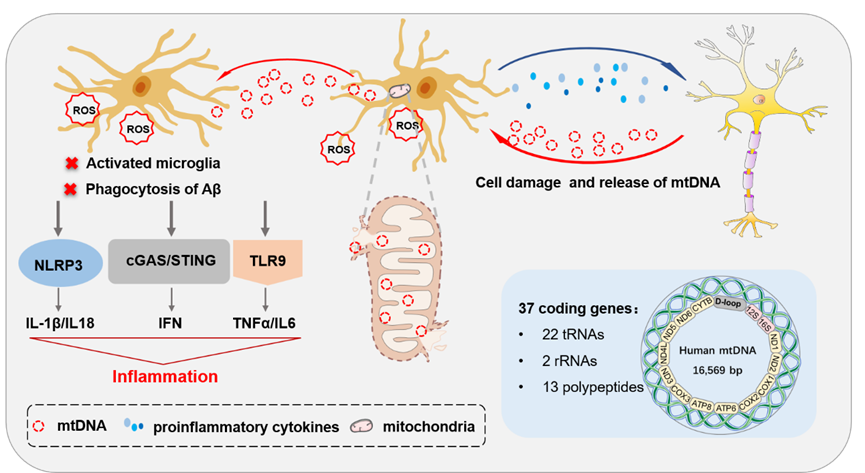
众所周知,DNA 损伤会发生在 AD 神经元中,snRNA-seq 揭示了 AD 神经元调节与 DNA 修复酶相关的基因(例如,XRCC6,它参与 DNA 修复启动,在 AD 神经元中下调)。此外,单细胞全基因组扩增测序表明神经元中的 DNA 损伤在神经变性过程中升高。人类神经元中高DNA损伤富集在AD24个体的差异表达基因中,这可能表明AD神经元中基因表达失调可能与DNA修复受损有关。DNA 损伤可能是与代谢应激相关的细胞状态转换的一部分(例如,DNA 损伤诱导转录物 DDIT3 的上调可能与更广泛的细胞应激程序有关) . 背负 DNA 损伤的神经元也会激活神经变性中的炎症信号。已知 DNA 损伤发生在神经元增强子和启动子上,特别是在学习期间,并且是学习相关的即刻早期基因表达所必需的。理清 AD 中与学习相关的 DNA 损伤和与衰老相关的 DNA 损伤可能会导致对 AD 中神经回路破坏进展的新见解。
神经发生
单细胞基因组学已经对成人大脑中新神经元的发展过程产生了分子上的深入了解,包括干细胞的分子定义及其最终命运,尽管神经祖细胞的常见标记可能会使定义人类神经发生的努力复杂化。PSEN1 的突变可能会改变干细胞生态位,并且一些神经干细胞可能特别受到淀粉样蛋白毒性的影响,因此 AD风险基因可能会改变AD背景下的神经发生。
中间神经元
中间神经元严格塑造神经活动的同步模式,单细胞转录组学提供小鼠和人类大脑中间神经元亚型的分子定义,这反映了他们的功能库。中间神经元与 AD 中的兴奋性神经元共享转录变化,包括与代谢应激、离子转运、DNA 损伤、神经元周围网络组装和 ErbB 信号转导相关的基因。尽管在淀粉样蛋白小鼠模型和用人 APOE4 靶向替代小鼠 Apoe 的小鼠中,中间神经元依赖性神经元节律的功能扰动已得到充分证明,但不同中间神经元亚型内的转录改变已经逃避了综合表征AD。AD中间神经元中的下调基因包括典型中间神经元亚型的标记基因,包括 SST、PVALB 和VIP。神经元间神经肽被认为调节抑制回路和神经血管偶联,因此 AD 中受损的神经元间肽信号传导可能广泛损害痴呆症中的神经元信号传导。典型标记的丢失也可能表明中间神经元失去了其转录身份的核心方面,这可能反映了细胞功能的整体丧失。
小胶质细胞
GWAS 的发现突出了免疫相关基因(例如 TREM2、CD33 和 HLA-DR)中与 AD 相关的变异;因此,小胶质细胞在单细胞分析中受到极大关注(图 4)。
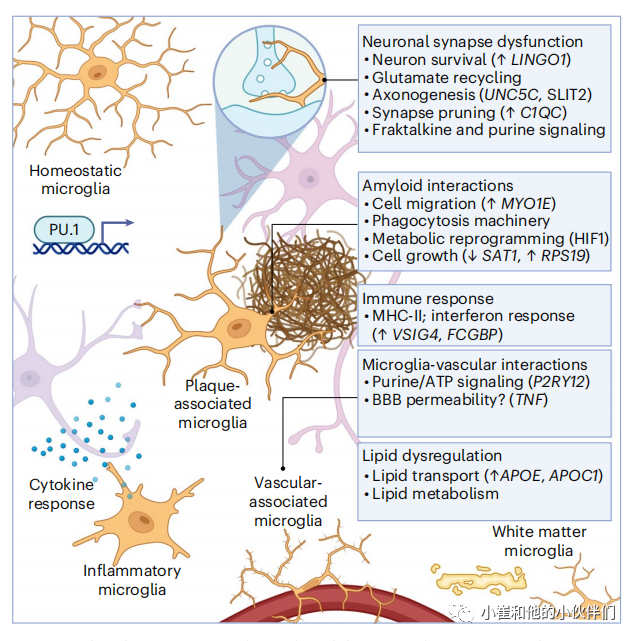
图4 单细胞基因组学揭示AD小胶质细胞的分子程序
斑块相关小胶质细胞
首批分析小胶质细胞的单细胞转录组学研究之一揭示了 5XFAD 小鼠的独特亚型,这是一种流行的淀粉样蛋白模型,具有与家族性 AD 相关的五个突变。来自 5XFAD 小鼠海马体的小胶质细胞被称为“疾病相关小胶质细胞”。含有 DAM 转录特征的小胶质细胞被发现定位于淀粉样斑块。一项研究根据用甲氧基-X04 标记的斑块水平对 5XFAD 小鼠的小胶质细胞进行了分类,甲氧基-X04 是一种荧光探针,可与淀粉样蛋白的纤维状 β 片层结合。有趣的是,甲氧基标记的小胶质细胞增加了缺氧诱导因子(由Hif1a编码)的表达,这可能与人AD小胶质细胞中与Hif1a信号通路相关的代谢程序的广泛开关有关。在5XFAD小鼠中的研究表明,斑块相关的小胶质细胞上调了与细胞表面受体(Trem2, Tyrobp, Clec7a),整合素(Itgax)和免疫相关通路(Csf1和Ccl6)相关的基因。这种转录特征在CKp25、APP-PS1、APPNL-G-F、Tau p.Pro301Ser和p.Pro301Leu小鼠中得到部分再现。
阿尔茨海默病小胶质细胞的脂质代谢
TREM2 在小胶质细胞中充当多种脂质的传感器,TREM2 的 p.Arg47His 变体与 AD 风险增加和小胶质细胞中 Akt 信号增强有关。在非AD个体的脂肪组织中,TREM2 驱动涉及吞噬作用、脂质分解代谢和能量代谢的基因表达,这表明 TREM2 可能广泛调节巨噬细胞中与脂质相关的代谢程序。根据实验研究强调小胶质细胞中脂质感应和代谢的重要性,小胶质细胞脂质代谢途径在AD中被广泛破坏。有趣的是,5XFAD 小鼠的 DAM 表型依赖于 Trem2。小鼠的几项研究结果表明,操纵小胶质细胞脂质通路可调节病理学。例如,敲低小鼠 Apoe 赋予 APP/PS1 小鼠神经保护作用,而过表达低密度脂蛋白受体(介导脂质清除)在 Tau p.Pro301Ser 小鼠中过表达时可减轻病理,并将小胶质细胞转录特征转变为稳态。脂质代谢对于小胶质细胞快速重塑质膜以进行局部大脑监测和调节神经活动至关重要,这些发现表明靶向小胶质细胞脂质相关通路可能会减轻 AD 病理。
神经元支持中的小胶质细胞扰动
明白小胶质细胞是如何调节神经回路这个过程变得越来越重要。小胶质细胞部分通过补体介导的突触消除fractalkine 信号和嘌呤来调节神经。因此,一些研究表明 AD 小胶质细胞调节与补体(C1Q)、分形受体(例如 CX3CR1)和嘌呤受体(P2RY12)。因此,AD 中的神经元功能障碍可能部分是由于小胶质细胞感知和控制神经元活动的能力改变所致。小胶质细胞代谢状态的扰动,部分与细胞应激和糖酵解转变有关,可能会集中在信号通路上,从而损害小胶质细胞调节神经元活动的能力(例如,使用 CRISPR 编辑的诱导多能干细胞的模型发现 APOE4 诱导的脂质积累损害神经元网络活动的小胶质细胞监测。小胶质细胞状态也可能与不同的 GABA 能回路和锥体神经元亚型有关;因此,未来定义小胶质细胞-神经元串扰的工作可能会揭示小胶质细胞控制 AD 神经元功能障碍的分子逻辑。
小胶质细胞和巨噬细胞的血管功能
毛细血管相关的小胶质细胞被认为通过嘌呤能信号调节血液流动。小胶质细胞和血管周围巨噬细胞被认为拥有不同的个体发生,一个由高Mrc1标记的细胞亚群(外周巨噬细胞的标记物)可能代表一个转录上不同的血管相关巨噬细胞群。血管相关小胶质细胞/巨噬细胞与血管细胞之间的信号通路可能影响AD的神经血管功能。例如,AD小胶质细胞分泌的因子可能调节内皮紧密连接的完整性。小胶质细胞分泌的趋化因子可能影响内皮壁的炎症状态(这反过来可能导致中性粒细胞粘连和毛细血管失速诱导的血流减少)。未来的研究可能会进一步确定血管相关巨噬细胞如何影响AD的血管通透性和神经血管耦合。
白质相关小胶质细胞
与灰质小胶质细胞相比,白质小胶质细胞具有不同的转录状态,并共享与DAM相关的基因。类似的白质小胶质细胞转录特征在5XFAD和APPNL-G-F小鼠中也存在,TREM2敲除可降低白质小胶质细胞的转录水平存在白质小胶质。白质小胶质细胞功能障碍可能与髓磷脂的修复和吞噬有关。进一步定义白质相关的小胶质细胞可能揭示促进有髓轴突健康的干预措施。
小胶质细胞炎症的状态转变
Morabito等人用snATAC-seq和snRNA-seq在表观基因组和转录组水平上定义AD关的基因调控程序。AD中的一些小胶质细胞对SPI1有更多开放的结合位点,SPI1编码髓系细胞分化的主要调节因子PU.1。PU.1可能是晚期AD小胶质细胞的转录抑制因子,AD小胶质细胞中复杂的转录因子网络(例如由ELF5、ETS1、ETV5和SPIC编码)可能参与AD的小胶质细胞状态转变。事实上,PU.1的表达水平和PU.1依赖的转录控制被认为是重要的调节小胶质细胞功能,如小胶质细胞清除淀粉样蛋白。单细胞转录组学和CRISPR推断和激活筛选可能进一步揭示调节小胶质细胞状态的基因程序。
星形胶质细胞
星形胶质细胞参与神经元营养支持、细胞外离子稳态和脑液平衡。单细胞分析揭示了星形胶质细胞的分子异质性和 AD 中的星形胶质细胞扰动。
星形胶质细胞代谢
星形胶质细胞是大脑能量稳态的核心驱动力。一些来自人类AD皮质的snRNA-seq研究表明,AD星形胶质细胞改变了与细胞应激相关的基因和与细胞应激相关的代谢重编程基因(如CIRBP, CABLES和CSRP1),以及许多与星形细胞细胞骨架结构重塑相关的基因(如GFAP) 和细胞外基质(如泛基因VCAN和整合素基因ITGB8和ITGB4)。在AD和5XFAD小鼠海马的多个snRNA-seq数据集中,也观察到AD星形胶质细胞中GFAP的上调,这可能有助于临床相关的生物标志物。考虑到星形胶质细胞在损伤和神经退行性变后对大脑炎症状态的严重反应和调节,可能以区域特异性的方式,这些发现强调了AD星形细胞代谢重编程的转录基础。AD星形胶质细胞中的许多失调通路都集中在脂质信号上(例如,编码磷脂酶的PLCE1和载脂蛋白家族基因)。与脂质合成和运输相关的基因(如LDLR)在AD星形胶质细胞中受到干扰。AD星形胶质细胞代谢重编程可能导致神经元回路调节能力受损。一项研究表明星形胶质细胞能分解过度活跃的神经元分泌的细胞毒性脂肪酸。来自5XFAD小鼠海马的疾病相关星形胶质细胞中脂质相关通路失调,包括胆固醇通路,概括了人类AD星形胶质细胞功能障碍的各个方面,这些方面与脂滴的运输和存储有关,以及活性氧的解毒(例如SOD2)。在小鼠中去除星形胶质细胞APOE4可降低多种细胞类型的疾病相关转录特征,并防止tau介导的神经退行性变。这些发现表明,星形胶质细胞中的脂质相关信号网络可能是AD的核心摄动。

图5 单细胞基因组学揭示AD星形胶质细胞中采用的分子程序
阿尔茨海默病星形胶质细胞功能失调的突触通讯
星形胶质细胞促进神经递质穿梭和突触营养支持。来自人类的snRNA-seq 数据表明,AD 星形细胞改变了与谷氨酸受体亚基相关的基因(例如,GRIA2、GRM3 和 GRID2)。 星形胶质细胞中的缝隙连接和钾处理对神经功能起到关键作用,来自人类 AD 样本的几项 snRNA-seq 研究揭示了与缝隙连接相关的基因(例如,GJA1 的上调,它编码主要的星形胶质细胞缝隙连接成分连接蛋白)和离子转运蛋白(例如,KCNIP4 的下调)在 AD 星形胶质细胞中失调。总的来说,这些转录变化突出了星形胶质细胞中调节细胞外离子稳态和神经元功能的分子通路失调。
为了深入了解驱动星形细胞状态之间转变的分子基础,几个小组分析了转录因子表达谱。转录因子 AEBP1 是主要免疫信号调节因子 NFκB 的共激活因子,可能调节星形胶质细胞中与 AD 相关的状态转换。由 TFEB 编码的主要溶酶体调节因子在 AD 患者的星形胶质细胞中上调,鉴于 TFEB 对溶酶体通路的重要性,细胞内脂质相关过程的功能障碍可能是一个关键驱动因素AD 相关功能障碍。AD小胶质细胞和星形胶质细胞之间有几个基因重叠(例如,CTSB、CTSD 和 APOE),这可能表明AD中可能出现常见的神经胶质炎症环境,包括与神经元的代谢协调减弱。
星形胶质细胞和小胶质细胞产生的复杂双向炎症环境(可能部分由少突胶质细胞相关细胞),共同调节神经元功能。分泌细胞因子和脂质相关运输的功能障碍可能代表对AD病理学的功能冗余神经胶质反应。例如,上面强调的小胶质细胞的代谢转变可能部分由AD星形胶质细胞共享,它调节参与细胞生长和信号转导的基因。这些变化共同突出了AD中主要细胞类型共享的常见脂质相关和免疫相关信号通路。
少突胶质细胞
来自小鼠和人脑的单细胞转录组学数据反映了少突胶质细胞的高度异质性。AD少突胶质细胞中受到干扰的分子程序反映了这些细胞多种功能库的改变,包括髓鞘形成、感知神经活动和免疫功能(图6)。
在AD中,白质体积和髓鞘形成率的缺陷得到了很好的评价。许多髓磷脂相关基因在AD少突胶质细胞中被干扰,如LINGO1的上调。髓鞘形成的负调节因子,在AD兴奋性神经元中也上调)和CNTN2和OPALIN(被认为调节轴突稳态的基因)下调。在AD的早期少突胶质细胞中,参与髓鞘生成的基因发生改变,包括与基本细胞构建模块相关的酶的基因(例如CERS2,CARNS1和QDPR7-9,它们编码对白质完整性重要分子的加工很重要的基因)和髓鞘形成本身(如PLP1, OLIG1和MBP)。一些来自人脑的研究也强调了脂质运输基因的改变,包括与载脂蛋白和脂质受体相关的基因(如ABCA6, LRP1和LDLRAD4) ,溶酶体功能(如LAMP1)和溶质载体(如SLC38A2和SLC5A11) 。这些发现强调了与生物合成过程和脂质处理相关的细胞通路集中于髓鞘合成,并可能在一定程度上解释了少突胶质细胞功能障碍如何导致AD中髓鞘形成的结构和可塑性缺陷。
髓鞘形成是一个高度调控的动态过程,可能是解剖学上截然不同的神经回路所特有的。髓鞘的可塑性可能与少突胶质细胞感知神经活动的能力有关,例如对小白蛋白抑制性中间神经元而非兴奋性胼胝体投射神经元的感觉经验依赖的髓鞘形成重塑。snRNA-seq提示AD少突胶质细胞调节与离子通道和谷氨酸受体亚基(如GRM3和GRID2)相关的基因。
这些发现提示AD少突胶质细胞可能表现出感知和调节神经活动的能力受损。记忆的保存被认为需要新的髓磷脂的形成,因此受损的少突胶质细胞自适应监测神经活动和促进髓磷脂重塑的能力可能控制AD的认知能力下降。
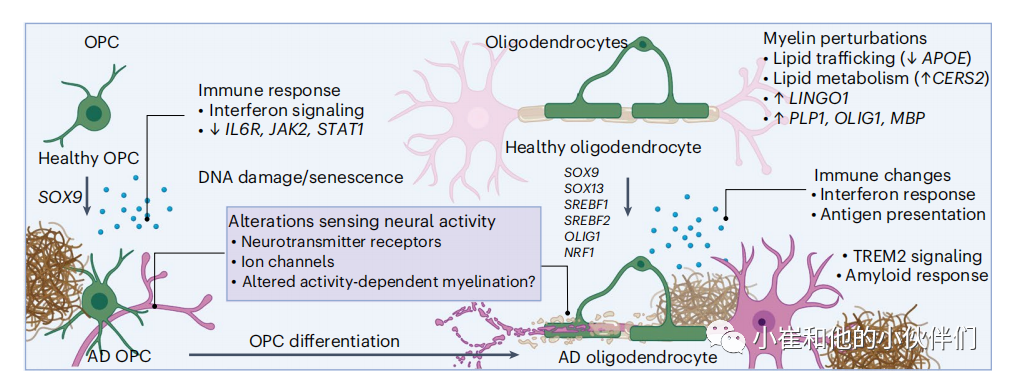
图6 单细胞基因组学揭示AD少突胶质细胞采用的分子程序
少突胶质细胞免疫和血管功能
小鼠研究揭示了少突胶质细胞的抗原处理和呈递能力,AD 少突胶质细胞调节与主要组织相容性类 (MHC)-I 和 MHC-II 相关的基因有关。许多其他免疫通路在 AD 中受到干扰,包括干扰素反应和炎症(例如,CD63 和 IRF2,它们参与免疫细胞的激活)。少突胶质细胞在 5XFAD 小鼠中显示出主要的转录组学改变。5XFAD小鼠的斑块承载区域中以 Serpina3n[+]C4b [+] 标记的反应性少突胶质细胞被认为以 TREM2 依赖性方式出现。少突胶质细胞也可能通过分泌调节血管细胞功能的生长因子(例如,被认为调节血管功能的 PDGF 信号,失调的 AD 少突胶质细胞)来响应并参与血脑屏障 (BBB) 的完整性。少突胶质细胞还支持细胞外基质重塑,这是髓鞘再生的关键因素,AD 少突胶质细胞调节与胶原蛋白、层粘连蛋白和软骨蛋白相关的基因。其中一些变化可能反映了与白质损伤相关的损伤,这是 AD 中常见的临床发现。总的来说,这些研究结果突出了 AD 少突胶质细胞采用的异质分子程序。
少突胶质细胞前体细胞
少突胶质细胞前体细胞 (OPC) 分布在整个灰质和白质中。snRNA-seq 揭示了小鼠和人类皮层中OPC 的异质亚型。OPC 调节神经活动并具有免疫相关和血管相关功能,而 snRNA-seq 反映了这些过程中 OPC 状态扰动的改变。例如,多项来自人类的 snRNA-seq 研究表明 AD OPC 下调离子通道基因(例如,KCNIP1 和 CACNA1D),并可能改变编码神经递质受体的基因、谷氨酸受体和突触基因。与少突胶质细胞一样,OPC 被认为可以动态感知和调节神经活动。转录结果强调OPC调节与电压门控离子通道相关的基因,提示OPC可能具有改变的神经网络感知能力,这可能在一定程度上解释了AD患者自适应髓鞘形成和神经元完整性的功能障碍。OPCs调节免疫相关基因(例如,IFIT1),突出了炎症和免疫机制在opc介导的AD功能障碍中的潜在作用。少突胶质细胞分化部分依赖于OLIG1,它在AD OPCs中上调,支持OPC命运动态重编程的改变,这可能是AD中少突胶质细胞改变的原因。
DNA损伤的OPCs可能改变其分化程序,值得注意的是,淀粉样蛋白本身被认为可以诱导OPCs衰老,而这可以通过抗衰老治疗逆转。
血管细胞
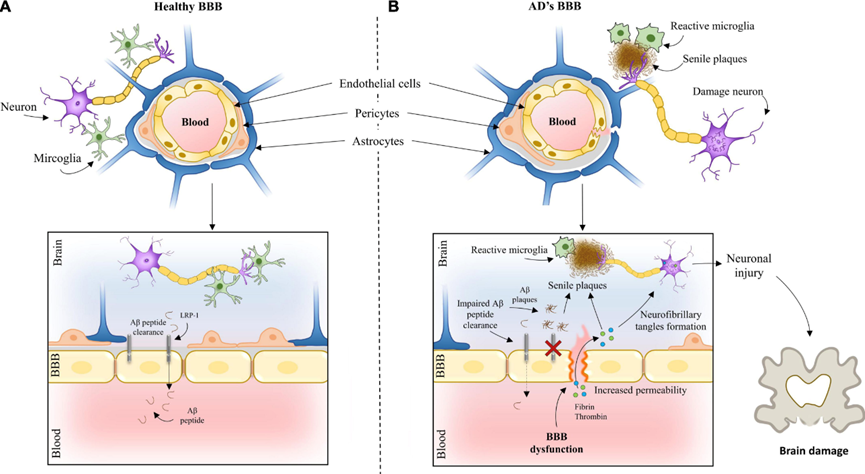
血管功能的改变对大脑稳态起着至关重要的作用,血流减少可能在 AD 早期出现。snRNA-seq 提供了小鼠和人类大脑中功能不同的血管细胞的分子定义。这些研究表明,AD 中的血管细胞改变了免疫信号、神经血管耦合和通透性。脑内皮细胞控制离子、分子和细胞在血液和实质之间的运动,这些特性统称为 BBB。来自 AD 患者的 snRNA-seq 数据揭示了很多方面的转录扰动BBB过程,包括紧密连接(例如 CLDN5)、溶质转运蛋白(例如 SLC2A1)和粘附分子链的改变。在 APP/PS1 小鼠的内皮细胞中,发现胰岛素敏感性调节剂 mNat1 控制内皮细胞坏死性凋亡。
周细胞存在于基底膜中并包裹着毛细血管。周细胞表达参与肌动球蛋白收缩的基因,这表明周细胞收缩性控制血管动力学的功能证据一致(例如,通过控制毛细血管连接处的血流和调节基础毛细血管直径),这可能导致 AD 相关的低灌注。来自 APOE4 携带者的人海马周细胞提高 NFAT 的表达,通过神经钙蛋白信号调节 NFAT 可降低 APOE 表达并改善淀粉样蛋白沉积 NFAT。APOE4 在小鼠血管壁细胞中的靶向表达可调节许多细胞的转录组,尤其是星形胶质细胞。总的来说,这些研究为与神经血管耦合和 BBB 完整性相关的 AD 血管功能障碍中的周细胞功能障碍相关观察提供了转录组学证据。
未来发展方向
单细胞分析揭示了 AD 中细胞类型特异性的改变,并突出了跨细胞类型功能失调的核心信号通路。并将遗传信息与其他细胞功能指标相结合,增强我们对不同细胞类型中 AD 改变的理解(图 7)。例如,使用空间转录组学保存解剖信息可能会深入了解 AD 的解剖进展,并定义易受 AD 功能障碍影响的不同神经元投射。扩大人类样本以解决性别、种族/民族、遗传风险变异以及教育、睡眠和运动习惯等因素的贡献,将进一步加深我们对导致记忆力下降的细胞表型的理解患有AD的人。必须整合现有的数据集并使其易于共享,以扩大 AD 反应的异质性并定义跨研究的一致基因表达变化。进一步定义人类分子特征在小鼠模型和细胞培养制剂中的重现方式将为剖析疾病机制带来新的实验机会。进一步表征在 AD 中变得功能失调的不同神经元微电路和细胞类型—并定义哪些细胞状态对 CSF 和血浆生物标志物有贡献,可能会产生新的框架来定义 AD 进展的细胞底物。通过识别脆弱的细胞类型和产生它们的分子程序,治疗干预可能会逆转异常的细胞轨迹。虽然许多转录改变是细胞类型特异性的,但这些变化最终可能会汇聚在跨细胞类型的共享信号通路上,这可能代表新治疗策略的目标。
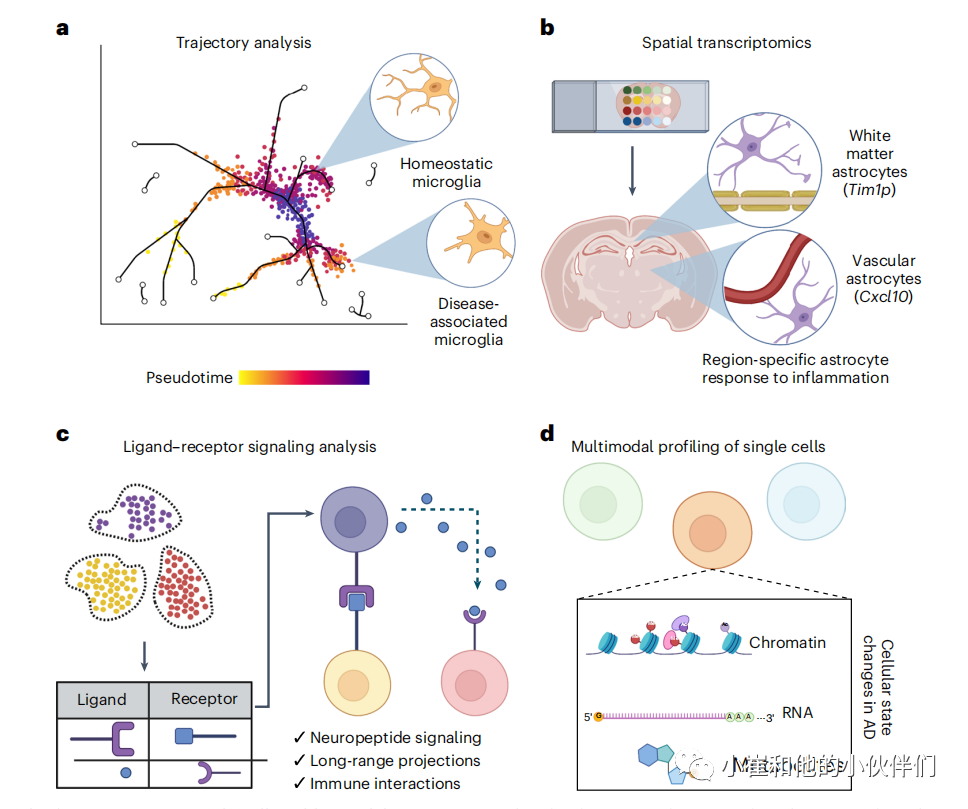
图7 新兴的AD单细胞谱方法
结论
单细胞分析有助于对 AD 大脑中受到扰动的各种细胞过程进行细致入微的描述,这些不同的分子程序有助于解释健康衰老和认知能力下降之间的差异,并突出显示与 AD 相关的细胞类型特异性分子程序。核心信号模块在多种细胞类型中被破坏,操纵被破坏的细胞状态将为新的治疗机会铺平道路。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言