晚期NSCLC奥希替尼耐药咋应对?从联合策略到第四代EGFR-TKIs
2024-02-22 苏州绘真医学 苏州绘真医学 发表于上海
在EGFR非依赖性机制的情况下,治疗可选择奥希替尼加特异性抑制剂或抗体-药物偶联物或双特异性抗体的联合策略。而如果存在新的EGFR突变,特别是在ATP结合位点,使用变构EGFR TKI将更合适。
研究背景
肺癌仍然是全球癌症相关死亡的主要原因,超过乳腺癌、结直肠癌和前列腺癌的死亡率总和。所有分期非小细胞肺癌(NSCLC)的 5 年总生存率约为 18%。在未来几年,筛查、靶向治疗和免疫治疗可能会改善这种不良预后。
目前,晚期NSCLC患者的治疗选择基于对一些参数的综合评估:组织学(鳞状与非鳞状);驱动基因变异的存在(EGFR 和/或 BRAF 敏感突变,以及 ALK 和/或 ROS1 和/或 NTRK 重排);PD-L1表达水平;患者的临床特征,例如年龄、体能状态(PS)和合并症。根据是否存在这些驱动基因变异,可以区分癌基因成瘾疾病和非癌基因成瘾疾病,采用不同的治疗方法。
已在NSCLC中发现了多种驱动基因变异。其中一些已可以通过特定药物靶向,另一些或许能够靶向,包括:KRAS基因突变(20-30%)、EGFR(10-15%的白人患者和高达40%的亚裔患者)、BRAF(2-4%)、ALK重排(3-7%)、ROS1(1-2%)、RET(1-2%)、NTRK(0.5-1%)、HER2基因突变(1-2%)和MET基因扩增或突变(2-4%)。
EGFR酪氨酸激酶抑制剂(TKIs)是携带常见突变(外显子19缺失(Ex19dels)和外显子21点突变(L858R))的晚期NSCLC患者的推荐一线治疗。多项随机 III 期试验表明,在携带常见 EGFR 突变的晚期 NSCLC 患者中,一线 EGFR TKI(吉非替尼、厄洛替尼、阿法替尼)在 RR 和 PFS 方面均优于标准铂类化疗。大多数接受这些药物治疗的患者(约一半)会出现耐药位点突变 T790M。为了克服这种耐药机制,开发了奥希替尼用于二线治疗。随后,其在一线治疗中,总生存期(OS)也优于第一代和第二代 TKI。因此,奥希替尼成为具有激活 EGFR 突变的晚期 NSCLC 患者的最佳治疗选择。然而,FLAURA-2试验和MARIPOSA试验的最新结果表明,一线联合策略延缓了耐药性的发生。与单药奥希替尼相比,奥希替尼加铂类-培美曲塞以及埃万妥单抗加拉泽替尼分别都实现了更长的PFS。
奥希替尼耐药机制
奥希替尼在一线或二线治疗中都大大改善了EGFR突变晚期NSCLC患者的生存,但获得性耐药的出现仍然是一个巨大的需求。
奥希替尼的耐药机制可能因用于一线还是后线治疗而异。奥希替尼最初是专门为在第一代或第二代TKI治疗期间出现T790M突变的患者开发的。在这种情况下,最常见的靶内耐药机制(约 14%)是 EGFR 外显子 20 C797S 点突变。19% 的患者发生 MET 扩增,7% 的患者与 C797S 突变一起发生。此外,HER2 和 PIK3CA 扩增、RET 和 NTRK 重排以及 BRAF V600E 突变分别在 3-5% 的病例中观察到。
关于奥希替尼一线治疗,一些文献数据报告了固有耐药性。相关机制包括 HER2 和 MET 扩增,在体外研究中观察到;还包括 KRAS G12D 突变同时 PTEN 缺失,以及 CDCP1 或 AXL RNA 过表达,在一些 NSCLC 患者中报道。
关于一线奥希替尼获得性耐药的主要信息来自III期试验FLAURA,其他一些文献数据来自病例报告或小型病例系列研究。FLAURA 试验中患者血液样本游离 DNA进行了 NGS 分析。没有观察到新发T790M突变。最常见的耐药机制是MET扩增(15%),其次是EGFR扩增(9%),以及C797S突变(7%)。S768I突变或其他EGFR共突变,如外显子19缺失+G724S(外显子18),L718Q(外显子18)+EGFR外显子20插入(外显子18+20),L718Q+C797S或L718Q+L797S(外显子18+20),非常罕见(<1%)。这些发现提示,继发性EGFR突变不是奥希替尼耐药的主要机制。
当对一线或二线奥希替尼产生耐药性时,观察到许多EGFR非依赖性机制。这些机制比靶内突变更明显,可能是由于与第一代或第二代 TKI 相比,奥希替尼对 EGFR 的抑制作用更强。此外,在奥希替尼治疗期间,EGFR非依赖性耐药机制往往比EGFR依赖性耐药机制更早发生,原因可能是在治疗的选择性压力下迅速出现预先存在的亚克隆。这种机制包括 MET 扩增、HER2 扩增、PI3KCA、BRAF 和 RAS 突变、ALK 或 RET 重排、细胞周期基因变异。正在进行的ELIOS试验(NCT03239340)旨在前瞻性地探索一线奥希替尼的获得性耐药机制,收集了配对的组织活检(治疗前和进展时)样本。此外,在约80%的NSCLC和超过85%的携带EGFR激活突变的NSCLC中发现HER3表达。其成为 EGFR TKI 耐药的进一步机制,倾向于转移进展和较差的预后。
最后,在高达15%的接受一线或后线奥希替尼治疗的患者中还观察到表型变化作为耐药机制,包括上皮-间充质转化和腺癌向小细胞癌的转化,后者与 RB1 和 TP53 突变有关。
在一线奥希替尼治疗期间出现疾病进展的患者应接受用于非鳞 NSCLC 的化疗方案。卡铂、紫杉醇、贝伐珠单抗和阿替利珠单抗联合治疗可能为一种治疗选择。抗 PD-1/PD-L1 药物作为单药治疗尚未被证明是该亚组患者的成功选择。三项III期试验探索了奥希替尼耐药后使用化疗+免疫治疗。CheckMate-722 表明在这些患者中缺乏益处。KEYNOTE-789 和 ORIENT-31 仍在进行中。
为了延长奥希替尼带来的获益,与第一代 TKI 类似,或可在具有某些条件的特定病例中进展后继续使用,例如轻度实体的仅影像学进展,缓慢的肿瘤动力学,无临床症状,以及在寡进展性疾病的情况下,与局部治疗联合。
下文讨论了对于一线奥希替尼治疗期间进展的患者,为了实现最佳结果,治疗策略的演变。针对这一目标的大多数研究仍在进行中。
联合策略
许多试验将奥希替尼与其他针对新出现的耐药机制的新型靶向药物联合使用。这些药物可分为特异性抑制剂、抗体-药物偶联物和双特异性抗体(表 1)。
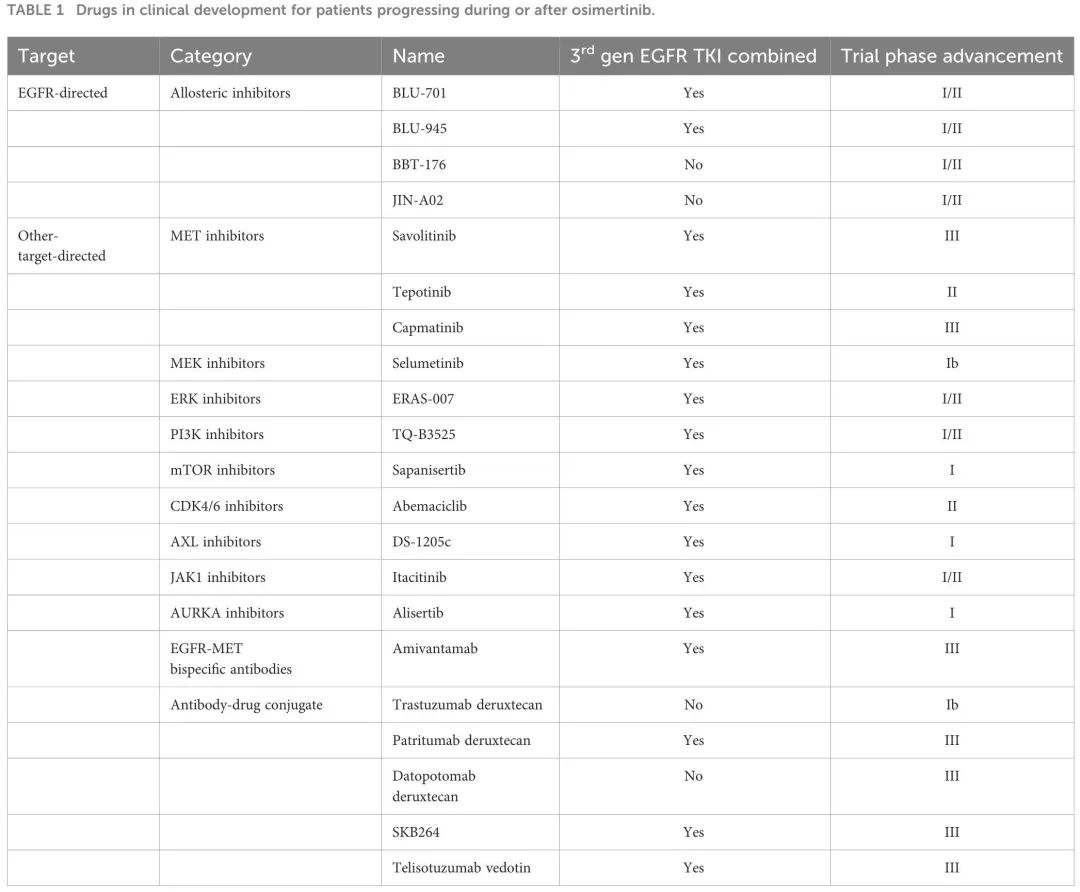
表1
鉴于MET变异是最常见的奥希替尼耐药机制,开发了三种MET抑制剂,与奥希替尼联合使用,包括赛沃替尼、特泊替尼和卡马替尼。还有其他特异性抑制剂,靶向 MEK(司美替尼)、AXL(DS-1205c)、ERK(ERAS-007)、mTOR(sapanisertib)、PI3Kα/δ(TQ-B3525)、JAK1(itacitinib)、CDK4/6(阿贝西利)、AURKA(alisertib)。
抗体-药物偶联物(ADC)由针对肿瘤分子的特异性单克隆抗体与细胞毒性有效载荷偶联而成。在单克隆抗体与其自身靶标结合后,药物被内化,连接子退化释放细胞毒性有效载荷,从而产生抗肿瘤作用。其中一些药物已用于 NSCLC 患者试验,特异性靶向 MET(telisotuzumab vedotin)、HER2(德曲妥珠单抗)、HER3(patritumab deruxtecan)、TROP2(datopotamab deruxtecan 和 SKB264)。所有这些抗体-药物偶联物都是在奥希替尼耐药后研究的。然而,只有 patritumab deruxtecan 和 telisotuzumab vedotin 与奥希替尼联合使用。有趣的是,patritumab deruxtecan I 期和 II 期试验的疗效结果在肿瘤膜广泛的治疗前 HER3 表达和各种 EGFR-TKI 耐药机制中实现。
最后,到目前为止,这种情况下的双特异性抗体仅有埃万妥单抗,一种针对突变EGFR和突变或扩增MET的全人源化抗体。其通过抑制配体结合和抗体依赖性细胞毒性发挥功能。该药物联合拉泽替尼(一种强效脑渗透性第三代 EGFR TKI),在三项临床试验(CHRYSALIS、CHRYSALIS-2、MARIPOSA-2)中用于奥希替尼期间或之后进展的患者。
ORCHARD是一项生物标志物指导的II期平台试验。该研究正根据一线奥希替尼的潜在耐药机制评估最佳治疗策略。出于这个原因,治疗分配基于奥希替尼进展时组织活检的分子肿瘤特征。每位患者根据发现的耐药机制被分配接受奥希替尼和特定靶向药物联合治疗,例如奥希替尼+赛沃替尼用于 MET 扩增,奥希替尼+耐昔妥珠单抗用于 EGFR 扩增等。如果未发现耐药机制,患者将被分配接受铂类化疗+度伐利尤单抗。具有无法靶向的耐药机制的患者根据当地实践治疗。该试验还包括一种适应性设计,允许添加新出现的药物。最近,一项安全性和有效性中期分析表明,奥希替尼+耐昔妥珠单抗在继发性 EGFR 基因变异(扩增、L718 或 G724 突变、外显子 20 插入)的患者中,符合无效标准,因此该治疗的招募已关闭。
第四代EGFR-TKI
我们上面讨论的奥希替尼获得性耐药的治疗策略适用于EGFR非依赖性耐药机制,这在一线奥希替尼治疗患者中更为常见。然而,一些患者会出现靶内EGFR突变,例如外显子20 C797S点突变,主要与激活突变呈顺式结构。尚无靶向该突变的特定药物。布格替尼,一种 ALK 抑制剂,对具有该突变的细胞表现出活性,但在体内需要与西妥昔单抗联合才有效。一项回顾性分析纳入了 15 例 C797S 突变导致奥希替尼耐药的患者,布格替尼联合西妥昔单抗的客观缓解率为 10%,疾病控制率为 60%。
正在开发各种EGFR抑制剂,包括新的TKI,为“第四代”或EGFR变构抑制剂(表1)。这些药物与激酶结构域ATP口袋外的受体结合,选择性地改变 EGFR 构象,绕过 ATP 结合域新突变(主要是 C797S)介导的耐药机制。EAI-045是首个被发现的该类药物,作为单药使用时活性有限,需与西妥昔单抗联合才对三重EGFR突变的细胞系(L858R / T790M / C797S)有效。同样,JBJ-04-125-02 联合奥希替尼相比单药,可增加细胞死亡,更有效地抑制细胞增殖。CH7233163 是另一种第四代 EGFR TKI,对 EGFR 三重突变(ex19del/T790M/C797S)表现出更强的抗肿瘤活性。其他一些EGFR变构抑制剂被纳入I/II期临床试验的设计中,包括BLU-701(HARMONY试验)、BLU-945(SYMPHONY试验)、BBT-176、JIN-A02。前两种作为单药和联合奥希替尼均被探索用于既往EGFR TKI期间或之后进展的患者。
讨 论
随着这些新治疗策略的出现,一线奥希替尼耐药患者或许能够避免或延迟化疗选择。哪些治疗策略更优,仍然没有足够的疗效数据。基于这些新药所针对的分子靶点,当接受奥希替尼治疗的患者对该药物敏感性低时,有必要评估出现了什么耐药机制。寻找这些耐药机制需要进行组织活检,可能需要结合血液样本游离DNA基因检测。液体和组织样本检测相结合可以明确耐药机制,指导最合适的分子疗法。原则上,在EGFR非依赖性机制的情况下(例如MET过表达或MET扩增,如CHRYSALIS-2试验生物标志物分析所见),治疗可选择奥希替尼加特异性抑制剂或抗体-药物偶联物或双特异性抗体的联合策略。而如果存在新的EGFR突变,特别是在ATP结合位点,使用变构EGFR TKI将更合适。这些正在进行的临床试验的结果可以解决一个相关问题:奥希替尼继续与这些新药联用还是停用。图1 总结了可能的未来情况,各种较为常见的一线奥希替尼耐药机制对应什么下一代治疗选择。基于许多临床试验的新结果,我们认为,未来,对于一线奥希替尼耐药患者,肿瘤学家将根据循环游离DNA和/或肿瘤组织DNA检测结果,采取不同的治疗策略。而一线联合策略(如FLAURA-2和MARIPOSA试验探索的)的结果,将进一步改变这种情况,我们认为可能会出现不同的耐药机制。面对可能导致一线治疗(奥希替尼单药或联合策略)耐药的基因变异的复杂性,有必要进行液体活检,如果没提供信息,可进行组织活检。我们认为平台试验的设计可能是管理耐药发生复杂性的最佳选择。
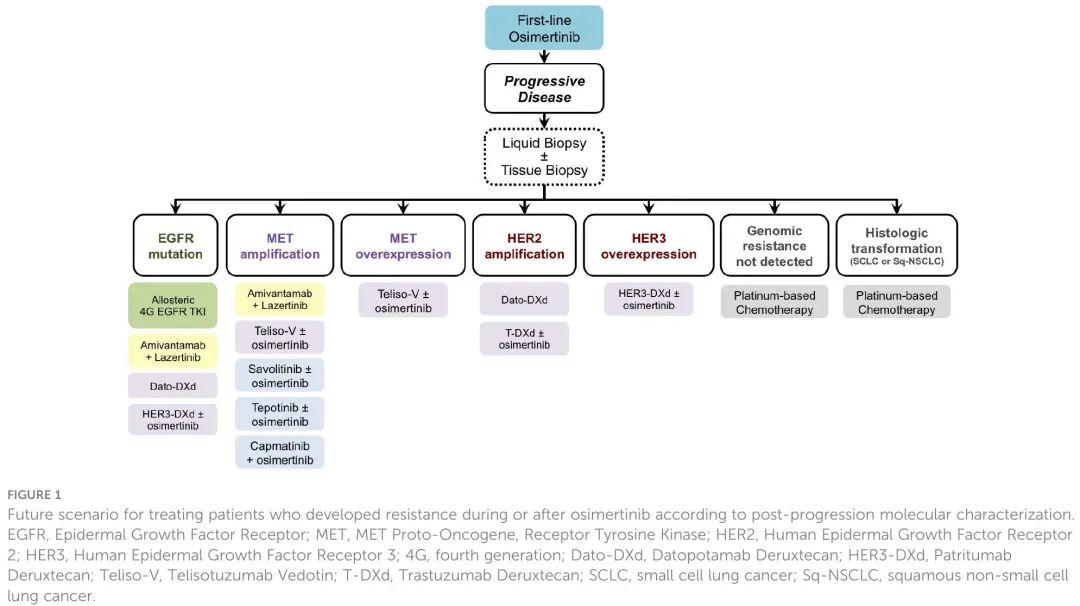
图1
参考文献:
Bronte G, Belloni A, Calabrò L and Crinò L (2024) The great need to overcome osimertinib resistance in advanced non-small cell lung cancer: from combination strategies to fourth-generation tyrosine kinase inhibitors. Front. Oncol. 13:1308460. doi: 10.3389/fonc.2023.1308460

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#NSCLC# #EGFR-TKIs# #奥希替尼#
26