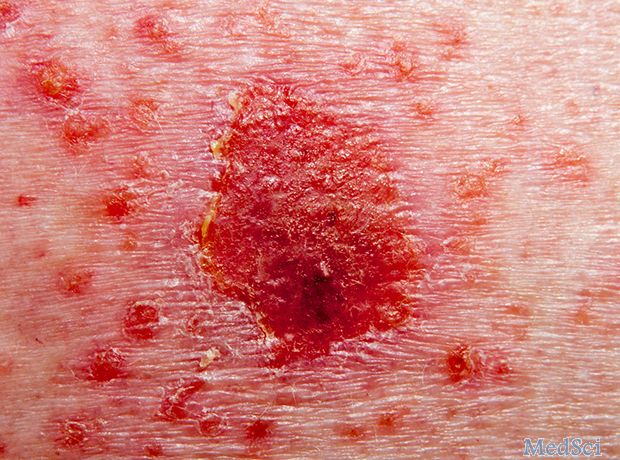
AbbVie向美国提交risankizumab
AbbVie已在美国提交risankizumab,寻求批准其用于治疗中度至重度斑块型银屑病。这项提交得到了四项III期研究的支持,涉及2000多名患有该病的患者,数据显示,接受该药物的患者中有一半以上在一年内实现了完全皮肤清除(PASI 100)。AbbVie研发部门首席科学官执行副总裁Michael Severino表示:"risankizumab提交是我们推进免疫介导疾病患者治疗目标的重要里程
MedSci原创 - risankizumab - 2018-04-29
【FDA指南分享】在上市前通知中提交和审查无菌信息(510(k))标记为无菌的器械提交
本指导文件还提供了有关我们建议申办者在 510(k) 提交中包含的热原性信息的详细信息。
网络 - 2024-01-17
百时美向FDA提交丙肝新药NDA
百时美施贵宝(BMS)4月7日宣布,已向FDA提交了实验性丙肝药物daclatasvir(DCV)和asunaprevir(ASV)的新药申请(NDA),daclatasvir是一种实验性NS5A复制复合物抑制剂
生物谷 - 新药,FDA - 2014-04-08
武田在日本提交TAK-438新药申请
武田(Takeda)3月3日宣布,已向日本劳动卫生福利部(MHLW)提交了实验性胃酸分泌抑制剂TAK-438(通用名:vonoprazan富马酸)的新药申请(NDA),该药属于钾离子(K+)竞争性酸阻滞剂
生物谷 - FDA,武田,TAK-438 - 2014-03-05
百特向FDA提交HyQvia修正版BLA
百特(Baxter)12月2日宣布,已向FDA提交了有关HyQvia的一份修订版生物制品许可申请(BLA),以便重新启动关于HyQvia治疗原发性免疫缺陷(primary immunodeficiency
生物谷 - 新药,FDA - 2013-12-04
GSK提交药物Promacta的补充新药申请
葛兰素史克(GSK)2月28日宣布,已向FDA提交了药物Promacta(eltrombopag,艾曲波帕)的补充新药申请(sNDA),寻求批准该药用于对免疫抑制疗法(IST)响应不足的重型再生障碍性贫血Promacta sNDA的提交,是基于一项开放标签II期NIH
生物谷 - 新药,FDA - 2014-03-04
武田在日本提交甲吡唑新药申请
武田(Takeda)12月25日宣布,已向日本卫生劳动福利部(MHLW)提交了甲吡唑(fomepizole)的新药申请(NDA),该药用于治疗乙二醇(ethylene glycol)和甲醇(methanol
生物谷 - 新药,FDA - 2013-12-26
赛诺菲计划重新提交单抗药Lemtrada sBLA
赛诺菲(Sanofi)及旗下健赞(Genzyme)4月7日宣布,经过与FDA之间富有建设性的讨论,计划于第二季度重新向FDA提交单抗药物Lemtrada(alemtuzumab,阿伦单抗)的补充生物制品许可申请此次sBLA的提交,将提供对FDA于2013年12月27日完整回应函(CRL)中所指出问题的回复。 去年12月,FDA审查后发现,L
生物谷 - 新药,FDA - 2014-04-08
辉瑞被要求向CDF提交Xalkori的提案
然而,Xalkori(crizotinib)可能会被暂缓执行,但该公司已被要求提交一份纳入癌症药物基金的提案,而不是针对未经治疗的患者。据NICE介绍
MedSci原创 - 辉瑞,Xalkori - 2018-01-17
吉利德提交丙肝新药Ledipasvir/Sofosbuvir新药申请
吉利德(Gilead)2月10日宣布,已向FDA提交了ledipasvir(LDV)+sofosbuvir(SOF)固定剂量组合片剂(LDV/SOF,90mg/400mg)新药申请(NDA),该药开发用于基因型LDV/SOF NDA的提交,
生物谷 - 新药,FDA - 2014-02-13
武田提交糖尿病新药trelagliptin新药申请
武田(Takeda)3月7日宣布,已向日本卫生劳动福利部(MHLW)提交了糖尿病新药trelagliptin succinate(曲格列汀琥珀酸盐,开发代码:SYR-472)的新药申请(NDA),该药开发用于
生物谷 - 新药,FDA - 2014-03-11
阿斯利康$12.6亿痛风药物lesinurad提交欧盟审查
英国制药巨头阿斯利康(AstraZeneca)近日宣布,欧洲药品管理局(EMA)已接受审查痛风药物lesinurad(200mg片剂)的上市许可申请(MAA)。lesinurad是一种选择性尿酸再吸收抑制剂(SURI),能够抑制URAT1转运体增加尿酸排泄从而降低血尿酸(sUA)。目前,阿斯利康正开发lesinurad联合黄嘌呤氧化酶(XO)抑制剂(别嘌呤醇或非布索坦)用于痛风患者高尿酸血症(
生物谷 - 阿斯利康,药物 - 2015-01-23
葛兰素史克提交Albiglutide上市申请
葛兰素史克公司于2013年3月7日表示,已向欧洲药监部门提交了旗下每周注射一次的糖尿病新药Albiglutide的上市申请,力求能在竞争激烈的糖尿病药物市场占有一席之地。
丁香园 - 糖尿病,Albiglutide,GLP-1 - 2013-03-09
QRxPharma公司向FDA再次提交Moxduo新药申请
澳大利亚QRxPharma公司在美国食品药品监督局(FDA)对其新药申请和数据有效性文件进行指导后再次向FDA提出Moxduo的新药申请。 QRxPharma公司的MD兼CEODrJohnHoladay说:“我们有信心我们再次的NDA中的数据文件能够证明我们的产品在呼吸系统安全性,并且我们希望FDA可以考虑到速释型Moxduo作为治疗选择将有利于数百万正在急性痛苦中备受煎熬的病人。我们在与FDA
中国医药保健品进出口商会 - 新药,FDA - 2013-12-17
试验方法提交指南Guidelines For The Submission Of Protocol Of Analysis
Guidelines For The Submission Of Protocol Of Analysis I. General Requirements 1. The Protocol of analysis must&nb
试验方法,提交,指南 - 2010-07-03
为您找到相关结果约500个