FDA 指导文件:治疗严重细菌性疾病的医疗需求未得到满足的患者的抗菌疗法——问答(修订版 1)
美国食品和药物管理局(FDA 或机构)宣布推出题为“治疗严重细菌性疾病的医疗需求未得到满足的患者的抗菌疗法——问答(修订版 1)”的行业指南草案。本指南
FDA官网 - 抗菌疗法,严重细菌性疾病 - 2022-07-09
FDA 行业指南草案:循环肿瘤脱氧核糖核酸在早期实体瘤药物开发中的应用
美国食品和药物管理局(FDA 或机构)宣布推出题为“循环肿瘤 DNA 用于早期实体瘤药物开发”的行业指南草案。本指南草案旨在帮助计划在研究性新药申请 (IND) 下进行的癌症临
FDA官网 - 循环肿瘤脱氧核糖核酸 - 2022-07-08
2024 AGA临床实践指南:选定的胃肠道疾病以粪便微生物群为基础的治疗
本文主要针对上述疗法在选定的胃肠道疾病中的应用提供指导建议,包括成人复发性艰难梭菌感染,重度至暴发性艰难梭菌感染,炎性肠病,包括贮袋炎以及肠易激综合症。
Gastroenterology - 粪便微生物群 - 2024-02-28
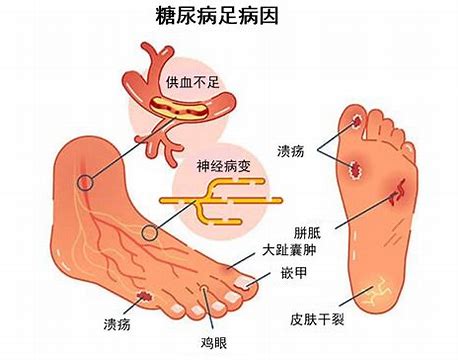
FDA“糖尿病足感染:开发治疗药物的供企业用的指导原则草案”介绍
美国食品药品监督管理局(FDA)于2023年11月发布了“糖尿病足感染:开发治疗药物的供企业用的指导原则(草案)”。该指导原则草案提出了糖尿病足感染治疗药物临床开发的建议,包括
药物评价研究 - 糖尿病足 - 2024-04-07
FDA指南:罕见病:药物和生物制品开发的考虑因素
本指南旨在通过讨论罕见病药物开发中常见的特定问题,帮助用于治疗罕见病的药物和生物制品的申办者开展高效和成功的药物开发项目。
FDA官网 - 罕见病 - 2023-12-26
关于进口药品注册审评审批有关事项的公告(征求意见稿)
依据中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),优化审评审批程序,提高进口药品再注册申请审评审批质量与效率,国家食品药品监督管理总局药
NMPA - 进口药品 - 2022-08-09
FDA治疗严重细菌性疾病的医疗需求未得到满足的患者的抗菌疗法——问答(修订版 1)
美国食品和药物管理局(FDA 或机构)宣布推出题为“治疗严重细菌性疾病的医疗需求未得到满足的患者的抗菌疗法——问答(修订版 1)”的行业指南草案。 本指
FDA - 抗菌药,抗菌药物 - 2022-08-07
FDA进口处方药最终规则问答; 小型实体合规指南
本指南旨在帮助小型实体更好地理解最终规则“处方药进口”,该规则于 2020 年 10 月 1 日发布 (85 FR 62094)。 卫生与公众服务部部长发布了最终规则,以实施《
FDA - 处方药 - 2022-08-08
网络药品经营监督管理办法(征求意见稿)
为贯彻落实《国务院办公厅关于进一步改革完善药品生产流通使用政策的若干意见》(国办发〔2017〕13号),进一步规范网络药品经营,根据《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》及有
药品食品监督局 - 药品经营 - 2022-08-09
FDA行业指南:IND 安全报告的电子提交技术一致性指南
本技术一致性指南(指南)提供了有关如何向药物评估和研究中心 (CDER) 或生物制品评估和研究中心 (CBER) 提交电子研究性新药申请 (IND) 安全报告的规范、建议和一般注意事项 )。 本指南补
FDA - 安全报告 - 2022-08-06
药物临床试验期间安全性数据快速报告标准和程序
为落实原国家食品药品监督管理总局《关于适用国际人用药品注册技术协调会二级指导原则的公告》(2018年第10号),我中心按照ICH技术指导原则要求,组织制定了《药物临床试验期间安全性数据快速报告标准和程
CDE - 指导原则 - 2020-10-03
为您找到相关结果约500个