默沙东Keytruda治疗胃癌获FDA加速批准
9月22日,美国FDA已批准其重磅免疫疗法新药Keytruda用于治疗罹患复发性局部晚期或转移性胃癌/胃食管结合部腺癌,且肿瘤表达PD-L1的患者。这也是在特定的胃癌患者人群中,美国FDA批准的首款抗PD-1疗法。加速批准是该药物基于肿瘤反应率和反应的耐久性数据。
新浪医药 - 胃癌,默沙东,FDA - 2017-09-26
肿瘤筛查用体外诊断试剂临床评价注册审查指导原则(征求意见稿)
我中心组织编制了《肿瘤筛查用体外诊断试剂临床评价注册审查指导原则(征求意见稿)》。
国家药品监督管理局 - 体外诊断试剂 - 2024-01-22
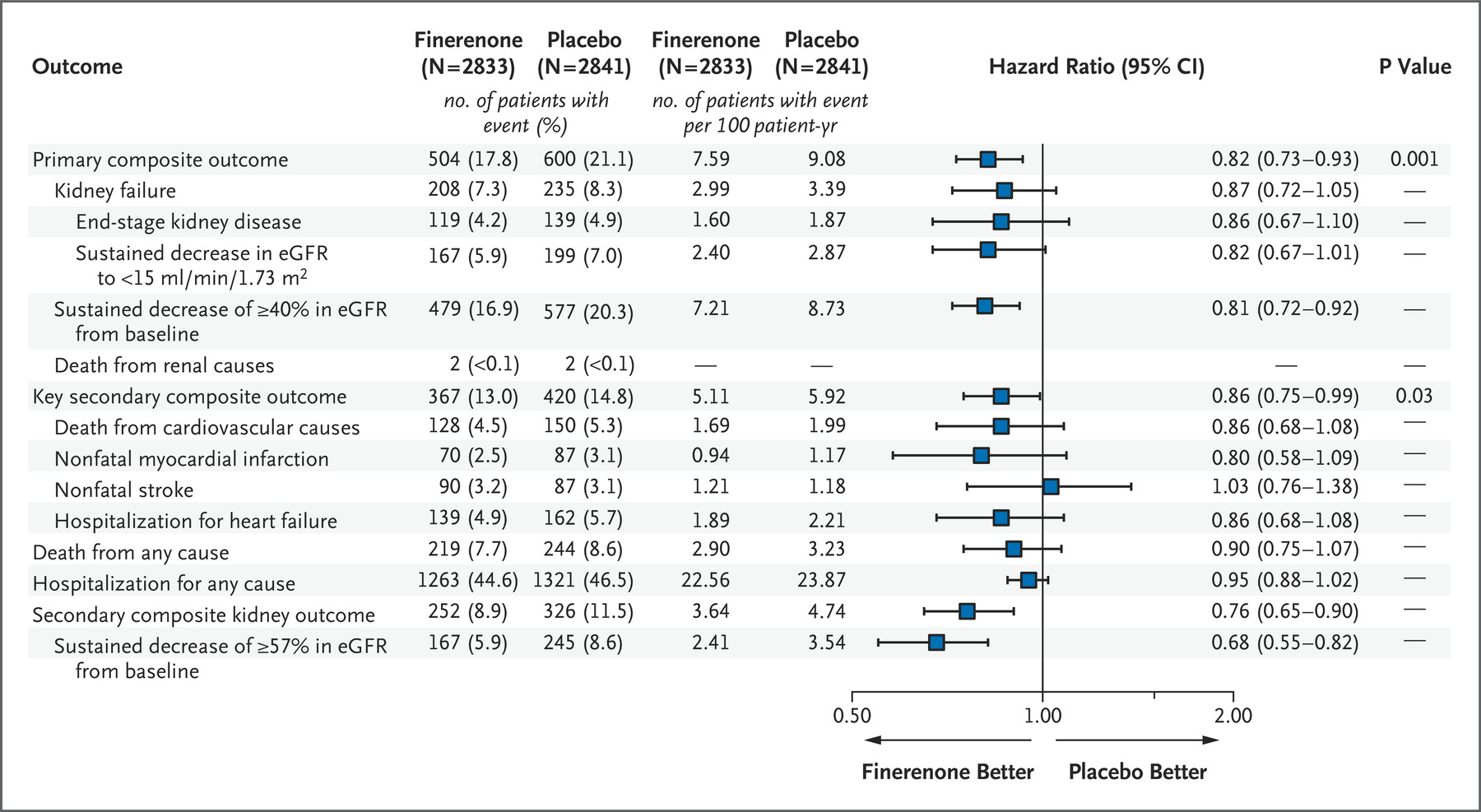
拜耳CKD药物Kerendia获得欧盟批准
拜耳近日宣布,欧盟监管机构已批准 Kerendia (finerenone) 用于治疗患有与 2 型糖尿病相关的慢性肾病(CKD)的成年患者。
MedSci原创 - 慢性肾病,慢性肾病患者,2 型糖尿病,Kerendia - 2022-02-28
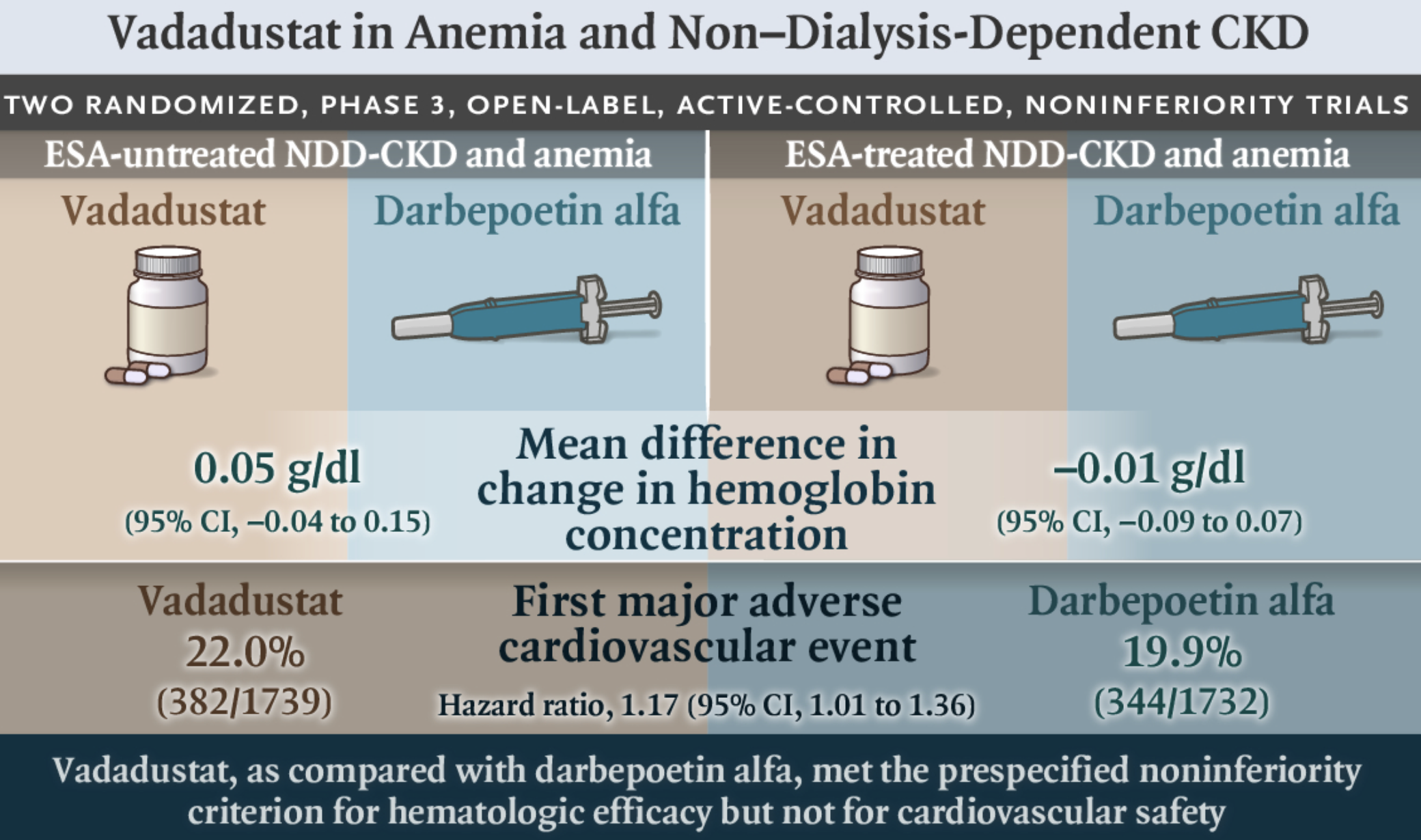
FDA拒绝批准vadadustat治疗CKD相关贫血
研究表明,在非透析依赖患者的主要疗效和安全性终点方面,虽然 vadadustat 在主要疗效目标上取得了成功,但它未能证明在 MACE 方面的非劣效性。
MedSci原创 - vadadustat, CKD 贫血 - 2022-04-03
个性化匹配骨植入物及工具医工交互质控审查指导原则
本文为国家药品监督管理局医疗器械技术审评中心发布的《个性化匹配骨植入物及工具医工交互质控审查指导原则》。
国家药品监督管理局医疗器械技术审评中心 - 植入物 - 2024-05-07
熊思东代表建议:强化中国涉人生物医学研究伦理审查与监督
今年全国两会期间,有“网红校长”之称的全国人大代表、苏州大学校长熊思东提交了《关于强化我国涉人生物医学研究伦理审查与监督的建议》(下称“《建议》”)。
澎湃新闻 - 熊思东,生物医学,伦理审查 - 2019-03-07
2017年FDA批准的41个新药
截止目前,CDER已经批准了41个新分子实体,还有2个药物的PDUFA最后期限落在12月,如12月间FDA不加速批准新药,那么2017年获批的新分子实体可能是41-43个。已经获批的41个产品中,有31个是全球首次批准,19个产品获得了优先
科睿唯安生命科学与制药 - FDA,新药 - 2017-12-06
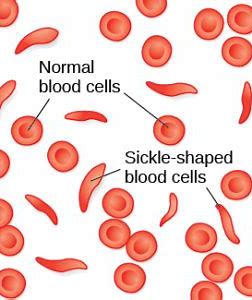
欧洲药品管理局(EMA)开始审查GBT的镰状细胞疗法Oxbryta
Oxbryta(voxelotor)旨在治疗12岁及以上的镰状细胞病(SCD)患者的溶血性贫血。
MedSci原创 - EMA,镰状细胞,镰状细胞贫血,Oxbryta - 2021-01-30
FDA批准了Waylivra用于FDA批准了Waylivra用于家族性高乳糜微粒血症综合征
此外,欧盟和加拿大也正在对Waylivra进行监管审查
MedSci原创 - 家族性高乳糜微粒血症,Waylivra,反义药物 - 2018-05-12
FDA批准的抗癌新药74%没用
近日,美国密尔沃基一本叫做《Sentinel and MedPage Today》的杂志发表一篇文章分析过去10年FDA批准上市的抗癌药,结果发现在54个上市新药中有74%的药物没有证据显示能延长患者寿命
美中药源 - 抗癌新药 - 2014-11-04
2014上半年FDA批准的新药
2014上半年FDA批准了18个新药,相比2013上半年有明显增长。GSK、强生、诺华、礼来、阿斯利康、默沙东等大型药企在今年各有斩获。由于2012年小型制药企业递交新药上市申请的数量激增,FDA的新药批准数量在2012年达到了39个的历史高点。随着2013年FDA批准的新药数量急剧下降至27个,人们也开始对全球新药研发
生物探索 - 新药,FDA - 2014-07-02
FDA批准Kyprolis用于骨髓瘤治疗
FDA已经批准蛋白酶抑制剂carfilzomib(Kyprolis)用于接受过其他疗法但效果不佳的多发性骨髓瘤患者的治疗。批准该药用于至少两种已有疗法(其中之一必须为硼替佐米,Velcade)无效的复发性或难治性骨髓瘤患者的治疗。获得FDA加速审批程序1个月后,carfilzomib在肿瘤药物咨询委员会(ODAC)投票表决中得到了11:0(其中1票弃权)的高度认同,成功获得批准。“Kyprolis
丁香园 - FDA,Kyprolis,骨髓瘤,治疗 - 2012-08-07
FDA批准酶替代药品Ultresa和Viokace
2012年3月2日FDA批准了两种用于治疗胰腺功能缺陷的酶替代新药品。
MedSci原创 - FDA,胰酶,Ultresa,Viokace,胰腺 - 2012-03-04
为您找到相关结果约500个