不得不说的2018年国自然基金(NSFC)申请书提交时间
在填写之前,大家需要了解一下,具体的填写时间和提交时间。
解说国自然 - 2018年,国自然基金,NSFC,申请书,提交时间 - 2018-01-06
AbbVie向美国提交risankizumab
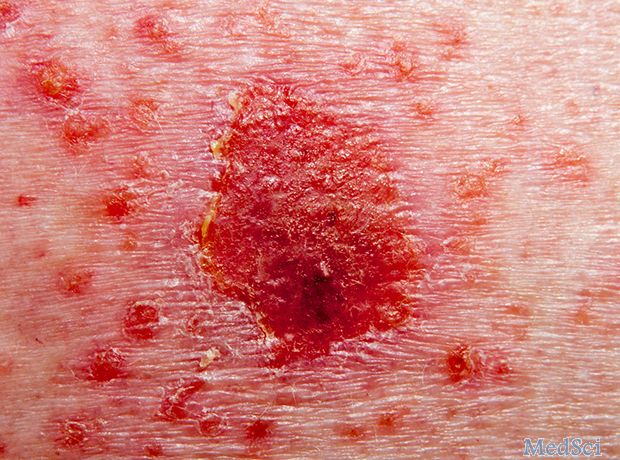
AbbVie已在美国提交risankizumab,寻求批准其用于治疗中度至重度斑块型银屑病。这项提交得到了四项III期研究的支持,涉及2000多名患有该病的患者,数据显示,接受该药物的患者中有一半以上在一年内实现了完全皮肤清除(PASI 100)。AbbVie研发部门首席科学官执行副总裁Michael Severino表示:"risankizumab提交是我们推进免疫介导疾病患者治疗目标的重要里程
MedSci原创 - risankizumab - 2018-04-29
武田在日本提交甲吡唑新药申请
武田(Takeda)12月25日宣布,已向日本卫生劳动福利部(MHLW)提交了甲吡唑(fomepizole)的新药申请(NDA),该药用于治疗乙二醇(ethylene glycol)和甲醇(methanol
生物谷 - 新药,FDA - 2013-12-26
赛诺菲计划重新提交单抗药Lemtrada sBLA
赛诺菲(Sanofi)及旗下健赞(Genzyme)4月7日宣布,经过与FDA之间富有建设性的讨论,计划于第二季度重新向FDA提交单抗药物Lemtrada(alemtuzumab,阿伦单抗)的补充生物制品许可申请此次sBLA的提交,将提供对FDA于2013年12月27日完整回应函(CRL)中所指出问题的回复。 去年12月,FDA审查后发现,L
生物谷 - 新药,FDA - 2014-04-08
GSK提交药物Promacta的补充新药申请
葛兰素史克(GSK)2月28日宣布,已向FDA提交了药物Promacta(eltrombopag,艾曲波帕)的补充新药申请(sNDA),寻求批准该药用于对免疫抑制疗法(IST)响应不足的重型再生障碍性贫血Promacta sNDA的提交,是基于一项开放标签II期NIH
生物谷 - 新药,FDA - 2014-03-04
吉利德提交丙肝新药Ledipasvir/Sofosbuvir新药申请
吉利德(Gilead)2月10日宣布,已向FDA提交了ledipasvir(LDV)+sofosbuvir(SOF)固定剂量组合片剂(LDV/SOF,90mg/400mg)新药申请(NDA),该药开发用于基因型LDV/SOF NDA的提交,
生物谷 - 新药,FDA - 2014-02-13
【FDA指南分享】在上市前通知中提交和审查无菌信息(510(k))标记为无菌的器械提交
本指导文件还提供了有关我们建议申办者在 510(k) 提交中包含的热原性信息的详细信息。
网络 - 2024-01-17
百时美向FDA提交丙肝新药NDA
百时美施贵宝(BMS)4月7日宣布,已向FDA提交了实验性丙肝药物daclatasvir(DCV)和asunaprevir(ASV)的新药申请(NDA),daclatasvir是一种实验性NS5A复制复合物抑制剂
生物谷 - 新药,FDA - 2014-04-08
武田在日本提交TAK-438新药申请
武田(Takeda)3月3日宣布,已向日本劳动卫生福利部(MHLW)提交了实验性胃酸分泌抑制剂TAK-438(通用名:vonoprazan富马酸)的新药申请(NDA),该药属于钾离子(K+)竞争性酸阻滞剂
生物谷 - FDA,武田,TAK-438 - 2014-03-05
日程时间
Chapter 1: 临床心脏病学和高效治疗 Section 1-1:心血管急救及身体检查 Section 1-2:脂代谢紊乱和心脏病治疗—血脂异常和动脉硬化/动脉粥样硬化 Section 1-3:高血压及治疗 Section 1-4-1:心律不齐—心房颤动,心房扑动,心室/室上性心动过速 Section 1-4-2:心律不齐—缓慢性心律失常,心导
会议 - 2010-07-01
会议时间
Schedule IDDST 2009 is comprised of Eight Section s designed to offer comprehensive sessions that address current issues in Drug R&D and innovative therapeutics. You can register a wh
会议 - 2009-09-01
葛兰素史克提交Albiglutide上市申请
葛兰素史克公司于2013年3月7日表示,已向欧洲药监部门提交了旗下每周注射一次的糖尿病新药Albiglutide的上市申请,力求能在竞争激烈的糖尿病药物市场占有一席之地。
丁香园 - 糖尿病,Albiglutide,GLP-1 - 2013-03-09
QRxPharma公司向FDA再次提交Moxduo新药申请
澳大利亚QRxPharma公司在美国食品药品监督局(FDA)对其新药申请和数据有效性文件进行指导后再次向FDA提出Moxduo的新药申请。 QRxPharma公司的MD兼CEODrJohnHoladay说:“我们有信心我们再次的NDA中的数据文件能够证明我们的产品在呼吸系统安全性,并且我们希望FDA可以考虑到速释型Moxduo作为治疗选择将有利于数百万正在急性痛苦中备受煎熬的病人。我们在与FDA
中国医药保健品进出口商会 - 新药,FDA - 2013-12-17
为您找到相关结果约500个