临床急需境外新药上市速度能多快?
5月29日,第二批临床急需境外新药名单正式稿公布,剔除了征求意见稿的5个产品,并新增了1个产品,最终26个产品入围。加上第一批正式稿名单的40个产品,合计两批66个产品入围。
医药经济报 - 临床急需境外新药,审批上市 - 2019-06-17
国家药监局:让群众尽早用上境外上市新药
审批速度明显提高国家药监局药品化妆品注册管理司司长王立丰介绍,目前在我国获批的境外上市药品共3800余个,其中化学药品3400余个、生物制品300余个、中药70余个,基本涵盖了抗癌、抗病毒、抗高血压等主要治疗领域平均每年批准进口药品上市56件,每年递增16%;从临床审批和上市审批的总时限看,我国新药审批法定时限与发达国家接
新华网 - 药监局,境外,新药 - 2018-06-23
加快境外上市新药审评审批获积极进展
党中央、国务院高度重视药品医疗器械审评审批制度改革工作,加快境外上市新药的审评审批是其中重要一环。今年4月、6月,李克强总理先后主持召开国务院常务会议,就加快进口新药上市作出系列重要部署。6月22日,在国务院新闻办召开的国务院政策例行吹风会上(以下简称吹风会),国家药品监督管理局局长焦红介绍,加快境外上市新药审评审批工作取得积极进展,简化境外上市新药审批政策效果初步显现。
中国医药报 - 境外上市新药,审评审批 - 2018-06-25
这13款临床急需境外新药,有望年内上市
自2018年中国国家药监局(NMPA)发布《临床急需境外新药审评审批工作程序》以来,共计81个药品先后被纳入三批《临床急需境外新药名单》,其中名单中的一批新药已在中国进入3期临床或者递交新药上市申请阶
医谷网 - 境外新药,年内上市,欧洲批准上市 - 2021-03-07
境外抗癌新药审批提速 促境内同步上市
新华社北京2月11日电 国务院总理李克强2月11日主持召开国务院常务会议,听取2018年全国两会建议提案办理工作汇报,推进提升政府施政水平;要求狠抓今年脱贫攻坚任务落实,为打赢脱贫攻坚战奠定坚实基础;部署加强癌症早诊早治和用药保障的措施,决定对罕见病药品给予增值税优惠;决定支持商业银行多渠道补充资本金,增强金融服务实体经济和防风险能力。
中国妇女报 - 境外,抗癌新药,境内同步 - 2019-02-13
CFDA:加速境外新药国内上市,化药注册检验调整为监督抽样
记者了解到,近年来我国在加快境外上市新药审评审批方面做了大量工作。数据显示,近十年来,在美国、欧盟、日本上市的新药共有415个,277个已经在中国上市和正在进入申报和临床试验阶段。其中,76个已经在中国上市,201个目前处在中国的临床试验和申报阶段。 从临床审批和上市审批的总时限看,我国为390天,美国为330天,欧盟为270天,日本为330天
MedSci原创 - 新药,化药 - 2018-06-23
中国将针对48个境外已上市的临床亟需新药进行优先审批
为了加速新药进入中国市场,中国刚刚提出了48个境外已上市临床亟需新药名单,经申请人证明不存在人种差异的药物,可通过境外试验数据申请中国批准。
MedSci原创 - 中国,加速审批,临床亟需新药 - 2018-08-12
中国拟有条件接受境外临床试验数据,新药上市不再“慢半拍”
10月20日,国家食药监总局药审中心发布关于《接受境外临床试验数据的技术要求》征求意见稿(下称“征求意见稿”),称将有条件接受境外临床试验数据。
澎湃新闻 - 境外临床实验数据,药品注册,国家食药监总局 - 2017-10-24
境外上市能解互联网医疗健康的“阵痛”?
近期据媒体披露,互联网医药O2O平台叮当快药遭遇成本加大、门店多次迁址的困扰,其中旗下北京一门店被传出“悄然搬迁”;而另一边,前日晚间广东互联网健康医疗平台健客宣布完成B轮1.3亿美元融资,并拟明年赴美国上市在互联网+医疗健康领域,相关企业赴境外资本市场上市似乎成可缓解“阵痛”的目标,但有分析人士认为,受互联网+医疗健康企业盈利模式不明确以及相关中概股数
南方都市报 - 互联网医疗 - 2018-09-06
重磅 | 中国药监局承认境外临床数据,加速境外药品在国内上市(附新规全文)
长期以来,中国政府一直致力于加速改革药品与医疗器械审批速度,如今,这一的努力迎来重大进展。
商业周刊中文版 - 中国药监局,境外临床数据,政策 - 2018-07-12
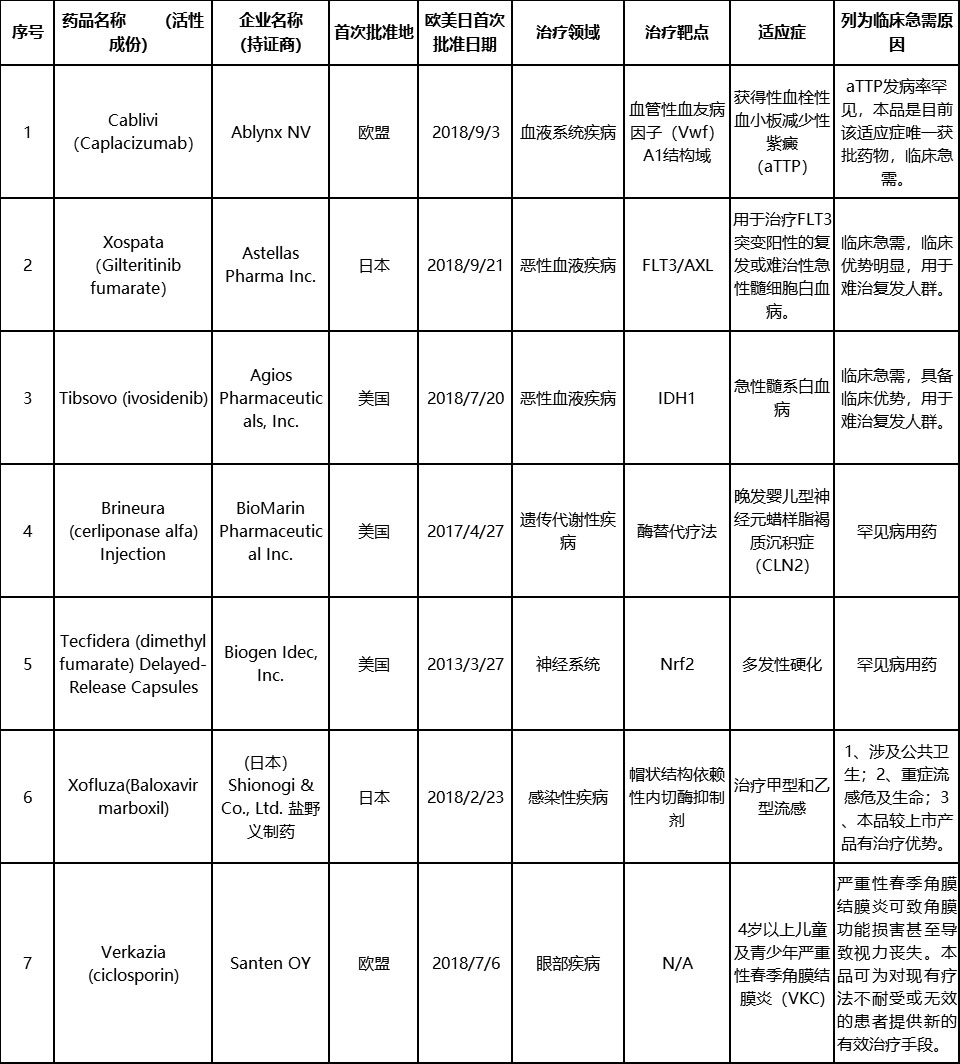
第三批临床急需境外新药名单公布
国家药品监督管理局药品审评中心(CDE)官网正式公布了第三批临床急需境外新药的名单,此次名单共纳入了7急需境外新药,针对的适应症包括获得性血栓性血小板减少性紫癜(aTTP)、急性髓系白血病、晚发婴儿型
医谷网 - 新药 - 2020-10-29
境外已上市境内未上市药品临床技术要求
境外已上市药品境内上市或仿制,是解决我国患者对临床迫切需求领域药品的可获得性和可及性的重要手段。为加快此类药品研发上市进程,加强科学监管,依据《药品注册管理办法》(总局令第27号)及其配套文件,药审中
CDE - 药品 - 2021-06-27
境外已上市境内未上市化学药品药学研究与评价技术要求(试行)
为进一步指导企业开展药品研发,加快境外已上市境内未上市化学药品研发上市进程,提供可参考的技术标准。在国家药品监督管理局的部署下,药审中心组织制定了《境外已上市境内未上市化学药品药学研究与评价技术要求(
CDE - 化学药品 - 2021-05-13
境外已上市境内未上市经口吸入制剂仿制药临床试验技术指导原则(试行)
为进一步引导经口吸入制剂仿制药产品科学合理开发,在国家药品监督管理局的部署下,药审中心组织制定了《境外已上市境内未上市经口吸入制剂仿制药临床试验技术指导原则(试行)》(见附件)。根据《国家药监局综合司
CDE - 仿制药 - 2021-11-19
为您找到相关结果约500个