AML的维持治疗
过去十年急性髓系白血病 (AML) 的药物开发取得了稳步进展,已逐步转向基于基因组学的治疗,AML的结局也有所改善,但仍远未令人满意。预防 AML 复发的方法之一是在患者达到缓解后给予维持治疗,包括HSCT 后也需要维持治疗,以减少高危亚组的复发。在过去的30年里,AML的维持治疗已从使用化疗药物发展到更多的靶向治疗和更好的免疫系统调节,但临床试验中这些药物对生存结局的改善并不一致。
为了从维持治疗中获得最佳获益,需要确定开始维持治疗的时间点,且治疗必须在基于AML 遗传学和风险分层、既往治疗暴露、移植资格、预期毒性和患者临床特征和倾向方面精确选择。AML的深远目标是促进缓解期患者达到正常的生活质量,同时改善缓解持续时间和总生存期。口服阿扎胞苷的QUAZAR研究获得成功,朝着易于给药的安全维持药物迈出可喜一步,但也留下了许多悬而未决的问题供讨论。
近日《Haematologica》发表的一篇综述中,作者通过探索 AML 维持治疗的需求、仅30年临床试验的结果以及维持治疗在现代 AML 治疗中的意义,讨论AML维持治疗的进展和争议。现整理主要内容供各位老师参考。

随着 AML 治疗的逐步细化,应根据维持治疗强度、治疗方案中使用的时间点和疾病控制状态来进行定义,通常为在达到至少形态学疾病控制后相对较长的持续时间内给予的低强度治疗。
过去几年的治疗策略,尤其是在老年 AML 患者中,已逐渐演变为几种有效的低强度治疗方案。由于这些方案的数据逐步获得关注,它们可能甚至可能在相对年轻的患者中进行诱导和巩固,因此不能仅使用治疗强度来定义维持治疗方案。接受低强度方案多个周期的患者,多会在获得缓解后继续相同的方案,但通常以逐渐减少的剂量给药,直至疾病进展或毒性;那么在使用相同药物时,治疗周期从“巩固治疗”转变为“维持治疗”的时间点是什么?AML 的既往维持治疗试验均包括不同于初始 AML 治疗(通常为常规化疗药物)的药物,其区别非常明确,而最近的试验和维持治疗概念,尤其是低强度 AML 治疗,通常使用相同的减毒剂量方案,导致了差异不甚明显。
对着在 AML 中进行 MRD 评估愈发普遍,是否将维持治疗视为在达到 MRD 阴性缓解后接受的治疗,或在持续 MRD 的情况下(即所谓的“MRD根除”)?然而随着强化和非强化治疗方案有效性的增加,在诱导缓解后进行维持前巩固治疗之前,通常会先出现 MRD 阴性状态,因此MRD阴性状态后的治疗不能被普遍视为维持治疗。ELN 2021 共识声明建议,理想情况下,MRD(骨髓)评估应在巩固治疗后进行,还定义了 MRD 阴性和 MRD 复发的不同检测(使用聚合酶链或二代测序的流式细胞术或分子学方法)的临界值。协调MRD 时间点对于选择后续治疗策略很重要,但大多数建议都是针对HSCT 巩固的需求,而在持续低水平 MRD 或 MRD 复发患者中是否使用维持疗法根除 MRD 的问题仍未得到解答。在 MRD 阳性缓解患者中维持治疗的概念,可能包括 MRD 根除或从 MRD 阳性至阴性状态的“转换”。
因此,在缺乏临床试验中使用的开始维持治疗时间点的情况下,临床实践中维持治疗的定义是可变的,通常基于临床背景和医生得出,这在很大程度上取决于基线 AML 基因组学、获得的缓解程度和进行后续 HSCT 的可能性。更好地定义这些时间点对于更好地理解临床试验以及回顾性数据管理中维持治疗的真实获益非常重要。对此可能需要考虑的因素包括:
•在强化治疗背景下,维持治疗可能包括在巩固治疗后作为重复低强度治疗给药的治疗,且具有不可检测/稳定的低水平 MRD(例如核心结合因子 [CBF]AML在氟达拉滨、阿糖胞苷、g-CSF为基础的治疗后给予地西他滨维持治疗)
•对于低强度诱导方案,维持治疗可能包括在达到 MRD 阴性状态后给予的治疗,或如果使用相同的药物,则维持治疗包括在初始治疗后药物剂量(剂量/持续时间)减少至少50%并获得稳定低水平MRD,或如果治疗改变/减量至更有针对性的方案则维持治疗可以是任何剂量(例如在 Aza-Ven 诱导后低 Aza-Ven 剂量维持治疗;在阿扎胞苷-维奈克拉-吉瑞替尼诱导后吉瑞替尼维持治疗)
•ASCT后开始的治疗,不考虑 MRD 状态(例如ASCT后索拉非尼或阿扎胞苷维持治疗)
所有 AML 患者均易复发。虽然使用更复杂的检测方法可检测到更深缓解,但低于检测限 (LOD) 的有害残留疾病(通常在白血病干细胞水平)仍可导致疾病复发(图1)。
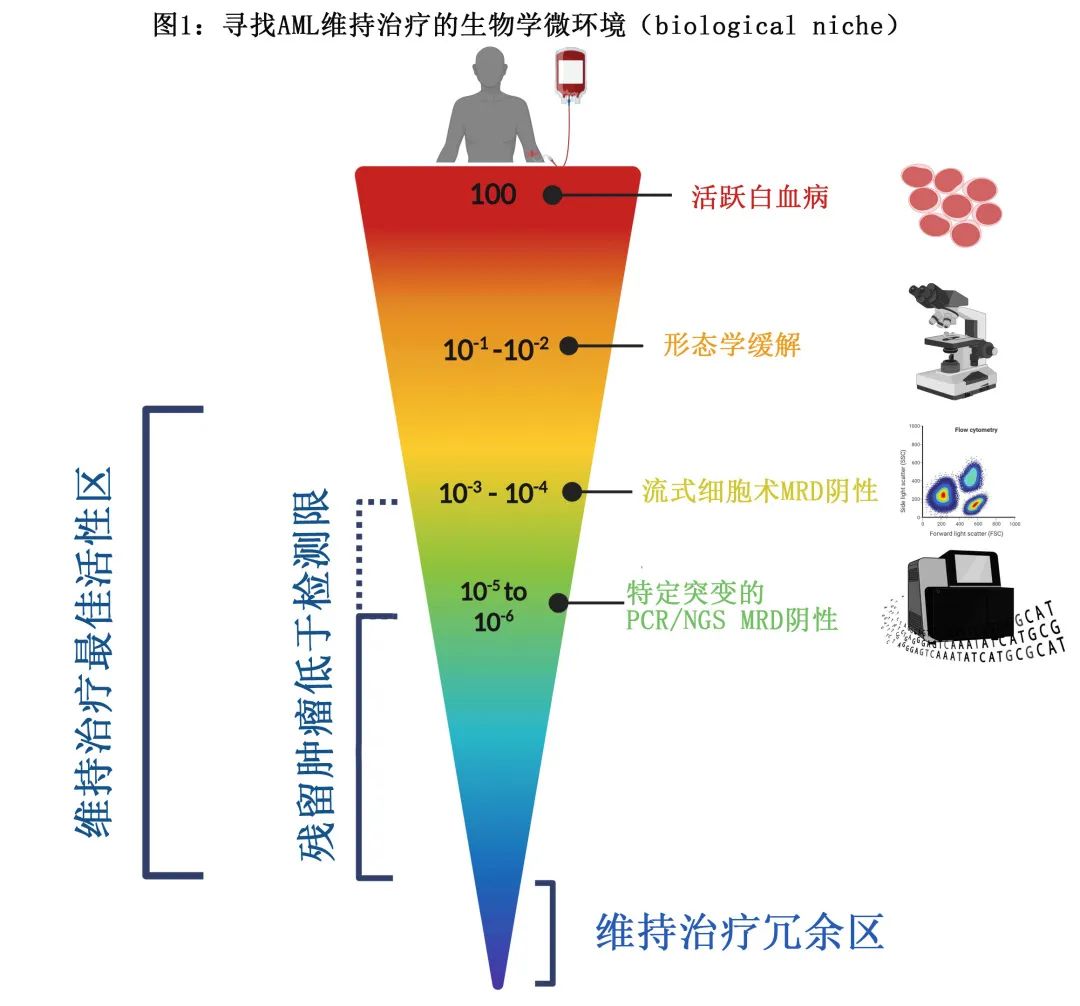
维持治疗的目的是防止克隆演变和生长,同时免疫系统能够克服残留白血病细胞负荷。在常规化疗时代,I-C周期的进一步强化通常未线性改善生存期,在非预后良好 AML 患者中强化治疗后HSCT具有更好的长期生存期。这一时期的大多数维持治疗研究未显示 OS 的任何改善,且通常无法证明复发/白血病/无疾病生存期的获益,可能是由于与标准细胞毒性化疗相比,缺乏具有不同作用机制的高效、耐受性良好的药物。
通过合理的联合治疗方案再加上新药,现在已能够达到更高和更深的缓解率,那么在这种缓解深度下维持治疗的真正获益是否明显?来自 UK NCRI AML 16 研究的结果显示,在强化化疗后达到 CR 的老年 AML 患者(>60岁)中,阿扎胞苷维持治疗仅改善了 MRD 阴性患者 (10-4) 的5年 OS (40% vs 13%),但未改善 MRD 阳性患者 (20% vs 23%)。随机 HOVON97 研究在新诊断 (ND)AML 老年患者(≥60岁)中比较了强化化疗后阿扎胞苷维持治疗与观察,结果治疗组的12个月 DFS 优于观察组 (64% vs. 42%),但在使用基线疾病风险的多变量至事件时间回归分析中,CR 或 CRi等作为变量,仅维持治疗开始时血小板≥100 × 109/L(相当于CR)是 DFS 改善的显著因素。尽管本研究未获得 MRD 数据,但 CR 可能反映了疾病控制状态优于CRi,再次强调了既往疾病控制较好的患者可能累积肠外阿扎胞苷维持治疗的实际获益。在具有里程碑意义的 QUAZAR 研究中,治疗 (CC-486) 组显示整个人群的 OS 统计学显著改善(24.7 vs. 14.8个月);但在探索性分析中,与阴性组相比,MRD阳性亚组中 CC-486 相对于观察组的2年 OS 获益显著,虽然 CR 患者的改善仍比 CRi 患者更显著。因此需要根据 AML 维持治疗时的疾病状态、基因组学和既往治疗暴露对患者开展分层的随机试验,以了解预期维持治疗效果最佳的人群。
最后,尚不清楚维持治疗是否会降低复发时挽救治疗的疗效,可能取决于使用的治疗方案类型;如果确实如此,则通过维持治疗改善首次缓解的持续时间可能不会带来 OS 获益(图2)。这还需要通过试验,纳入维持治疗持续较长时间后复发患者对挽救治疗方案的反应,进行更多探索。


首先,理想的维持治疗方案应抑制复发倾向残留白血病细胞的演变,但不应导致额外的治疗相关基因组不稳定性。其次,该方案不应给患者带来显著的额外毒性负担,包括增加感染风险、需要反复输血和总体生活质量差,这是极其重要的,因为这些方案是用于已经处于缓解期的患者(通常血细胞计数良好)。尽管 HMA 作为维持治疗具有一般安全性,但其仍可引起血细胞减少,从而增加感染风险和输血需求,尤其是与维奈克拉等药物联合使用时。免疫调节剂(如来那度胺)用作 ASCT 后的维持治疗时可显著增加移植物抗宿主病 (GVHD) 的风险,而免疫检查点抑制剂 (ICI) 也可导致免疫毒性,如自身免疫性肝炎和结肠炎。第三,该方案应易于给药,需要的监测和医院随访较少。此外HSCT后的维持治疗方案不应增加 GVHD 风险、对抗重要的 GVL 效应、引起移植物抑制或干扰移植后免疫抑制剂。
尽管针对可靶向突变(尤其是在维持治疗开始时持续存在的突变)的单药治疗似乎是最适合的选择(例如FLT3/IDH抑制剂),但在治疗压力下它们可增加克隆逃逸和复发的风险。考虑到 AML 亚克隆异质性,HMA联合维奈克拉或其他靶向药物等可能是更好的维持治疗选择,因其具有更广泛的作用机制。目前尚无对比数据,但评估和比较这些方案作为维持治疗的效力和毒性非常重要。对于没有可靶向突变或已知突变本身会导致复发(例如FLT3-ITD)的患者,做出选择更容易一些。
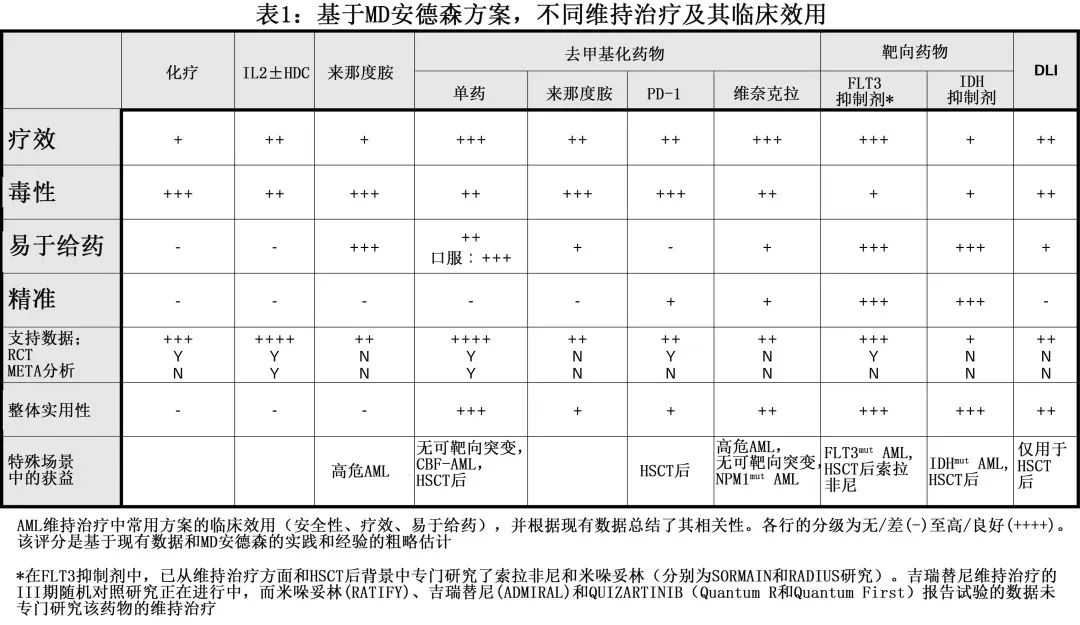
AML 维持治疗的临床开发历程经历了白细胞介素、干扰素(和 HSCT 后供者淋巴细胞输注)、免疫调节剂(如来那度胺)、低强度化疗、HMA、靶向治疗或过继性细胞治疗(表1)。具体研究数据不做罗列,如需原文请联系微信zhaolongfei169。
对于AML 患者,除了巩固治疗以外,缓解后治疗也变得越来越重要,但与 ALL 和 APL 不同,各维持治疗在 AML 中的成功率有所差异。鉴于 AML 的生物学异质性,维持治疗的选择很应基于患者的 AML 基因组学、缓解状态和移植资格,并考虑额外毒性负担、医院随访和患者生活质量方设计维持治疗。
MD安德森癌症中心正在进行的一项研究使用上述因素,并使用基因组学方法研究 AML 口服维持治疗的不同组合 (NCT05010772)。在这5个平行组的研究中,首次缓解且不适合立即HSCT的成人AML患者接受维持治疗最多治疗24个周期,包括:口服地西他滨单药治疗,或口服地西他滨联合维奈克拉,或口服地西他滨联合基因组学确定的其他药物(吉瑞替尼、enasidenib或艾伏尼布)。
MD安德森癌症中心目前提倡对所有 AML 患者进行维持治疗。对于CBF-AML 患者,如果患者无法完成指定周期的氟达拉滨、阿糖胞苷、G-CSF和 GO i-C 治疗方案,或在充分巩固治疗后出现持续性分子学 MRD,建议给予胃肠外地西他滨治疗。对于中危和高危 AML 患者,HSCT是首选的巩固治疗,随后是适当的维持治疗。对于无法进行 HSCT 的患者,在无靶向髓系突变的情况下,提倡联合使用HMA +/-维奈克拉。对于携带可靶向突变(如 FLT3 或IDH)的患者,在通过强化/低强度方案诱导缓解后,继续使用相应的抑制剂(作为单药治疗或与 HMA 联合治疗)作为维持治疗。维持治疗的持续时间各不相同,具体取决于患者耐受性和血细胞计数恢复情况、基线 AML 基因组学、MRD动力学和后续 HSCT 的可能性。
在过去的25年里,AML的维持方案已经从低强度化疗发展到使用更多的靶向治疗以及免疫治疗,但对于接受充分一线治疗和处于深度缓解状态的患者,是否有某个方案可真正改善OS,还需要更好的研究。在高危疾病(复杂核型、TP53突变、复发性/难治性疾病、HSCT时/后 MRD 阳性)患者中,大多数医生偏好维持治疗,这几乎没有争议;但维持治疗在预后不良风险较低的 AML 中是否有益,可能还需要进行中的研究给予确定。在设计维持治疗方案时,还必须牢记在维持治疗压力下,恶化基因组不稳定和克隆逃逸的可能性。
参考文献
Jayastu Senapati,et al. Maintenance therapy in acute myeloid leukemia: advances and controversies.Haematologica . 2023 May 4. doi: 10.3324/haematol.2022.281810.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言