Circulation报道右心室肌节收缩抑制和粗丝激活在心力衰竭合并肺动脉高压中的作用
2023-06-06 刘少飞 MedSci原创 发表于上海
这项研究的临床意义在于提供了关于肺动脉高压患者右心室肌节功能损害的新见解。
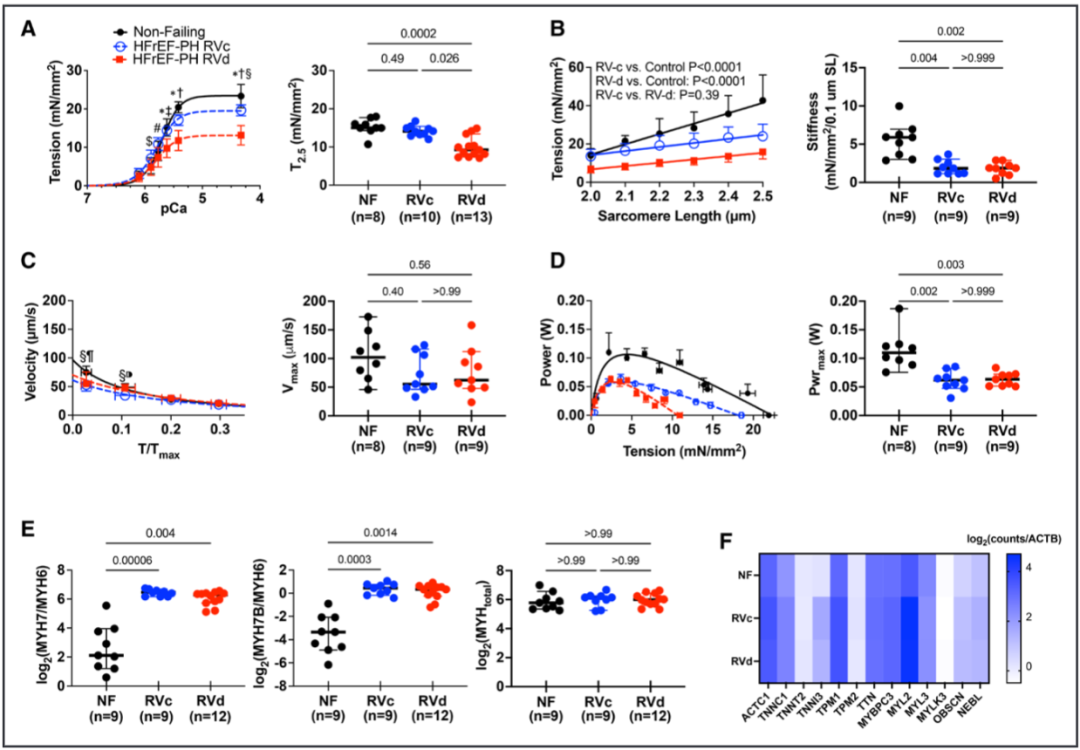
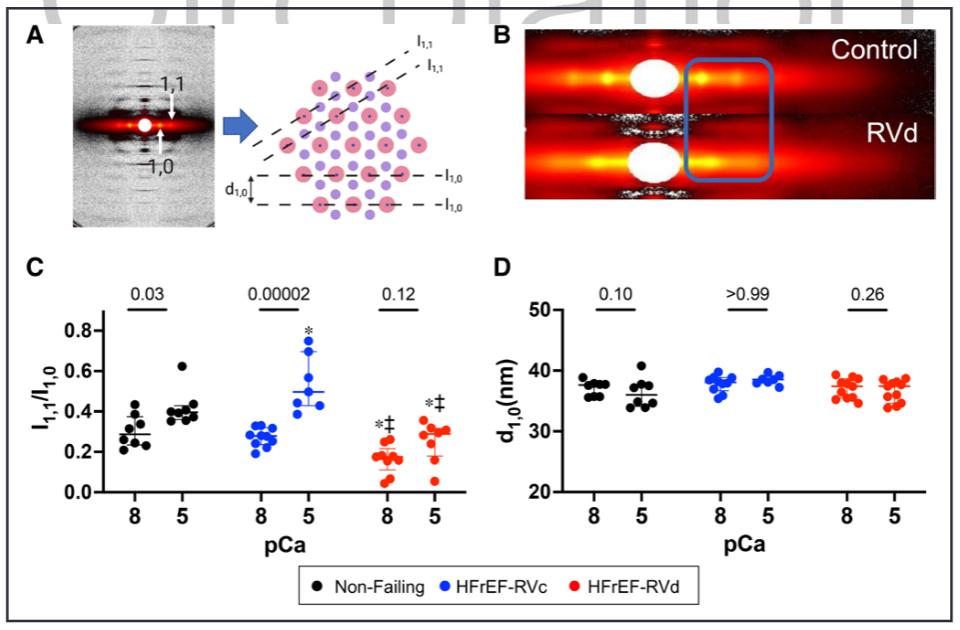
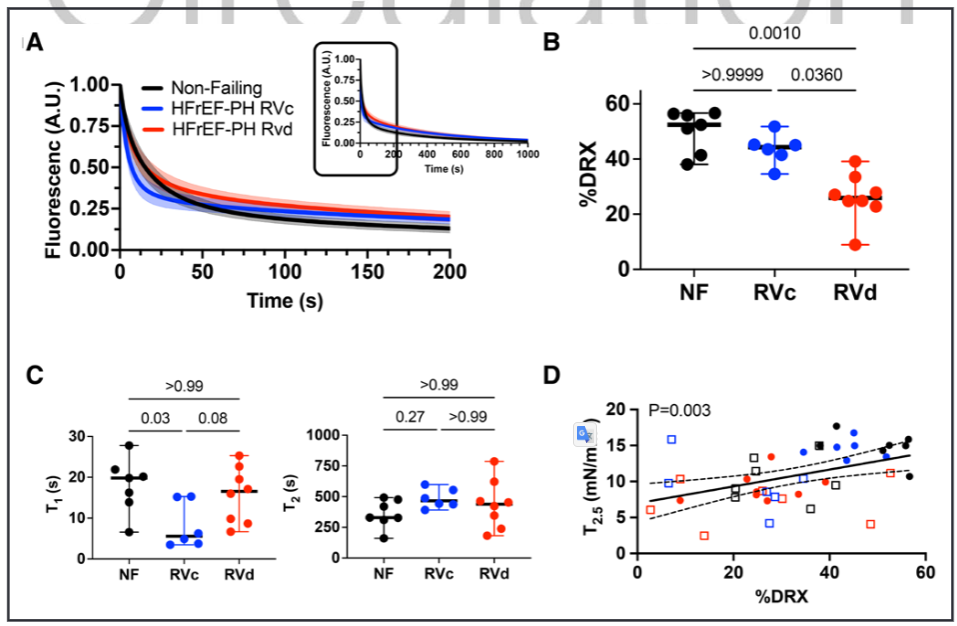
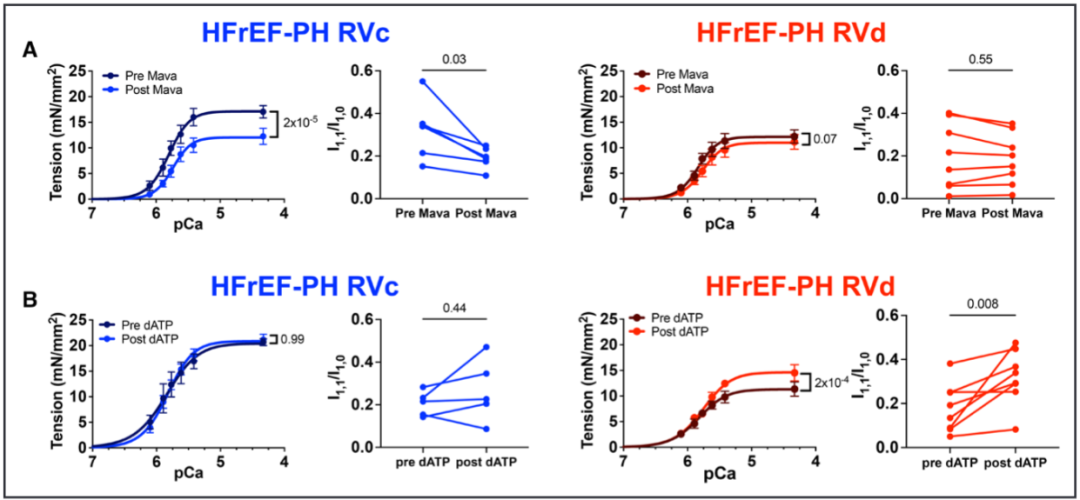
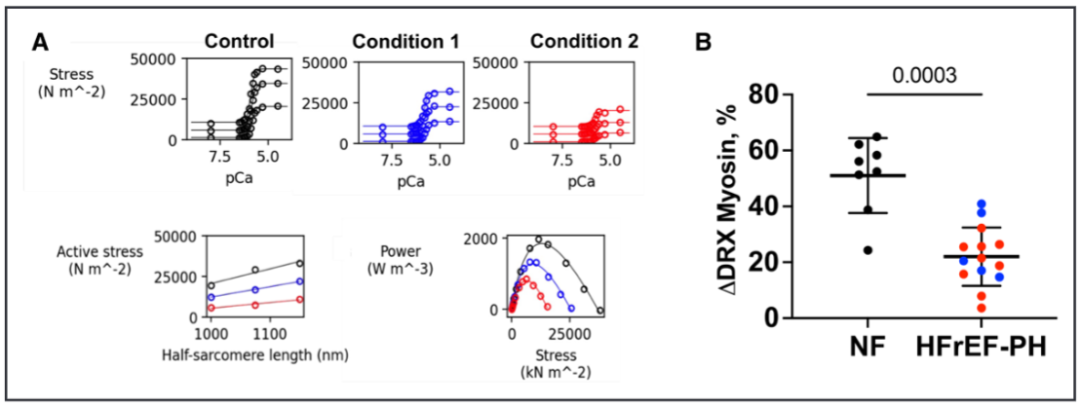
三分之一因伴左心室射血分数降低的心力衰竭相关的肺动脉高压(HFrEF-PH)患者会发展为右心室(RV)衰竭。然而,我们识别RV功能障碍的能力仍然不足,因为许多患者直到RV衰竭太严重才被发现。此外,这种功能障碍通常不会被标准的临床RV指数检测到。因此,该研究试图描述HFrEF-PH中RV肌细胞收缩抑制的特征,确定临床RV指数反映的哪些成分,并揭示潜在的生物物理机制。 之前的研究发现,潜在的机制包括肌动蛋白-肌球蛋白横桥动力学、肌节蛋白化学计量学、粗丝结构及其对舒张期拉伸和负荷的反应(即长度依赖性激活),以及可用于产生力的肌球蛋白头的数量。最后一个被认为随着肌球蛋白头的比例而变化,肌球蛋白头处于称为无序松弛(DRX)状态的跨桥准备状态与不能形成跨桥的超松弛(SRX)状态。 确定哪些肌丝依赖性机制导致HfrEF-PH中RV收缩力降低变得越来越重要,因为目前正在开发和测试用于人类心力衰竭的刺激其功能的药物。这些药物被称为肌收缩药,可调节肌节蛋白以增强收缩力,而不会引起有害的钙介导的代谢和心律失常成本,如蛋白激酶A刺激性强心剂所发现的那样。它们各自具有不同的生物物理效应,因此在不知道潜在的肌细胞缺陷的情况下最佳地利用它们的影响是具有挑战性的。 本研究检测了RV肌细胞收缩力的重要特征,实际上并未由RV功能的标准临床参数反映的假设。确定哪些是开发更好、更有针对性的治疗方法的核心,哪些不是核心。其次,研究确定了hFrEF-PH中RV收缩缺陷的生物物理原因,重点关注肌原纤维结构的作用、粗丝激活和DRX/SRX比率的控制。这些研究是在从hFrEF-PH患者与供体对照的RV心肌分离的透化肌细胞和肌条中进行的。 令人惊讶的是,该研究发现在反映肌细胞收缩力降低的多个特征中,只有钙刺激的等长张力反映在临床指标定义的更抑郁的 RV 室功能障碍中。较低的峰值钙激活张力与较低百分比的 DRX 肌球蛋白相关,减少了肌球蛋白头与肌动蛋白的关联,并且在较高的肌节长度(SL)下DRX肌球蛋白的募集较少。这些数据为hFrEF-PH中的RV心肌缺陷、它们与临床指标的关系以及DRX/SRX肌球蛋白比率在该过程中所起的作用提供了新的见解。 这项研究使用了心脏组织样本和分子生物学技术,通过分析肌肉蛋白和收缩相关基因表达来评估肌肉收缩功能。 基于心肌细胞力学的HFrEF-PH亚群鉴定 基于肌细胞机械测量生成HFrEF-PH子组的管道。研究队列的规模有限,需要减少用于模型训练的特征数量。因此,研究团队构建了算法以包括HFrEF-PH与对照肌细胞相比变异系数至少高50%的机械特征,假设这些是编码区分亚组所需的最多信息的特征。 图 1. 无监督机器学习识别 HFrEF-PH 中心肌细胞功能的 2 个亚组。 等距Ca2+-激活张力区分HFrEF-PH亚群 不论是右心室压力过载(RVc)还是右心室容量过载(RVd)亚组,在心肌收缩能力的主要指标方面表现相似。其中之一是钙激活张力-长度关系的斜率,它是心肌水平上与心腔舒张末期刚度(如弹性)相关的指标。两组的斜率均降低,尽管与RVc亚组不同,RVd亚组的关系进一步向下偏移,与该组在2.5μM钙离子浓度下的张力(T2.5)较低一致。 此外,最大功率和峰值功率时的张力,即心肌收缩功能的主要指标,在两组中均显著降低;与非衰竭组相比,最大无负荷缩短速度在任何一组中都没有降低。交联桥形成的动力学指标,包括ktr,在任何组之间都没有显著差异。值得注意的是,心肌细胞的横截面积和长度在各组之间相似,因此细胞几何形态并不是这些结果的显著影响因素。 图 2. 等长张力,而不是心肌细胞收缩力的其他测量值,与RV功能的临床指标相关 HFrEF-PH亚组显示不同的肌丝结构 为了确定RVd心肌是否具有较少功能可用于产生力量的肌球蛋白头部,研究人员从离体脱膜RV肌条中获取了小角度X射线衍射图案。在收缩期,I1,1/I1,0与形成的肌动蛋白交联桥的数量和随后的力量发展相关。在放松条件下,减少的I1,1/I1,0表示肌球蛋白头部与细丝之间的结合减少,并且更多肌球蛋白头部与粗丝骨架相关。这反映了粗丝的失活和肌球蛋白可用性降低,用于产生力量。在放松状态下,HFrEF-PH的RVd组中的I1,1/I1,0明显降低。除了钙结合到肌钙蛋白以激活收缩外,钙依赖的粗丝结构激活也已被报道。当Ca2+浓度增加时,对照组和RVc组的I1,1/I1,0比值增加,但RVd组没有这种变化。综上所述,这些数据支持HFrEF-PH RVd患者中可用肌球蛋白头部数量的减少(较低的NA)作为降低肌细胞力量(张力)的主要机制。它们还表明,钙依赖的粗丝激活在钙刺激的等长张力降低的患者中受损。 图 3. HFrEF-PH RVd 患者的粗丝失活。 DRX肌球蛋白的比例在T2.5降低的HFrEF-PH组中最低 2个HFrEF-PH组之间I1,1/I1,0的差异可能转化为处于DRX状态的肌球蛋白头比例的差异。这是通过使用荧光mant-ATP在皮肤RV心肌细胞。mant-ATP信号衰减适合双指数衰减,SRX 肌球蛋白通过初始快速衰减 (T1) 后的二次较慢荧光衰减 (T2) 识别。T1 被认为与急性ATP酶、非特异性结合核苷酸的释放以及核苷酸从细胞中扩散有关。因此,SRX和DRX肌球蛋白的比例是从缓慢阶段量化的,在放松条件下,被认为加起来达到100%。在RVd 中,mant-ATP测定中较大比例的荧光衰减发生在缓慢的晚期阶段,表明%DRX减少。相反,RVc中的%DRX与对照相似。T1和T2衰减常数在RVd和对照中相似,而T1在RVc和对照中较低。最后,研究发现%DRX与T2.5直接相关,进一步支持它们的关联。 图 4. HFrEF-PH RVd 患者的无序松弛 (DRX) 肌球蛋白比例降低。 %DRX的变化不同地改变了HFrEF-PH亚组中的等距主动张力 为了进一步探索%DRX和等距Ca2+依赖性张力之间的关系,将肌细胞暴露于减少%DRX的肌球蛋白抑制剂 (mavacamten) 或增加它的dATP。在RVc肌细胞中,mavacamten在很宽的范围内降低了Ca2+-张力依赖性,而这种效果在RVd肌细胞中要小得多。右边是I1,1/I1,0比值,通过X 射线衍射测量来自同一患者的心肌 (± mava-camten),显示RVc比值减少,但RVd肌细胞没有。使用增加%DRX的dATP获得了相反的响应;RVc肌细胞中Ca2+激活的张力或I1,1/I1,0比率几乎没有变化,但RVd 中两者都有显着增加。这些数据表明,基线时DRX肌球蛋白较少的肌细胞对增加它的药物的反应比接近正常的肌细胞(RVc)的反应更大,而增加 %DRX 的药物影响更大。 图 5. HFrEF-PH RVc 和 RVd 中 DRX 肌球蛋白比例的药理学操作。 %DRX肌球蛋白的肌细胞长度依赖性张力和应变依赖性 为了确定降低肌细胞长度依赖性张力的机制,研究使用了基于开源程序FiberSim的空间明确的半肌节模型,该模型假定粗丝激活的3态动力学模型。测试了另外两个条件;两者都阻止了将 SRX负责招募到DRX,其中一个进一步增加了SRX的百分比。最后一个条件最好地复制了实验观察到的张力-钙、张力-长度和张力-功率/速度关系,表明需要更大的%SRX和受损的SRX到 DRX过渡。为了测试后者,在增加SL之前和之后通过mant-ATP测定确定DRX/SRX平衡。当在放松条件下从2.1 μm SL拉伸到2.4 μm SL时,对照心肌细胞显示%DRX增加51%,但这在来自HFrEF-PH亚组的肌细胞中显着降低(22%)。这些数据提供了一种抑制肌细胞活性刚度的新机制,表明DRX肌球蛋白的应变依赖性募集减少发挥了作用。 图 6。两个HFrEF-PH亚组中的灭活肌球蛋白对长度介导的募集不那么敏感。 研究结果显示,在心力衰竭伴随肺动脉高压的患者中,右心室心肌出现了肌节段收缩力减退的异常。具体来说,与正常心脏组织相比,患者的右心室心肌细胞长度缩短,肌节段收缩力下降。此外,研究还发现,在肺动脉高压患者中,心肌中的厚丝蛋白激活过程受到损害,导致收缩功能的进一步受损。这些结果表明,在心力衰竭伴随肺动脉高压的患者中,右心室心肌收缩功能异常,存在肌节段收缩力减退和厚丝蛋白激活的缺陷。 这些发现对于我们理解心力衰竭伴随肺动脉高压的病理生理机制具有重要意义,有助于为相关疾病的治疗提供新的靶点和策略。进一步的研究可以探索这些异常的具体机制,并开发针对心力衰竭伴随肺动脉高压的新治疗方法。 确定HFrEF-PH心肌中存在的哪些基本RV肌细胞机械异常反映在RV功能的标准临床指标中。研究惊讶地发现只有等长钙刺激的主动张力和%DRX肌球蛋白的相关缺陷与这些患者的临床RV功能指数相关。此外,粗丝的钙依赖性激活也仅在等长主动张力降低的患者中受损。其他主要的机械缺陷,包括最大功率降低、肌细胞活性刚度、肌球蛋白异构体转换和长度介导的%DRX增加,在HFrEF-PH患者中更常见。 确定HFrEF-PH中发现的异常RV肌细胞收缩行为的生物物理机制。研究揭示了抑制的钙刺激等长张力,这至少部分是由于%DRX肌球蛋白减少和钙依赖性粗丝激活。这些是第一个揭示收缩力低下的人类心脏行为的数据,并支持DRX/SRX平衡与心脏病收缩力的广泛相关性。最后,增加SL(预加载)会提高 %DRX,这可能有助于主动长度-张力关系的正斜率。这两个功能在HFrEF-PH中都被抑制了。以前的人类心力衰竭综合征中并未显示%DRX的长度依赖性募集下降。这些新结果为为人类心力衰竭综合征设计强肌素的持续努力提供了路线图,揭示了目标特定特征和%DRX的核心参与。 这项研究的临床意义在于提供了关于肺动脉高压患者右心室肌节功能损害的新见解。研究结果表明,在心力衰竭合并肺动脉高压的患者中,右心室肌节功能受损,导致心肌收缩力下降。此外,研究还揭示了肌节功能损害的潜在机制,即肌节激活过程中肌球蛋白头部可用性的减少。这些发现对于理解和诊断心力衰竭合并肺动脉高压的病理生理过程具有重要意义,为开发新的治疗策略和药物靶点提供了指导。进一步研究可能有助于发展针对右心室肌节功能损害的治疗方法,以改善肺动脉高压患者的预后和生活质量。 Jani V, Aslam MI, Fenwick AJ, Ma W, Gong H, Milburn G, Nissen D, Salazar IMC, Hanselman O, Mukherjee M, Halushka MK, Margulies KB, Campbell K, Irving TC, Kass DA, Hsu S. Right Ventricular Sarcomere Contractile Depression and the Role of Thick Filament Activation in Human Heart Failure With Pulmonary Hypertension. Circulation. 2023 May 17. doi: 10.1161/CIRCULATIONAHA.123.064717. Epub ahead of print. PMID: 37194598.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







受益匪浅
22