Sci Rep:ONECUT2过表达促进RAS驱动的肺腺癌进展
2020-01-10 xiangting MedSci原创
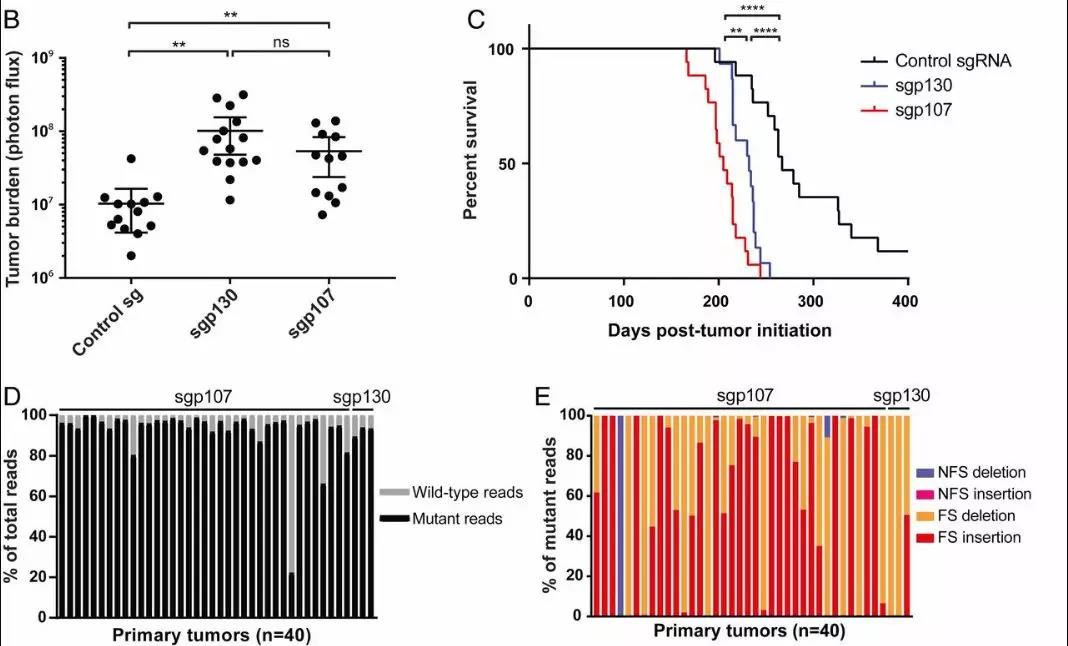
由正常沉默的组织-特异性基因激活驱动的异常分化导致细胞身份的转换,并通常导致癌症的进展。潜在的遗传和表观遗传学改变在很大程度上仍然未知。这里报告了肝胆、肠和神经特异性基因onecuthomeobox2(ONECUT2)在肺癌不同亚型中的异位激活。 ONECUT2表达与RAS驱动的肺腺癌预后不良相关。ONECUT2过表达在体外促进肿瘤生长和A549肺癌细胞的侵袭,在体内促进
由正常沉默的组织-特异性基因激活驱动的异常分化导致细胞身份的转换,并通常导致癌症的进展。潜在的遗传和表观遗传学改变在很大程度上仍然未知。这里报告了肝胆、肠和神经特异性基因onecuthomeobox2(ONECUT2)在肺癌不同亚型中的异位激活。
ONECUT2表达与RAS驱动的肺腺癌预后不良相关。ONECUT2过表达在体外促进肿瘤生长和A549肺癌细胞的侵袭,在体内促进这些细胞的异种移植肿瘤发生和骨转移。整合转录组学和表观基因组学分析表明,ONECUT2通过调节多梳抑制复合物2(PRC2)占位,优先靶向和调节二价染色质域的活性,从而促进肺癌细胞的转分化。
这项研究结果表明,ONECUT2是肺腺癌的系谱特异性和环境依赖性癌基因,并表明ONECUT2是这些肿瘤的潜在治疗靶标。
原始出处:
Qingyang
Ma. ONECUT2 overexpression promotes RAS-driven lung adenocarcinoma progression.
Sci Rep. 27 December 2019.
本文系梅斯医学(MedSci)原创编译整理,转载需授权!
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#NEC#
25
#过表达#
40